亚氯酸盐(如NaClO2)可作漂白剂,在常温、不见光条件下可保存一年,在酸性条件下发生反应:5ClO +4H+=4ClO2↑+Cl—+2H2O,开始时,反应非常慢,一段时间后,反应速率变快,对于该反应速率变快的原因,下列猜测最合理的是
+4H+=4ClO2↑+Cl—+2H2O,开始时,反应非常慢,一段时间后,反应速率变快,对于该反应速率变快的原因,下列猜测最合理的是
 +4H+=4ClO2↑+Cl—+2H2O,开始时,反应非常慢,一段时间后,反应速率变快,对于该反应速率变快的原因,下列猜测最合理的是
+4H+=4ClO2↑+Cl—+2H2O,开始时,反应非常慢,一段时间后,反应速率变快,对于该反应速率变快的原因,下列猜测最合理的是A.ClO 起催化作用 起催化作用 | B.H+起催化作用 |
| C.Cl—起催化作用 | D.ClO2的逸出 |
更新时间:2023-06-19 22:35:55
|
【知识点】 催化剂对化学反应速率的影响解读
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】二氧化碳甲烷化可以缓解能源危机。CO2在催化剂的作用下与H2制备甲烷的反应机理如图所示。下列说法错误的是
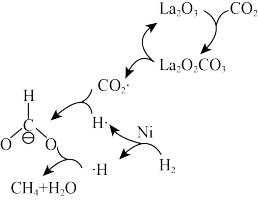

| A.Ni属于d区元素,Cu属于ds区元素 |
| B.Ni和La2O3是该反应的催化剂,二者不能改变反应物的平衡转化率 |
| C.H2→2H·的过程吸收热量,使用恰当的催化剂可以使该过程放热 |
D.该过程总反应的化学方程式为:4H2+CO2 CH4+2H2O CH4+2H2O |
您最近一年使用:0次
【推荐2】我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s—SnLi可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法错误的是


| A.放电时,每生成0.5molHCOO-,整个装置内转移0.5NA个电子 |
| B.使用催化剂Sn或者s—SnLi均能有效减少副产物CO的生成 |
| C.放电时,正极电极周围pH升高 |
| D.使用s—SnLi催化剂,中间产物更不稳定 |
您最近一年使用:0次

 浓度,活化分子百分数增大,单位时间生产效率提升
浓度,活化分子百分数增大,单位时间生产效率提升

