在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析下列一组有现象变化的化学反应。
(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:_______ 。
(2)Ⅲ中加碱时出现的现象是_______ 。
(3)Ⅳ中加酸时出现的现象是_______ ,用离子方程式解释产生此现象的原因:_______ 。
(4)滴加试剂顺序的变化会影响溶液中的现象和发生的反应。请继续分析以下实验。
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0mL0.1mol·L-1Fe(NO3)2溶液中_______ ,如果溶液变红色,说明溶液中含有Fe3+,证明加酸时溶液中发生了反应。(请将上述操作补充完整)
②推测溶液中产生Fe3+的可能原因有两种:
a._______ 。
b._______ 。
| 实验及操作 | 现象 | ||
| 装置 | 试管 | 滴管 | |
 | 饱和Na2SiO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol·L-1NaOH溶液;再滴加1.5mL1.0mol·L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol·L-1AlCl3溶液 | Ⅱ.加碱时_______;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol·L-1Fe(NO3)2溶液 | Ⅲ.加碱时_______;加酸后得到棕黄色溶液 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后_______ | ||
(2)Ⅲ中加碱时出现的现象是
(3)Ⅳ中加酸时出现的现象是
(4)滴加试剂顺序的变化会影响溶液中的现象和发生的反应。请继续分析以下实验。
| 实验及操作 | 现象 | ||
| 装置 | 试管 | 滴管 | |
 | 0.1mol·L-1Fe(NO3)2溶液 | 先滴加1.5mL1.0mol·L-1H2SO4溶液;再滴加1.0mL0.5mol·L-1NaOH溶液 | Ⅴ.加酸时溶液有明显现象;加碱后溶液依然没有明显变化 |
②推测溶液中产生Fe3+的可能原因有两种:
a.
b.
更新时间:2023-07-20 07:42:49
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并使用硫代硫酸钠溶液对氰化钠溶液进行统一解毒销毁。
实验I.实验室通过如图所示装置制备Na2S2O3晶体
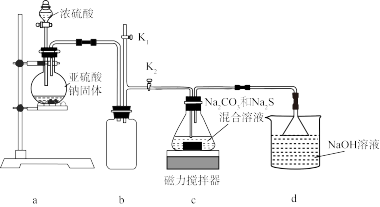
(1)盛装浓硫酸的仪器名称是_______ ,b装置的作用是_______ 。
(2)a装置中发生的化学反应方程式为_______ 。
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物可能是_______ (填化学式)。
(4)实验结束后,在e处最好连接盛_______ (填“NaOH溶液”“水”“CCl4”中的一种)的注射器。
实验Ⅱ.产品纯度的检测
(5)已知:Na2S2O3·5H2O的摩尔质量为248 g·mol-1;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品0.1000 g,加水溶解后,滴入几滴淀粉溶液,用0.01000 mol·L-1碘水滴定到终点时,消耗碘水溶液15.00 mL,则该样品的纯度是_______ 。(保留三位有效数字)
(6)滴定过程中可能造成实验结果偏高的是_______(填字母)。
实验Ⅲ.处理氰化钠溶液
(7)化学兴趣小组的同学配备了防毒口罩、橡胶手套和连体式胶布防毒衣等防护用具,在老师的指导下进行以下实验:向装有1.5mL 0.1mol/L的NaCN溶液的试管中滴加1.5mL 0.1mol/L的Na2S2O3溶液,两反应物恰好完全反应,但没有明显实验现象,取反应后的溶液少许滴入盛有10mL0.1mol/L FeCl3溶液的小烧杯中,溶液呈现血红色,请写出Na2S2O3解毒的离子方程式:_______ 。
实验I.实验室通过如图所示装置制备Na2S2O3晶体

(1)盛装浓硫酸的仪器名称是
(2)a装置中发生的化学反应方程式为
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物可能是
(4)实验结束后,在e处最好连接盛
实验Ⅱ.产品纯度的检测
(5)已知:Na2S2O3·5H2O的摩尔质量为248 g·mol-1;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品0.1000 g,加水溶解后,滴入几滴淀粉溶液,用0.01000 mol·L-1碘水滴定到终点时,消耗碘水溶液15.00 mL,则该样品的纯度是
(6)滴定过程中可能造成实验结果偏高的是_______(填字母)。
| A.锥形瓶未用Na2S2O3溶液润洗 |
| B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数 |
| C.滴定到终点时仰视读数 |
| D.滴定管尖嘴内滴定前无气泡,滴定到终点出现气泡 |
实验Ⅲ.处理氰化钠溶液
(7)化学兴趣小组的同学配备了防毒口罩、橡胶手套和连体式胶布防毒衣等防护用具,在老师的指导下进行以下实验:向装有1.5mL 0.1mol/L的NaCN溶液的试管中滴加1.5mL 0.1mol/L的Na2S2O3溶液,两反应物恰好完全反应,但没有明显实验现象,取反应后的溶液少许滴入盛有10mL0.1mol/L FeCl3溶液的小烧杯中,溶液呈现血红色,请写出Na2S2O3解毒的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】ZnO在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿[主要成分为ZnCO3,还含有Cd(II)、Fe(II)、Mn[(II)等杂质]制备。工艺如图所示:

已知:①相关金属离子[c(Mn+ )=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下表:
②“溶浸”后的溶液中金属离子主要有: Zn2+、 Fe2+、 Cd2+、 Mn2+。
③弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
回答下列问题:
(1)“溶浸”过程中,提高浸出率的措施有___________ 。(写一条即可)
(2)“调pH”是将“溶浸”后的溶液调节至弱酸性(pH约为5),若pH过低,对除杂的影响是___________ 。
(3)加KMnO4“氧化除杂”发生反应的离子方程式分别是2MnO +3Mn2++2H2O=5MnO2↓+4H+和
+3Mn2++2H2O=5MnO2↓+4H+和___________ 。
(4)“还原除杂”中镉置换率与 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。若需置换出112.0kgCd,且使镉置换率达到98%,实际加入的Zn应为
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。若需置换出112.0kgCd,且使镉置换率达到98%,实际加入的Zn应为___________ kg。

(5)“沉锌”生成碱式碳酸锌[ZnCO3·2Zn(OH)2·2H2O]沉淀,写出加入Na2CO3溶液沉锌的化学方程式___________ 。形成的沉淀要用水洗,检查沉淀是否洗涤干净的方法是___________ 。

已知:①相关金属离子[c(Mn+ )=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下表:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 | 8.1 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 | 10.1 |
③弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
回答下列问题:
(1)“溶浸”过程中,提高浸出率的措施有
(2)“调pH”是将“溶浸”后的溶液调节至弱酸性(pH约为5),若pH过低,对除杂的影响是
(3)加KMnO4“氧化除杂”发生反应的离子方程式分别是2MnO
 +3Mn2++2H2O=5MnO2↓+4H+和
+3Mn2++2H2O=5MnO2↓+4H+和(4)“还原除杂”中镉置换率与
 的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。若需置换出112.0kgCd,且使镉置换率达到98%,实际加入的Zn应为
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。若需置换出112.0kgCd,且使镉置换率达到98%,实际加入的Zn应为
(5)“沉锌”生成碱式碳酸锌[ZnCO3·2Zn(OH)2·2H2O]沉淀,写出加入Na2CO3溶液沉锌的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
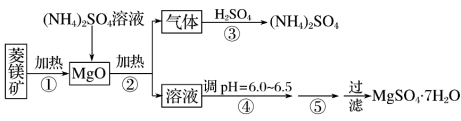
(1)步骤②中发生反应的离子方程式为__________________________________________ 。
(2)步骤④中调节pH=6.0~6.5的目的是_______________________________________ 。
(3)步骤⑤的操作为________________________________________________________ 。
(4)若要除去MgSO4溶液中的FeSO4应先加________ ,再加入过量__________ ,过滤即可把杂质除尽;请用离子方程式以及文字 说明除杂原理___________________________________
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
25 ℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________ (已知25 ℃时 ,Ksp[Mg(OH)2]=5.6×10-12 )。

(1)步骤②中发生反应的离子方程式为
(2)步骤④中调节pH=6.0~6.5的目的是
(3)步骤⑤的操作为
(4)若要除去MgSO4溶液中的FeSO4应先加
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化氯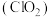 是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠
是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠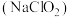 制备二氧化氯,装置如图:
制备二氧化氯,装置如图:
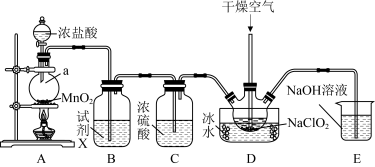
(1)仪器a的名称为_______ ,装置A中反应的离子方程式为_______ 。
(2)试剂X的作用是_______ 。
(3)装置D中通入干燥空气的作用是_______ 。
(4)该实验装置的缺陷是_______ 。
(5)E中发生反应的化学方程式为_______ 。
(6)漂白粉也有杀菌作用,工作原理用化学方程式表示为_______ 。
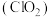 是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠
是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠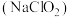 制备二氧化氯,装置如图:
制备二氧化氯,装置如图:
(1)仪器a的名称为
(2)试剂X的作用是
(3)装置D中通入干燥空气的作用是
(4)该实验装置的缺陷是
(5)E中发生反应的化学方程式为
(6)漂白粉也有杀菌作用,工作原理用化学方程式表示为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
真题
名校
【推荐2】废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图:
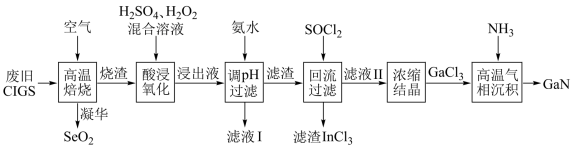
回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为___ ;镓(Ga)和铟(In)位于元素周期表第IIIA族,CuIn0.5Ga0.5Se2中Cu的化合价为___ 。
(2)“酸浸氧化”发生的主要氧化还原反应的化学方程式为____ 。
(3)25℃时,已知:Kb(NH3·H2O)≈2.0×10-5,Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,Ksp[Cu(OH)2]≈1.0×10-20,“浸出液”中c(Cu2+)=0.01mol·L-1。当金属阳离子浓度小于1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为___ (保留一位小数);若继续加入6.0mol·L-1氨水至过量,观察到的实验现象是先有蓝色沉淀,然后___ ;为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3+NH3·H2O [Ga(OH)4]-+NH
[Ga(OH)4]-+NH 的平衡常数K=
的平衡常数K=___ 。
(已知:Ga3++4OH- [Ga(OH)4]- K′=
[Ga(OH)4]- K′=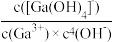 ≈1.0×1034)
≈1.0×1034)
(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO 是否洗净的试剂是
是否洗净的试剂是___ ;“回流过滤”中SOCl2的作用是将氢氧化物转化为氯化物和___ 。
(5)“高温气相沉积”过程中发生的化学反应方程式为___ 。

回答下列问题:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为
(2)“酸浸氧化”发生的主要氧化还原反应的化学方程式为
(3)25℃时,已知:Kb(NH3·H2O)≈2.0×10-5,Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,Ksp[Cu(OH)2]≈1.0×10-20,“浸出液”中c(Cu2+)=0.01mol·L-1。当金属阳离子浓度小于1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为
 [Ga(OH)4]-+NH
[Ga(OH)4]-+NH 的平衡常数K=
的平衡常数K=(已知:Ga3++4OH-
 [Ga(OH)4]- K′=
[Ga(OH)4]- K′=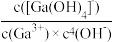 ≈1.0×1034)
≈1.0×1034)(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO
 是否洗净的试剂是
是否洗净的试剂是(5)“高温气相沉积”过程中发生的化学反应方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】某化学小组在实验室中模拟利用高浓度 气体(含
气体(含 、
、 )制备
)制备 、
、 。具体流程如下:
。具体流程如下:
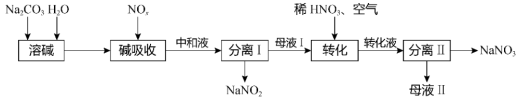
回答下列问题:
(1)用氨氧化法制备 气体,写出制备
气体,写出制备 的化学方程式
的化学方程式_______ 。
(2)“碱吸收”过程,若 、
、 按物质的量之比
按物质的量之比 被
被 溶液吸收,反应的化学方程式是
溶液吸收,反应的化学方程式是_______ 。为提高吸收速率与效率,最好选用_______ 装置(填序号)。

(3)“分离I”包括_______ 、过滤等操作,分离过程中产生的气态排放物中含有少量的 等有害物质,不能直接排放,冷凝后将其导入
等有害物质,不能直接排放,冷凝后将其导入_______ (填操作单元的名称)最合理。
(4)“转化”过程,加入 、通入空气的目的是
、通入空气的目的是_______ 。
(5)若将 、
、 两种产品的物质的量之比设为
两种产品的物质的量之比设为 ,则生产
,则生产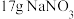 时,
时, 的理论用量是
的理论用量是_______ g。
 气体(含
气体(含 、
、 )制备
)制备 、
、 。具体流程如下:
。具体流程如下:
回答下列问题:
(1)用氨氧化法制备
 气体,写出制备
气体,写出制备 的化学方程式
的化学方程式(2)“碱吸收”过程,若
 、
、 按物质的量之比
按物质的量之比 被
被 溶液吸收,反应的化学方程式是
溶液吸收,反应的化学方程式是
(3)“分离I”包括
 等有害物质,不能直接排放,冷凝后将其导入
等有害物质,不能直接排放,冷凝后将其导入(4)“转化”过程,加入
 、通入空气的目的是
、通入空气的目的是(5)若将
 、
、 两种产品的物质的量之比设为
两种产品的物质的量之比设为 ,则生产
,则生产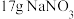 时,
时, 的理论用量是
的理论用量是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
I.(1)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验溶液是否被氧化的方法:_______ 。
II.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备绿矾FeSO4·7H2O的流程如下:
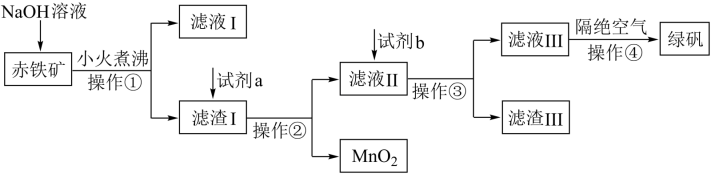
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_______ 。
(3)向滤渣I中加入过量的试剂a为_______ ,试剂b要加入过量,试剂b为_______ 。
(4)操作④隔绝空气的目的是_______ 。
Ⅲ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2是_______ (填氧化剂、还原剂),与CO2反应的化学反应方程式_______ 。
(6)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_______ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为_______ mol。
I.(1)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验溶液是否被氧化的方法:
II.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备绿矾FeSO4·7H2O的流程如下:

(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为
(3)向滤渣I中加入过量的试剂a为
(4)操作④隔绝空气的目的是
Ⅲ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2是
(6)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】已知:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验。请回答下列问题:
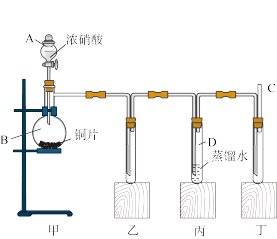
(1)装置甲中盛放浓硝酸的仪器A的名称是_______ 。
(2)实验过程中,装置乙、丙中出现的现象分别是:_______ 、_______ ;装置丙中的试管内发生反应的离子方程式为_______ 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是_______ 。
(4)为了探究NO2的氧化性,取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为_______ 色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为_______ 色。

(1)装置甲中盛放浓硝酸的仪器A的名称是
(2)实验过程中,装置乙、丙中出现的现象分别是:
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是
(4)为了探究NO2的氧化性,取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】2019年人教版新教材《化学必修1》新增了“研究与实践”栏目,在“检验食品中铁元素”的研究实践中设置了菠菜中铁元素的检测。某实验小组对菠菜中的铁元素(主要以难溶的 形式存在)进行检测。实验如下:
形式存在)进行检测。实验如下:
I.水煮检验法:

II.灼烧检验法:
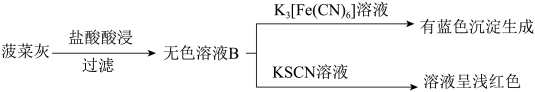
(1)CCl4的作用为_______ 。
(2)操作 中起分离作用的仪器名称为
中起分离作用的仪器名称为_______ 。
(3)溶液A中未能检测出 的可能原因是
的可能原因是_______ 。
(4)取无色溶液B,先滴加 溶液,再滴加KSCN溶液,溶液呈红色。用离子方程式表示
溶液,再滴加KSCN溶液,溶液呈红色。用离子方程式表示 的作用
的作用_______ 。
(5)甲同学取少量无色溶液B,滴加酸性 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有
溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有 。乙同学认为甲同学的实验方法不严谨,理由是
。乙同学认为甲同学的实验方法不严谨,理由是 _______ 。
(6)菠菜中铁元素的含量可以用 表达,即每100g菠菜中含铁元素的含量是多少mg。
表达,即每100g菠菜中含铁元素的含量是多少mg。 可以通过
可以通过 标准溶液进行滴定的方法来测定,准确称取
标准溶液进行滴定的方法来测定,准确称取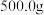 菠菜样品,充分燃烧成灰,经处理后将所得溶液转移到250mL容量瓶中并定容;从中取出
菠菜样品,充分燃烧成灰,经处理后将所得溶液转移到250mL容量瓶中并定容;从中取出 待测液置于锥形瓶中,再用
待测液置于锥形瓶中,再用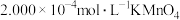 标准溶液进行滴定,当滴入
标准溶液进行滴定,当滴入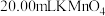 溶液时恰好完全反应。菠菜中铁元素的含量为
溶液时恰好完全反应。菠菜中铁元素的含量为_______  。(保留3位有效数字)
。(保留3位有效数字)
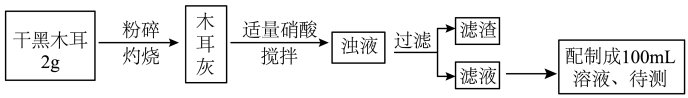
III.木耳中也富含铁元素。下图是检验黑木耳中的铁元素并测定其含量的实验流程图。
(一)定性检验
(7)粉碎后的黑木耳应置于_______ (填仪器名称)中灼烧。取3滴待测液滴在点滴板上,加几滴_______ (填化学式)溶液,若出现_______ 的现象,则此溶液中存在 。
。
(二)定量测定
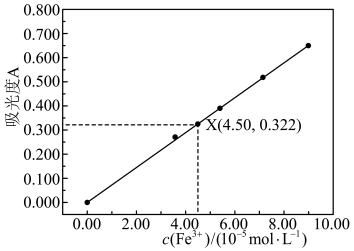
(8)已知溶液的吸光度A与溶液中c(Fe3+)关系如下图。从上述 溶液中取出
溶液中取出 待测液,测得待测液吸光度位于图中X点,试计算该黑木耳中铁元素的含量
待测液,测得待测液吸光度位于图中X点,试计算该黑木耳中铁元素的含量_______ (mg/100g)。
 形式存在)进行检测。实验如下:
形式存在)进行检测。实验如下: I.水煮检验法:

II.灼烧检验法:

(1)CCl4的作用为
(2)操作
 中起分离作用的仪器名称为
中起分离作用的仪器名称为(3)溶液A中未能检测出
 的可能原因是
的可能原因是(4)取无色溶液B,先滴加
 溶液,再滴加KSCN溶液,溶液呈红色。用离子方程式表示
溶液,再滴加KSCN溶液,溶液呈红色。用离子方程式表示 的作用
的作用(5)甲同学取少量无色溶液B,滴加酸性
 溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有
溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有 。乙同学认为甲同学的实验方法不严谨,理由是
。乙同学认为甲同学的实验方法不严谨,理由是 (6)菠菜中铁元素的含量可以用
 表达,即每100g菠菜中含铁元素的含量是多少mg。
表达,即每100g菠菜中含铁元素的含量是多少mg。 可以通过
可以通过 标准溶液进行滴定的方法来测定,准确称取
标准溶液进行滴定的方法来测定,准确称取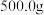 菠菜样品,充分燃烧成灰,经处理后将所得溶液转移到250mL容量瓶中并定容;从中取出
菠菜样品,充分燃烧成灰,经处理后将所得溶液转移到250mL容量瓶中并定容;从中取出 待测液置于锥形瓶中,再用
待测液置于锥形瓶中,再用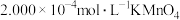 标准溶液进行滴定,当滴入
标准溶液进行滴定,当滴入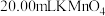 溶液时恰好完全反应。菠菜中铁元素的含量为
溶液时恰好完全反应。菠菜中铁元素的含量为 。(保留3位有效数字)
。(保留3位有效数字)III.木耳中也富含铁元素。下图是检验黑木耳中的铁元素并测定其含量的实验流程图。

(一)定性检验
(7)粉碎后的黑木耳应置于
 。
。(二)定量测定
(8)已知溶液的吸光度A与溶液中c(Fe3+)关系如下图。从上述
 溶液中取出
溶液中取出 待测液,测得待测液吸光度位于图中X点,试计算该黑木耳中铁元素的含量
待测液,测得待测液吸光度位于图中X点,试计算该黑木耳中铁元素的含量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】我国自主研发的万米载人潜水器“奋斗者”号,在马里亚纳海沟执行深渊科学考察任务期间,创造了我国载人深潜的新纪录。过氧化钠可用作呼吸面具和潜水艇的供氧剂。请你选用适当的化学试剂和下列实验装置进行实验,证明过氧化钠可作供氧剂。
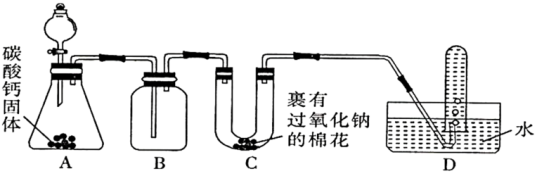
已知:实验室提供的试剂仅有 、稀硫酸、稀盐酸、饱和
、稀硫酸、稀盐酸、饱和 溶液、过氧化钠、碱石灰,且每种试剂最多选用一次。
溶液、过氧化钠、碱石灰,且每种试剂最多选用一次。
(1)仪器A中发生反应的离子方程式为_______ 。
(2)仪器B中装有_______ (填试剂名称),其作用是_______ 。
(3)写出C中发生反应的化学方程式:_______ 。
(4)有同学认为装置C、D直接相连使实验设计不够严谨,改进的措施为_______ ,其作用是_______ 。
(5)用_______ 检验D中试管收集到的气体,现象是_______ 。

已知:实验室提供的试剂仅有
 、稀硫酸、稀盐酸、饱和
、稀硫酸、稀盐酸、饱和 溶液、过氧化钠、碱石灰,且每种试剂最多选用一次。
溶液、过氧化钠、碱石灰,且每种试剂最多选用一次。(1)仪器A中发生反应的离子方程式为
(2)仪器B中装有
(3)写出C中发生反应的化学方程式:
(4)有同学认为装置C、D直接相连使实验设计不够严谨,改进的措施为
(5)用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Na2CO3和NaHCO3是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I:
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10 mL水,充分振荡,再分别加入几滴酚酞试液,溶液红色较深的是_______ 。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图组装好仪器(A为大试管,B为小试管),试管A中盛放的药品是_______ ,澄清石灰水变混浊的是_______ (填“a”或“b”),写出固体受热分解的化学方程式_______ 。
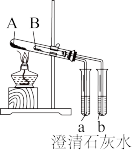
实验I:
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10 mL水,充分振荡,再分别加入几滴酚酞试液,溶液红色较深的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图组装好仪器(A为大试管,B为小试管),试管A中盛放的药品是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置)
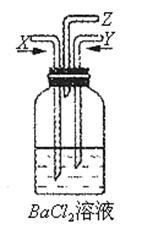
请回答下列问题
(1)气体X的主要成分有____________ 。(写化学式)
(2)洗气瓶中的反应现象为_____________ 。用文字简要解释产生上述实验现象的原因:_______________________ 。
(3)管口Z处的现象是_________________ ,产生此现象的原因是_______________ 。(用化学方程式表示)

请回答下列问题
(1)气体X的主要成分有
(2)洗气瓶中的反应现象为
(3)管口Z处的现象是
您最近一年使用:0次



