铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。下列叙述错误的是
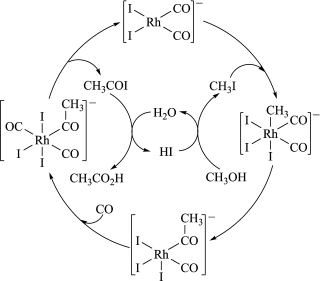

| A.CH3COI是反应中间体 |
| B.甲醇羰基化反应为CH3OH+CO=CH3CO2H |
| C.反应过程中Rh的成键数目保持不变 |
| D.增大CH3OH的浓度,可以增大单位体积内活化分子数 |
更新时间:2023-09-16 09:21:06
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列说法正确的是
| A.增大压强,活化分子数增加,化学反应速率一定增大 |
| B.常温下,反应C(s)+CO2 (g)=2CO(g)不能自发进行,则该反应的∆H>0 |
| C.加入反应物,使活化分子百分数增加,化学反应速率一定增大 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照的点燃条件下的∆H不同 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列有关有效碰撞理论和化学反应方向的认识,不正确的是
| A.自发进行的化学反应的方向,应由焓判据和熵判据的复合判据来判断 |
| B.增大反应物浓度,活化分子百分数增加,有效碰撞次数增多,故反应速率增大 |
| C.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的△H>0,ΔS>0 |
| D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多,故反应速率增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
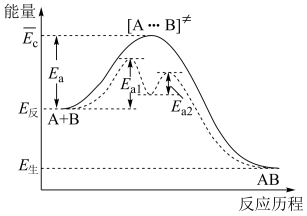
【推荐1】甲酸常被用于橡胶、医药等工业,一定条件下可分解生成CO和H2O。在无催化剂和有催化剂的条件下,能量与反应历程的关系分别如图1、图2所示。下列说法错误的是
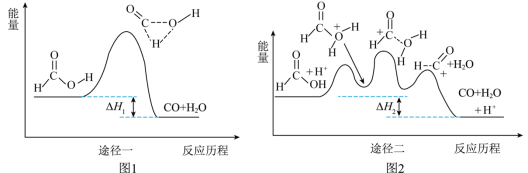

| A.途径一和途径二中均涉及了极性键的断裂和生成 |
| B.ΔH1<ΔH2<0 |
| C.途径二使用了H+作为催化剂 |
D.途径二反应的快慢由生成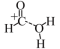 的速率决定 的速率决定 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】科学家结合实验与计算机模拟结果,研究出了均相催化的思维模型。总反应: (
( 为催化剂)①
为催化剂)①
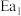 ,②
,②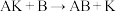
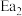
 (
( 为催化剂)①
为催化剂)①
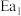 ,②
,②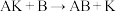
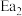
| A.第①步为决速步骤 |
| B.升高温度,该反应的速率加快 |
C.该反应的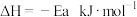 |
| D.加入催化剂,不能改变该化学反应的反应热 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】工业生产硝酸过程中,反应Ⅰ、Ⅱ均会在氧化炉内发生。不同温度下,反应Ⅰ、Ⅱ的化学平衡常数如下表所示。下列说法正确的是
| 温度(K) | 化学平衡常数 | |
反应Ⅰ: | 反应Ⅱ: | |
| 500 | 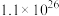 | 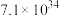 |
| 700 | 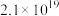 | 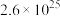 |
A.反应Ⅰ、Ⅱ的 均大于0 均大于0 |
B.相同条件下, 与 与 反应,生成NO的趋势比生成 反应,生成NO的趋势比生成 趋势更大 趋势更大 |
| C.改变氧化炉的压强可促进反应Ⅰ而抑制反应Ⅱ |
| D.使用选择性催化反应Ⅰ的催化剂,可增大氧化炉中NO的含量 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是
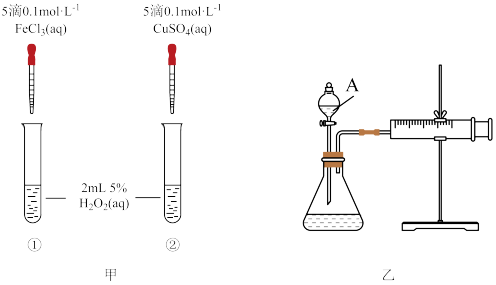

| A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
| C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D.相同环境下若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
您最近一年使用:0次

 历程如图所示,其中吸附在催化剂表面上的物种用*标注。
历程如图所示,其中吸附在催化剂表面上的物种用*标注。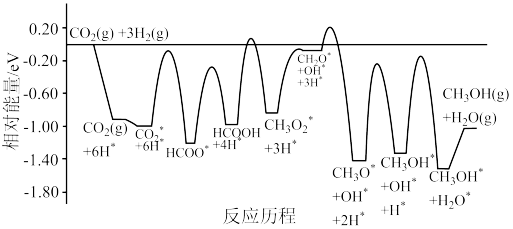
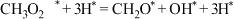
 从催化剂表面的解吸过程,该过程的
从催化剂表面的解吸过程,该过程的
 )催化氧化脱氢反应历程如下图。下列说法
)催化氧化脱氢反应历程如下图。下列说法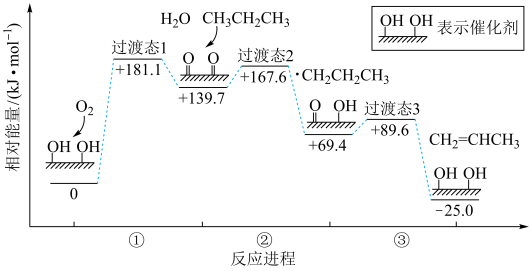
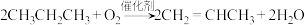
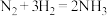 ,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是 能
能 转化为
转化为

