下列有关说法不正确的是
A.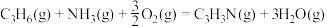 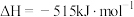 和 和 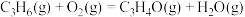 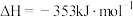 ,两个反应在热力学上趋势均很大 ,两个反应在热力学上趋势均很大 |
B. 与 与 的反应是熵增加的放热反应,该反应能正向自发进行 的反应是熵增加的放热反应,该反应能正向自发进行 |
C.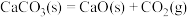 在室温下不能自发进行,说明该反应 在室温下不能自发进行,说明该反应 |
D. 在室温下能自发进行,则该反应 在室温下能自发进行,则该反应 |
更新时间:2023-10-11 16:53:52
|
相似题推荐
【推荐1】 催化
催化 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:
第1步: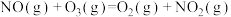
 ;
;
第2步: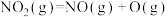
 ;
;
第3步:
 。
。
下列说法正确的是
 催化
催化 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:
第1步:
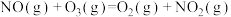
 ;
;第2步:
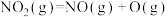
 ;
;第3步:

 。
。下列说法正确的是
| A.三步基元反应都是放热反应 |
| B.第1步是总反应的决速步 |
| C.该过程共有三种中间产物 |
D.总反应 的焓变为 的焓变为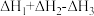 |
您最近一年使用:0次
单选题
|
适中
(0.65)
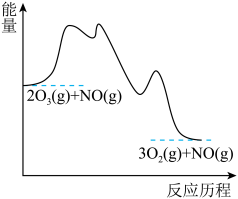
【推荐2】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为①N2O+Fe+===N2+FeO+(慢)、②FeO++CO===CO2+Fe+(快)。下列说法错误的是
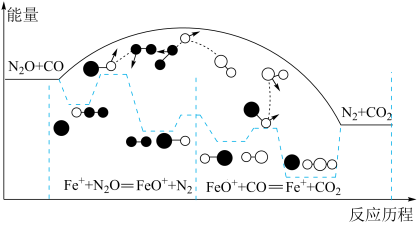

| A.反应①②都是氧化还原反应 |
| B.两步反应均为放热反应,总反应的化学反应速率由反应①决定 |
| C.Fe+使反应的活化能减小,FeO+是中间产物 |
| D.若转移1mol电子,则消耗11.2LN2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知:①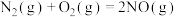 △H1 =+180.5kJ/mol ;
△H1 =+180.5kJ/mol ;
②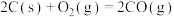 △H2 =—221.0kJ/mol;
△H2 =—221.0kJ/mol;
③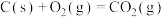 △H3 =—393.5kJ/mol
△H3 =—393.5kJ/mol
则能表示汽车尾气转化的热化学方程式为( )
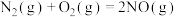 △H1 =+180.5kJ/mol ;
△H1 =+180.5kJ/mol ;②
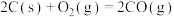 △H2 =—221.0kJ/mol;
△H2 =—221.0kJ/mol;③
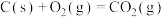 △H3 =—393.5kJ/mol
△H3 =—393.5kJ/mol则能表示汽车尾气转化的热化学方程式为( )
A. △H =+746.5kJ/mol △H =+746.5kJ/mol |
B. △H =—746.5kJ/mol △H =—746.5kJ/mol |
C. △H =—1493kJ/mol △H =—1493kJ/mol |
D. △H =+1493kJ/mol △H =+1493kJ/mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g) CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确 的是

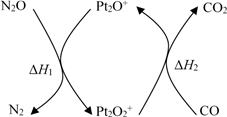
 CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法

| A.ΔH = ΔH1 + ΔH2 |
| B.ΔH = −226 kJ/mol |
| C.该反应正反应的活化能小于逆反应的活化能 |
| D.为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列有关化学反应方向及其判据的说法中错误的是( )
| A.1 mol H2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)] |
| B.自发反应的熵一定增大,非自发反应的熵一定减小 |
| C.反应:CaCO3(s)=CaO(s)+CO2(g)能否自发进行,主要由ΔS>0决定 |
| D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行是因为体系有自发地向混乱度增大的方向转变的倾向 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
| A.熵增的反应都是自发的,自发反应的现象一定非常明显 |
| B.应该投入大量资金研究2CO(g)→2C(s)+O2(g) ΔH>0该过程发生的条件,以解决含碳燃料不充分燃烧引起的环境问题 |
| C.常温下,若反应A(s)+B(g)=C(g)+D(g)不能自发进行,则该反应的ΔH>0 |
| D.已知C(s)+CO2(g)=2CO(g) ΔH>0,该反应吸热,一定不能自发进行 |
您最近一年使用:0次
【推荐3】一定温度下,在两个容积均为1L的密闭容器中,充入一定量的反应物,发生反应:
 。相关反应数据如下表所示:
。相关反应数据如下表所示:
下列说法正确的是

 。相关反应数据如下表所示:
。相关反应数据如下表所示:| 容器编号 | 温度/℃ | 起始物质的量/mol | 10s时物质的量/mol | |
| NO | CO |  | ||
| Ⅰ |  | 0.2 | 0.2 | 0.05 |
| Ⅱ | 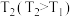 | 0.2 | 0.2 | 0.05 |
A.前10s,容器Ⅰ中的化学反应速率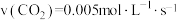 |
| B.该反应在任何温度下均能自发进行 |
| C.10s时,容器Ⅰ中的反应一定处于平衡状态 |
D.若向容器Ⅱ中再充入0.08mol NO和 ,反应将向正反应方向进行 ,反应将向正反应方向进行 |
您最近一年使用:0次

 在
在 ,101KPa条件下,液态水气化热为40.69kJ/mol,则
,101KPa条件下,液态水气化热为40.69kJ/mol,则
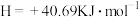
 已知
已知 时,
时, 的
的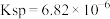 ,则在该温度下,含有固体
,则在该温度下,含有固体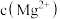 与
与 是否相等,总有
是否相等,总有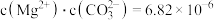
 已知:
已知: 
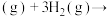

 常温下,在
常温下,在 的
的 溶液中加入少量
溶液中加入少量 晶体,则
晶体,则

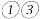
 2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol−1①
2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol−1①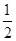 O2(g)
O2(g)

