完成下列各题。
(1)按如图所示操作,充分反应后:
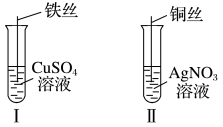
①Ⅰ中发生反应的离子方程式为_____ 。
②Ⅱ中铜丝上观察到现象是_____ 。
③结合Ⅰ、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_____ 。
(2)人体内的铁元素以 和
和 的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含
的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含 的亚铁盐,如硫酸亚铁。服用维生素
的亚铁盐,如硫酸亚铁。服用维生素 ,可使食物中的
,可使食物中的 还原成
还原成 ,有利于人体吸收。这句话说明维生素
,有利于人体吸收。这句话说明维生素 在这一反应中起的作用是
在这一反应中起的作用是_____ 。
(3)实验室可以用铜和稀硝酸反应制取 ,反应的化学方程式如下(未配平):
,反应的化学方程式如下(未配平):
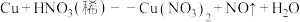
①写出配平后的上述化学方程式:_____ 。
②该反应中,被还原的硝酸与未被还原的硝酸质量比为_____ 。
(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为
②Ⅱ中铜丝上观察到现象是
③结合Ⅰ、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(2)人体内的铁元素以
 和
和 的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含
的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含 的亚铁盐,如硫酸亚铁。服用维生素
的亚铁盐,如硫酸亚铁。服用维生素 ,可使食物中的
,可使食物中的 还原成
还原成 ,有利于人体吸收。这句话说明维生素
,有利于人体吸收。这句话说明维生素 在这一反应中起的作用是
在这一反应中起的作用是(3)实验室可以用铜和稀硝酸反应制取
 ,反应的化学方程式如下(未配平):
,反应的化学方程式如下(未配平):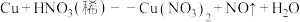
①写出配平后的上述化学方程式:
②该反应中,被还原的硝酸与未被还原的硝酸质量比为
更新时间:2023-10-25 22:26:04
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】下文描述的是工业制取盐酸的简单流程:
工业制备 主要采用电解法。
主要采用电解法。 经精制后,得到
经精制后,得到 ,溶于水配制成饱和
,溶于水配制成饱和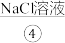 ,通电电解,除得到
,通电电解,除得到 外,在阴极有
外,在阴极有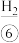 产生,阳极有
产生,阳极有 产生。在反应器中将H2和Cl2通至石英(主要成分为
产生。在反应器中将H2和Cl2通至石英(主要成分为 )制的烧嘴处点火燃烧,生成
)制的烧嘴处点火燃烧,生成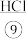 ,并放出大量热,HCl冷却后被水吸收成为盐酸。
,并放出大量热,HCl冷却后被水吸收成为盐酸。
按要求回答下列问题:
(1)在上述制取盐酸的方法中,有9个标有序号的物质,其中属于混合物的是_____ (填标号,下同);属于电解质的是_____ ;属于非电解质的是_____ 。
(2)请简单描述⑥在⑦中燃烧的现象:_____ 。
(3)写出③在水中的电离方程式:_____ 。
(4)写出CO2与过量的⑤的水溶液反应的离子方程式:_____ 。
工业制备
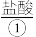 主要采用电解法。
主要采用电解法。 经精制后,得到
经精制后,得到 ,溶于水配制成饱和
,溶于水配制成饱和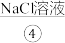 ,通电电解,除得到
,通电电解,除得到 外,在阴极有
外,在阴极有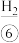 产生,阳极有
产生,阳极有 产生。在反应器中将H2和Cl2通至石英(主要成分为
产生。在反应器中将H2和Cl2通至石英(主要成分为 )制的烧嘴处点火燃烧,生成
)制的烧嘴处点火燃烧,生成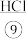 ,并放出大量热,HCl冷却后被水吸收成为盐酸。
,并放出大量热,HCl冷却后被水吸收成为盐酸。按要求回答下列问题:
(1)在上述制取盐酸的方法中,有9个标有序号的物质,其中属于混合物的是
(2)请简单描述⑥在⑦中燃烧的现象:
(3)写出③在水中的电离方程式:
(4)写出CO2与过量的⑤的水溶液反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氯的许多化合物是高效广谱的消毒剂,同时又是生产中重要的化工原料。回答下列问题:
(1)NaClO溶液能够杀灭新冠病毒的原因是_______ ,为了较长时间保持NaClO溶液的杀菌能力,NaClO溶液应密闭避光保存的原因是_______ 。
(2)已知HClO的电离能力远低于H2SO3的电离能力,写出NaClO溶液中通入少量SO2过程中发生的离子反应方程式为_______ 。
(3)ClO2常温下为橘黄色气体,性质不稳定,易引起爆炸,若用稀有气体或N2、CO2等稀释时,爆炸性则大大降低。ClO2可由KClO3和草酸(H2C2O4)混合物中加入足量的稀硫酸水浴加热制得。
①用H2C2O4溶液、稀硫酸和KClO3制备ClO2最大优点是_______ 。
②工业废水中Mn2+常用ClO2处理,将Mn2+转化为MnO2,氯元素转化为无毒离子。写出除去Mn2+的离子方程式_______ 。
③纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物与稀硫酸、NaClO3反应生成。完全反应的化学方程式:_______ 。
(4)ClO2也可以亚氯酸钠和稀盐酸为原料制备,写出该反应的化学方程式:_______ 。在上述过程中会发生副反应:NaClO2+4HCl=NaCl+2Cl2↑+2H2O,研究表明,产生的Cl2的含量随盐酸溶液的浓度有如图变化关系,推测其原因是_______ 。

(1)NaClO溶液能够杀灭新冠病毒的原因是
(2)已知HClO的电离能力远低于H2SO3的电离能力,写出NaClO溶液中通入少量SO2过程中发生的离子反应方程式为
(3)ClO2常温下为橘黄色气体,性质不稳定,易引起爆炸,若用稀有气体或N2、CO2等稀释时,爆炸性则大大降低。ClO2可由KClO3和草酸(H2C2O4)混合物中加入足量的稀硫酸水浴加热制得。
①用H2C2O4溶液、稀硫酸和KClO3制备ClO2最大优点是
②工业废水中Mn2+常用ClO2处理,将Mn2+转化为MnO2,氯元素转化为无毒离子。写出除去Mn2+的离子方程式
③纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物与稀硫酸、NaClO3反应生成。完全反应的化学方程式:
(4)ClO2也可以亚氯酸钠和稀盐酸为原料制备,写出该反应的化学方程式:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】自然界中的局部氮循环如下图所示。
(1)氮气的电子式为___________ 。
(2)上图各含氮物质的转化途径中,属于氮的固定的是___________ (填数字序号)。
(3)NH3是氮循环中的重要物质,工业合成NH3的化学方程式为___________ 。
(4)某化工厂出现泄蹈,大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH上升,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是___________ (填标号)。
A.循环水的pH上升与氨水的碱性有关
B.过量氨进入循环水后,不会导致水体富营养化
C.过量氨进入循环水后,水中 和
和 含量会升高
含量会升高
D.为减少氨对杀菌剂杀菌效果的影响,可以改用非氧化性杀菌剂
②通过检测循环水中的c( )可判断循环水的水质是否恶化,c(
)可判断循环水的水质是否恶化,c( )检测利用的是酸性条件下I-被
)检测利用的是酸性条件下I-被 氧化为I2,同时生成的气体遇空气变红棕色,该反应的离子方程式为
氧化为I2,同时生成的气体遇空气变红棕色,该反应的离子方程式为___________ 。
(5)含 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:___________ 。
___________ +___________ FeS2+___________ H+
+___________ FeS2+___________ H+ ___________N2↑+___________
___________N2↑+___________  +___________ Fe3+___________
+___________ Fe3+___________
该反应中被氧化的物质为___________ 。
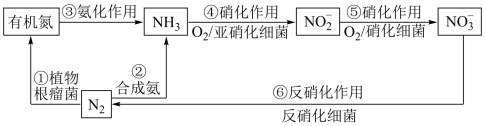
(1)氮气的电子式为
(2)上图各含氮物质的转化途径中,属于氮的固定的是
(3)NH3是氮循环中的重要物质,工业合成NH3的化学方程式为
(4)某化工厂出现泄蹈,大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH上升,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是
A.循环水的pH上升与氨水的碱性有关
B.过量氨进入循环水后,不会导致水体富营养化
C.过量氨进入循环水后,水中
 和
和 含量会升高
含量会升高D.为减少氨对杀菌剂杀菌效果的影响,可以改用非氧化性杀菌剂
②通过检测循环水中的c(
 )可判断循环水的水质是否恶化,c(
)可判断循环水的水质是否恶化,c( )检测利用的是酸性条件下I-被
)检测利用的是酸性条件下I-被 氧化为I2,同时生成的气体遇空气变红棕色,该反应的离子方程式为
氧化为I2,同时生成的气体遇空气变红棕色,该反应的离子方程式为(5)含
 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:___________
 +___________ FeS2+___________ H+
+___________ FeS2+___________ H+ ___________N2↑+___________
___________N2↑+___________  +___________ Fe3+___________
+___________ Fe3+___________该反应中被氧化的物质为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可替代的。
I.属于同一类的物质具有相似性,在生活和学习中,使用分类的方法处理问题可以做到举一反三,还可以做到由此及彼的效果。
(1) 、
、 、
、 、
、 都属于酸性氧化物,由
都属于酸性氧化物,由 ,可得出
,可得出 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2) 、
、 、
、 都属于非强酸形成的酸式盐,由
都属于非强酸形成的酸式盐,由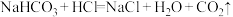 、
、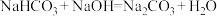 ,完成
,完成 分别与
分别与 、
、 反应的化学方程式
反应的化学方程式___________ 、___________ 。
II.现有物质:①铜②干冰③盐酸④液态醋酸⑤蔗糖⑥ 固体⑦
固体⑦ 溶液⑧熔融的
溶液⑧熔融的
(3)能导电的是:___________ ,属于电解质的是:___________ 。
(4)将 固体溶于水,写出
固体溶于水,写出 的电离方程式:
的电离方程式:___________ 。
(5)按要求写出下列物质间反应的离子反应方程式:
①向 溶液中加入
溶液中加入 溶液
溶液___________ 。
②向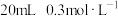 的
的 溶液中加入
溶液中加入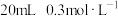 的
的 溶液,反应的离子方程式:
溶液,反应的离子方程式:___________ ﹔继续加入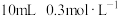 的
的 溶液,反应的离子方程式:
溶液,反应的离子方程式:___________ 。
III.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(6)下图为离子反应、氧化还原反应和置换反应三者间的关系,其中表示离子反应的是___________ (填字母)。

(7)有同学认为所有酸碱中和反应均可表示为 。请举个例子反驳上述观点(用离子方程式表示)
。请举个例子反驳上述观点(用离子方程式表示)___________ 。
(8)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理: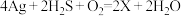 。则
。则 的化学式是
的化学式是______ 。其中 是该反应的
是该反应的______ (填字母)。
A.氧化剂B.还原剂
C.既是氧化剂又是还原剂D.既不是氧化剂也不是还原剂
I.属于同一类的物质具有相似性,在生活和学习中,使用分类的方法处理问题可以做到举一反三,还可以做到由此及彼的效果。
(1)
 、
、 、
、 、
、 都属于酸性氧化物,由
都属于酸性氧化物,由 ,可得出
,可得出 与
与 反应的化学方程式为
反应的化学方程式为(2)
 、
、 、
、 都属于非强酸形成的酸式盐,由
都属于非强酸形成的酸式盐,由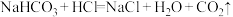 、
、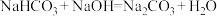 ,完成
,完成 分别与
分别与 、
、 反应的化学方程式
反应的化学方程式II.现有物质:①铜②干冰③盐酸④液态醋酸⑤蔗糖⑥
 固体⑦
固体⑦ 溶液⑧熔融的
溶液⑧熔融的
(3)能导电的是:
(4)将
 固体溶于水,写出
固体溶于水,写出 的电离方程式:
的电离方程式:(5)按要求写出下列物质间反应的离子反应方程式:
①向
 溶液中加入
溶液中加入 溶液
溶液②向
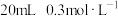 的
的 溶液中加入
溶液中加入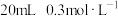 的
的 溶液,反应的离子方程式:
溶液,反应的离子方程式: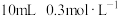 的
的 溶液,反应的离子方程式:
溶液,反应的离子方程式:III.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(6)下图为离子反应、氧化还原反应和置换反应三者间的关系,其中表示离子反应的是

(7)有同学认为所有酸碱中和反应均可表示为
 。请举个例子反驳上述观点(用离子方程式表示)
。请举个例子反驳上述观点(用离子方程式表示)(8)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:
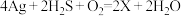 。则
。则 的化学式是
的化学式是 是该反应的
是该反应的A.氧化剂B.还原剂
C.既是氧化剂又是还原剂D.既不是氧化剂也不是还原剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氧化还原反应是一类非常重要的反应。回答下列问题:
(1)按如图所示操作,充分反应后:

①中发生反应的离子方程式为_______ ;
②Ⅱ中铜丝上观察到的现象是_______ ;
③结合Ⅰ、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应: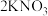
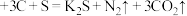 。其中氧化产物是
。其中氧化产物是_______ 。
(3)人体内的铁元素是以 和
和 的形式存在。
的形式存在。 易被人体吸收,服用维生素C,可使
易被人体吸收,服用维生素C,可使 转化成
转化成 ,有利于人体吸收,说明维生素C具有
,有利于人体吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
(1)按如图所示操作,充分反应后:

①中发生反应的离子方程式为
②Ⅱ中铜丝上观察到的现象是
③结合Ⅰ、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:
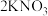
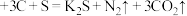 。其中氧化产物是
。其中氧化产物是(3)人体内的铁元素是以
 和
和 的形式存在。
的形式存在。 易被人体吸收,服用维生素C,可使
易被人体吸收,服用维生素C,可使 转化成
转化成 ,有利于人体吸收,说明维生素C具有
,有利于人体吸收,说明维生素C具有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】钠是一种非常活泼、具有广泛应用的金属。
(1)钠的原子结构示意图为_______ ,钠在反应中容易_______ 电子(填“得到”或“失去”)。
(2)某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。
ⅰ.当汽车发生较严重的碰撞时,引发NaN3分解:2NaN3 = 2Na + 3N2,从而为气囊充气。其中Na是_______ (填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。
ⅱ.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是_______ 。
ⅲ.NaHCO3是冷却剂,吸收产气过程释放的热量。NaHCO3起冷却作用时发生反应的化学方程式为_______ 。
ⅳ.一个安全气囊通常装有50 g NaN3,其完全分解所释放的N2为_______ g。 (保留小数点后一位。)
(1)钠的原子结构示意图为
(2)某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。
ⅰ.当汽车发生较严重的碰撞时,引发NaN3分解:2NaN3 = 2Na + 3N2,从而为气囊充气。其中Na是
ⅱ.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是
ⅲ.NaHCO3是冷却剂,吸收产气过程释放的热量。NaHCO3起冷却作用时发生反应的化学方程式为
ⅳ.一个安全气囊通常装有50 g NaN3,其完全分解所释放的N2为
您最近一年使用:0次
【推荐1】氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)“维生素C可以将食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有_____ (填“氧化性”或“还原性”)。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:
_____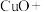 _____
_____
 _____
_____ _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应_____ 。
②该反应中,氧化剂是_____ (填化学式),被氧化的元素是_____ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为
的反应为
①该反应中的还原产物是_____ (写化学式),反应中每生成1个 分子,转移电子的数目为
分子,转移电子的数目为_____ 。
②用双线桥标出反应中电子转移的方向和数目_____ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是_____ (填序号)
A. B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为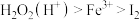 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为_____ 。
(1)“维生素C可以将食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:_____
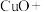 _____
_____
 _____
_____ _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为
的反应为
①该反应中的还原产物是
 分子,转移电子的数目为
分子,转移电子的数目为②用双线桥标出反应中电子转移的方向和数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为
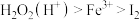 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】铜能被氯化铁浓溶液腐蚀,化学反应是:Cu+2FeCl3==CuCl2+2FeCl2。现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉经充分反应,溶液中还存在4.8g不溶解的物质。请回答:
(1)加入铁粉后发生反应的离子反应方程式为______________________________ 。
(2)充分反应后,溶液中存在4.8g不溶物的成分为______________ 。
(3)充分反应后溶液中一定不存在的金属离子为__________ ,一定存在的金属离子是_________ 。
(4)由Cu+2FeCl3=CuCl2+2FeCl2知,溶液中离子氧化性Fe3+__________ Cu2+(填“大于”、“等于”、“小于”)。
(1)加入铁粉后发生反应的离子反应方程式为
(2)充分反应后,溶液中存在4.8g不溶物的成分为
(3)充分反应后溶液中一定不存在的金属离子为
(4)由Cu+2FeCl3=CuCl2+2FeCl2知,溶液中离子氧化性Fe3+
您最近一年使用:0次
【推荐3】(1)黑火药是我国古代科技四大发明之一,在化学史上占有重要地位,黑火药主要是硝酸钾、硫磺、木炭三者 粉末的混合物,在点燃条件下,其化学反应式主要为:KNO3+S+C→N2↑+CO2↑+K2S
试填写下列空白:
①在黑火药燃烧的反应中,氧化剂为_____ ,被氧化的物质为_____ 。
②根据化学反应式分析,一个硫原子参与反应时_____ (得到或失去)_______ 个电子。
(2)过氧化氢(H2O2,氧显-1 价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2 =2Ag+O2↑+H2O
B.2H2O2 =2H2O+O2 ↑
C.3H2O2 +Cr2(SO4)3+10KOH=2K2CrO4 +3K2SO4 +8H2O
①上述反应中,H2O2分别表现的性质。A_______ ;B ______ ;C_______ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序_____________ 。
试填写下列空白:
①在黑火药燃烧的反应中,氧化剂为
②根据化学反应式分析,一个硫原子参与反应时
(2)过氧化氢(H2O2,氧显-1 价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2 =2Ag+O2↑+H2O
B.2H2O2 =2H2O+O2 ↑
C.3H2O2 +Cr2(SO4)3+10KOH=2K2CrO4 +3K2SO4 +8H2O
①上述反应中,H2O2分别表现的性质。A
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序
您最近一年使用:0次
【推荐1】回答下列问题
(1)NaH能与水剧烈反应生成对应的碱和氢气,写出反应的化学方程式并用单线桥标明电子转移的方向和数目___________ 。该反应中氧化产物与还原产物的质量比为___________ 。
(2)配平反应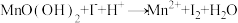 (未配平)的方程式,其化学计量数依次为
(未配平)的方程式,其化学计量数依次为___________ 。
(1)NaH能与水剧烈反应生成对应的碱和氢气,写出反应的化学方程式并用单线桥标明电子转移的方向和数目
(2)配平反应
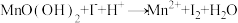 (未配平)的方程式,其化学计量数依次为
(未配平)的方程式,其化学计量数依次为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+ 2H2O。
MnCl2+Cl2↑+ 2H2O。
(1)用“双线桥法”标明反应中电子转移的方向和数目_________ 。
(2)该反应中,氧化剂和还原剂物质的量之比是_________ 。
(3)草酸能使酸性KMnO4溶液褪色,配平下面的化学方程式:_____ KMnO4+H2SO4+H2C2O4 = MnSO4+K2SO4 +CO2↑+H2O。
Ⅱ.盐酸广泛应用在稀有金属的湿法治金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2 g/mL,质量分数为36.5%的浓盐酸配制250mL 3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为________ mL。
(2)实验过程中,下列操作会导致最终所配溶液浓度偏高的是____________ 。
A.量取浓盐酸时俯视刻度线 B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线 D.转移时,未洗涤烧杯和玻璃棒
 MnCl2+Cl2↑+ 2H2O。
MnCl2+Cl2↑+ 2H2O。(1)用“双线桥法”标明反应中电子转移的方向和数目
(2)该反应中,氧化剂和还原剂物质的量之比是
(3)草酸能使酸性KMnO4溶液褪色,配平下面的化学方程式:
Ⅱ.盐酸广泛应用在稀有金属的湿法治金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2 g/mL,质量分数为36.5%的浓盐酸配制250mL 3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为
(2)实验过程中,下列操作会导致最终所配溶液浓度偏高的是
A.量取浓盐酸时俯视刻度线 B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线 D.转移时,未洗涤烧杯和玻璃棒
您最近一年使用:0次
【推荐3】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:KClO3+HCl(浓)== KCl+ClO2↑+Cl2↑+。
(1)请写出完整的化学方程式并配平_______ 。
(2)浓盐酸在反应中显示出来的性质是_______ (填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)用双线桥法标明电子转移的方向和数目____ 。
(4)产生0.1molCl2,则转移的电子的物质的量为___ mol。
(1)请写出完整的化学方程式并配平
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)用双线桥法标明电子转移的方向和数目
(4)产生0.1molCl2,则转移的电子的物质的量为
您最近一年使用:0次



