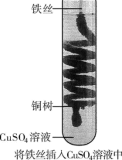
氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)“维生素C可以将食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有_____ (填“氧化性”或“还原性”)。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:
_____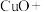 _____
_____
 _____
_____ _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应_____ 。
②该反应中,氧化剂是_____ (填化学式),被氧化的元素是_____ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为
的反应为
①该反应中的还原产物是_____ (写化学式),反应中每生成1个 分子,转移电子的数目为
分子,转移电子的数目为_____ 。
②用双线桥标出反应中电子转移的方向和数目_____ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是_____ (填序号)
A. B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为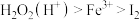 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为_____ 。
(1)“维生素C可以将食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下:_____
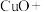 _____
_____
 _____
_____ _____
_____ _____
_____ _____
_____
①配平上述氧化还原反应
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为
的反应为
①该反应中的还原产物是
 分子,转移电子的数目为
分子,转移电子的数目为②用双线桥标出反应中电子转移的方向和数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.KI D.
C.KI D.
(4)双氧水是公认的绿色氧化剂。已知氧化性强弱顺序为
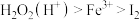 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
更新时间:2023-07-05 09:47:22
|
相似题推荐
【推荐1】(Ⅰ)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
请回答下列问题:
(1)此反应的氧化剂是________ ,氧化产物是________ 。
(2)H2SO4在上述反应中表现出来的性质是________ (填选项序号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
已知碳与浓硫酸在加热条件下反应生成CO2、SO2和H2O,写出该反应的化学方程式:__________ 。
(Ⅱ)饮用水中的NO 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,可以在碱性条件下用铝粉将NO
的浓度,可以在碱性条件下用铝粉将NO 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(3)上述反应中,被氧化的元素__________ ,还原产物是________ 。
(4)用双线桥法表示反应中电子转移的方向和数目:_____ 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(5)请配平下列离子方程式。
________ Fe2++_______ H++_______ NO =
=_______ Fe3++_______ N2O↑+_______ H2O
请回答下列问题:
(1)此反应的氧化剂是
(2)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
已知碳与浓硫酸在加热条件下反应生成CO2、SO2和H2O,写出该反应的化学方程式:
(Ⅱ)饮用水中的NO
 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,可以在碱性条件下用铝粉将NO
的浓度,可以在碱性条件下用铝粉将NO 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:(3)上述反应中,被氧化的元素
(4)用双线桥法表示反应中电子转移的方向和数目:
(5)请配平下列离子方程式。
 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氮,磷,硫,氯等非金属元素的单质和化合物在工农业生产中有重要应用。回答下列问题:
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为___________ ,某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为N2的是___________ (填标号)。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为___________ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4 :1,则氧化产物为____ (填化学式)。
(3)硫代硫酸钠晶体(Na2S2O3·5H2O),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式___________ 。
(4)氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO的物质的量之比为3 :1的离子方程式为___________ 。
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4 :1,则氧化产物为
(3)硫代硫酸钠晶体(Na2S2O3·5H2O),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式
(4)氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO的物质的量之比为3 :1的离子方程式为
您最近一年使用:0次
【推荐3】氮族元素包括氮(N),磷(P),砷(As),锑(Sb)和铋(Bi)五种元素,它们位于元素周期表第15纵列,研究氮族元素单质及其化合物的性质对于生产生活具有重要意义。请回答下列问题:
(1)亚硝酸钠( )是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
)是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
①亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,从而使血红蛋白丧失输送氧气的能力而使人体中毒;一旦发生亚硝酸盐中毒,可立即注射美蓝溶液进行解毒治疗,试推断美蓝溶液具有______ (填“氧化”或“还原”)性。
②亚硝酸钠外观极像食盐,工业上检验食盐中是否混有亚硝酸钠的方法是:取样品,加淀粉碘化钾溶液,酸化后溶液______ (描述现象),说明样品中含有亚硝酸钠。
(2)饮用水中的 对人类健康会产生危害,为降低
对人类健康会产生危害,为降低 的浓度,某饮用水研究人员提出用铝粉将
的浓度,某饮用水研究人员提出用铝粉将 还原为
还原为 ,其化学方程式为
,其化学方程式为 。用“双线桥法”表示反应中电子转移的方向和数目:
。用“双线桥法”表示反应中电子转移的方向和数目:________ 。
(3)次磷酸( )是一种精细磷化工产品,具有较强还原性,它可将溶液中的
)是一种精细磷化工产品,具有较强还原性,它可将溶液中的 还原为银单质,因而可用于化学镀银。在利用
还原为银单质,因而可用于化学镀银。在利用 进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为
进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为____ (填化学式)。
(4)工业上常将含砷废渣(主要成分为 ,其中硫元素显-2价)制成浆状,通入
,其中硫元素显-2价)制成浆状,通入 氧化,生成
氧化,生成 和单质硫,写出发生反应的化学方程式
和单质硫,写出发生反应的化学方程式_______ 。
(5)已知由 、
、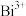 、
、 、
、 、
、 、
、 组成的一个氧化还原反应体系中,发生了
组成的一个氧化还原反应体系中,发生了 的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:
的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:___ +____ +___ 
___ +____ +___  。
。
(1)亚硝酸钠(
 )是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
)是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。①亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,从而使血红蛋白丧失输送氧气的能力而使人体中毒;一旦发生亚硝酸盐中毒,可立即注射美蓝溶液进行解毒治疗,试推断美蓝溶液具有
②亚硝酸钠外观极像食盐,工业上检验食盐中是否混有亚硝酸钠的方法是:取样品,加淀粉碘化钾溶液,酸化后溶液
(2)饮用水中的
 对人类健康会产生危害,为降低
对人类健康会产生危害,为降低 的浓度,某饮用水研究人员提出用铝粉将
的浓度,某饮用水研究人员提出用铝粉将 还原为
还原为 ,其化学方程式为
,其化学方程式为 。用“双线桥法”表示反应中电子转移的方向和数目:
。用“双线桥法”表示反应中电子转移的方向和数目:(3)次磷酸(
 )是一种精细磷化工产品,具有较强还原性,它可将溶液中的
)是一种精细磷化工产品,具有较强还原性,它可将溶液中的 还原为银单质,因而可用于化学镀银。在利用
还原为银单质,因而可用于化学镀银。在利用 进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为
进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为(4)工业上常将含砷废渣(主要成分为
 ,其中硫元素显-2价)制成浆状,通入
,其中硫元素显-2价)制成浆状,通入 氧化,生成
氧化,生成 和单质硫,写出发生反应的化学方程式
和单质硫,写出发生反应的化学方程式(5)已知由
 、
、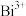 、
、 、
、 、
、 、
、 组成的一个氧化还原反应体系中,发生了
组成的一个氧化还原反应体系中,发生了 的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:
的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:
 。
。
您最近一年使用:0次
【推荐1】某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化产物是__________ (填化学式)。
(2)如果反应方程式中I2和KIO3的系数都是5,则:
①KMnO4的系数是______ 。
②配平上述化学方程式,并用单线桥表示电子转移的方向和数目________ 。
(3)如果没有对反应方程式中的某些系数进行限定,可能的配平的系数有许多组,原因是_______ 。
(1)该反应的氧化产物是
(2)如果反应方程式中I2和KIO3的系数都是5,则:
①KMnO4的系数是
②配平上述化学方程式,并用单线桥表示电子转移的方向和数目
(3)如果没有对反应方程式中的某些系数进行限定,可能的配平的系数有许多组,原因是
您最近一年使用:0次
【推荐2】 是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可通过反应
是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可通过反应
 制得。
制得。
试回答下列问题:
(1)该反应中还原产物的化学式是___________ ,被氧化的元素是___________ (填元素符号)。
(2)用双线桥法标出上述反应的电子转移情况。________________
(3)若反应共产生了8.96 L(标准状况)气体,则反应转移的电子的物质的量为________ mol,消耗还原剂的物质的量为_______ mol。
(4)标准状况下44.8 mL的 恰好能与50 mL0.1 mol/L的
恰好能与50 mL0.1 mol/L的 溶液完全反应,生成的产物之一为
溶液完全反应,生成的产物之一为 ,氯元素在产物中的化合价为
,氯元素在产物中的化合价为_______ ,此过程说明 具有
具有______ (填“氧化”或“还原”)性。
(5)在硫化钠溶液中通入 可发生如下反应,请将生成物补充完整并配平。
可发生如下反应,请将生成物补充完整并配平。
_______ 
_______ 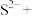
_____  =
=_____ 
_______ 
_____
 是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可通过反应
是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可通过反应
 制得。
制得。试回答下列问题:
(1)该反应中还原产物的化学式是
(2)用双线桥法标出上述反应的电子转移情况。
(3)若反应共产生了8.96 L(标准状况)气体,则反应转移的电子的物质的量为
(4)标准状况下44.8 mL的
 恰好能与50 mL0.1 mol/L的
恰好能与50 mL0.1 mol/L的 溶液完全反应,生成的产物之一为
溶液完全反应,生成的产物之一为 ,氯元素在产物中的化合价为
,氯元素在产物中的化合价为 具有
具有(5)在硫化钠溶液中通入
 可发生如下反应,请将生成物补充完整并配平。
可发生如下反应,请将生成物补充完整并配平。
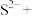
 =
=

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】 为棕褐色固体,在化工生产中有许多应用。
为棕褐色固体,在化工生产中有许多应用。
(1)书写利用单质反应制备氯化铁的化学方程式,并标出电子转移的方向和数目 :___________ 。
(2)铁与硫单质反应生成黑色固体 ,由以上信息可知,氯气的氧化性
,由以上信息可知,氯气的氧化性___________ 硫单质。
A.强于 B.弱于
(3)氯化铁溶于水后,电离方程式为___________ 。
(4)对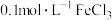 溶液说法正确的是___________。
溶液说法正确的是___________。
(5)将 氧化铁晶体(
氧化铁晶体( ,
, )与
)与 溶液恰好完全沉淀,则
溶液恰好完全沉淀,则 溶液的物质的量浓度约为___________。
溶液的物质的量浓度约为___________。
(6)若用氯化铁晶体( )配制
)配制 溶液,下列会造成所配溶液物质的量浓度偏高的是___________。
溶液,下列会造成所配溶液物质的量浓度偏高的是___________。
(7)配制 溶液过程中用到的玻璃仪器:玻璃棒、烧杯、
溶液过程中用到的玻璃仪器:玻璃棒、烧杯、___________ 。
(8)将饱和氯化铁溶液与小苏打溶液混合时,会产生红褐色沉淀和一种无色无味且能使石灰水变浑浊的气体,则该气体在标况下的密度为___________ (保留三位小数)。
 为棕褐色固体,在化工生产中有许多应用。
为棕褐色固体,在化工生产中有许多应用。(1)书写利用单质反应制备氯化铁的化学方程式,并标出
(2)铁与硫单质反应生成黑色固体
 ,由以上信息可知,氯气的氧化性
,由以上信息可知,氯气的氧化性A.强于 B.弱于
(3)氯化铁溶于水后,电离方程式为
(4)对
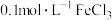 溶液说法正确的是___________。
溶液说法正确的是___________。A.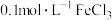 溶液中 溶液中 的物质的量为 的物质的量为 |
B.将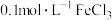 固体溶于 固体溶于 的水中得到 的水中得到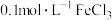 溶液 溶液 |
C.Fe与盐酸反应的离子方程式: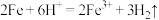 |
D.将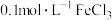 溶液加水稀释100倍,其浓度变为 溶液加水稀释100倍,其浓度变为 |
 氧化铁晶体(
氧化铁晶体( ,
, )与
)与 溶液恰好完全沉淀,则
溶液恰好完全沉淀,则 溶液的物质的量浓度约为___________。
溶液的物质的量浓度约为___________。A. | B.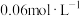 | C. | D. |
 )配制
)配制 溶液,下列会造成所配溶液物质的量浓度偏高的是___________。
溶液,下列会造成所配溶液物质的量浓度偏高的是___________。| A.定容时,仰视凹液面最低点 | B.转移时,有少量液体溅出 |
C. ,晶体已部分失水 ,晶体已部分失水 | D.烧杯、玻璃棒未洗涤 |
 溶液过程中用到的玻璃仪器:玻璃棒、烧杯、
溶液过程中用到的玻璃仪器:玻璃棒、烧杯、(8)将饱和氯化铁溶液与小苏打溶液混合时,会产生红褐色沉淀和一种无色无味且能使石灰水变浑浊的气体,则该气体在标况下的密度为
您最近一年使用:0次
【推荐1】(1)黑火药是我国古代科技四大发明之一,在化学史上占有重要地位,黑火药主要是硝酸钾、硫磺、木炭三者 粉末的混合物,在点燃条件下,其化学反应式主要为:KNO3+S+C→N2↑+CO2↑+K2S
试填写下列空白:
①在黑火药燃烧的反应中,氧化剂为_____ ,被氧化的物质为_____ 。
②根据化学反应式分析,一个硫原子参与反应时_____ (得到或失去)_______ 个电子。
(2)过氧化氢(H2O2,氧显-1 价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2 =2Ag+O2↑+H2O
B.2H2O2 =2H2O+O2 ↑
C.3H2O2 +Cr2(SO4)3+10KOH=2K2CrO4 +3K2SO4 +8H2O
①上述反应中,H2O2分别表现的性质。A_______ ;B ______ ;C_______ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序_____________ 。
试填写下列空白:
①在黑火药燃烧的反应中,氧化剂为
②根据化学反应式分析,一个硫原子参与反应时
(2)过氧化氢(H2O2,氧显-1 价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2 =2Ag+O2↑+H2O
B.2H2O2 =2H2O+O2 ↑
C.3H2O2 +Cr2(SO4)3+10KOH=2K2CrO4 +3K2SO4 +8H2O
①上述反应中,H2O2分别表现的性质。A
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】归纳、实验探究是学习化学的有效方法。
(1)现有反应:①Cl2+2NaBr=2NaCl+Br2; ②Br2+2NaI=2NaBr+I2
分析反应①和②,可以得到:Cl2 Br2 I2三种非金属单质的氧化性由强到弱的顺序是____________________ 。
(2)已知:①CCl4不溶于水,且密度比水大
②Cl2、Br2、I2在水中的溶解较小,而易溶解在CCl4中
③溴、碘的CCl4溶液分别呈橙红色和紫红色。
某同学想通过实验的方法比较Cl2和I2的氧化性,于是向盛有NaI溶液的试管中加入少许CCl4后滴加氯水,发现CCl4层变成紫红色,反应的方程式为_________________ ,证明了上述结论。
(3)该同学还意外发现继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
①写出CCl4层由紫红色变成无色的化学反应方程式,并配平:____________
+ +H2O→ HIO3+
②此过程中的还原剂是_____________________ 。
(1)现有反应:①Cl2+2NaBr=2NaCl+Br2; ②Br2+2NaI=2NaBr+I2
分析反应①和②,可以得到:Cl2 Br2 I2三种非金属单质的氧化性由强到弱的顺序是
(2)已知:①CCl4不溶于水,且密度比水大
②Cl2、Br2、I2在水中的溶解较小,而易溶解在CCl4中
③溴、碘的CCl4溶液分别呈橙红色和紫红色。
某同学想通过实验的方法比较Cl2和I2的氧化性,于是向盛有NaI溶液的试管中加入少许CCl4后滴加氯水,发现CCl4层变成紫红色,反应的方程式为
(3)该同学还意外发现继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
①写出CCl4层由紫红色变成无色的化学反应方程式,并配平:
+ +H2O→ HIO3+
②此过程中的还原剂是
您最近一年使用:0次
【推荐1】已知在碱性条件下,氯气会发生自身氧化—还原反应,某条件下,反应体系的物质为:KClO3、Cl2、KCl、KOH、H2O。
(1)在该反应中KClO3是_________ (填“氧化剂”、“还原剂”或“氧化产物”、“还原产物”)。
(2)请把反应物的化学式及配平,并标出电子转移的方向和数目:
3Cl2 + 6KOH→__________ +___________ 。
(3)若反应中有1 mol电子发生转移,则参加反应的KOH 是___________ 。
(4)实验室利用6HCl + KClO3→KCl + 3H2O + 3Cl2↑ 可制取Cl2。根据该反应可推知__________ 。
A.KCl是还原产物 B.盐酸在反应中仅仅是还原剂
C.反应中转移的电子数为6 e D.从方程式可知还原性:HCl>Cl2
(1)在该反应中KClO3是
(2)请把反应物的化学式及配平,并标出电子转移的方向和数目:
3Cl2 + 6KOH→
(3)若反应中有1 mol电子发生转移,则参加反应的KOH 是
(4)实验室利用6HCl + KClO3→KCl + 3H2O + 3Cl2↑ 可制取Cl2。根据该反应可推知
A.KCl是还原产物 B.盐酸在反应中仅仅是还原剂
C.反应中转移的电子数为6 e D.从方程式可知还原性:HCl>Cl2
您最近一年使用:0次
【推荐2】KClO3 和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:____KClO3+____HCl(浓)=____KCl+____ClO2↑+____Cl2↑+____H2O
(1)请配平上述化学方程式并用双线桥表示出电子转移情况。________
(2)该反应中还原产物与氧化产物的物质的量之比为________ 。
(3)若该反应有 490gKClO3 参加反应,则被氧化的 HCl 的质量为________ 。
(4)若该反应的产生 2.24L(标准状况)ClO2,则转移的电子数目为________ 。
(5)某地生产的食盐中含有少量的剧毒氰化钠 NaCN,用 ClO2 可以除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒的气体。写出该反应的化学方程式________ 。
(1)请配平上述化学方程式并用双线桥表示出电子转移情况。
(2)该反应中还原产物与氧化产物的物质的量之比为
(3)若该反应有 490gKClO3 参加反应,则被氧化的 HCl 的质量为
(4)若该反应的产生 2.24L(标准状况)ClO2,则转移的电子数目为
(5)某地生产的食盐中含有少量的剧毒氰化钠 NaCN,用 ClO2 可以除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒的气体。写出该反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】已知铜和浓硫酸可以在加热条件下发生如下反应:Cu+2H2SO4(浓) CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
(1)A物质可以使酸性KMnO4溶液___________ (实验现象)。反应中的还原剂是____________ (化学式)。
(2)一定量的铜片与100mL18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为_________ g, 生成的A气体在标准状况下的体积为_________ L(假设气体全部逸出)。
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应,所得沉淀为混合物,其中硫酸钡的质量为______ g。(保留到0.1g,不要求计算过程)
 CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:(1)A物质可以使酸性KMnO4溶液
(2)一定量的铜片与100mL18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应,所得沉淀为混合物,其中硫酸钡的质量为
您最近一年使用:0次