下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,使有效碰撞次数增大 |
| B.气体参加的化学反应,压缩体积增大压强可增加活化分子百分数,加快反应速率 |
| C.升温能使化学反应速率加快,主要原因是增大了反应物分子的活化分子百分数 |
| D.催化剂影响反应活化能,增大反应物分子的活化分子百分数,只加快正反应速率 |
更新时间:2023-10-26 17:02:31
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法错误的是

A.在25℃和101kPa时,1moL  (s)完全燃烧生成 (s)完全燃烧生成 (s)和 (s)和 (g)时放出853kJ的热量,则 (g)时放出853kJ的热量,则 燃烧热的热化学方程式为: 燃烧热的热化学方程式为:  |
B.已知冰的熔化热为6.0 ,冰中氢键键能为20 ,冰中氢键键能为20 ,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 ,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
| C.中和反应反应热的测定,需要测量三次温度,第三次测量反应后体系的最高温度 |
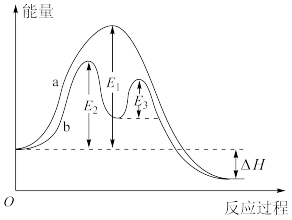
| D.某反应过程能量变化如图,b为在有催化剂作用下的反应过程 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】单位体积内“活化分子”多少可以判断化学反应速率快慢,下列说法中不正确的是( )
| A.活化分子之间的碰撞一定是有效碰撞 |
| B.催化剂能降低反应的活化能,使单位体积内的活化分子百分数增加 |
| C.增大反应物的浓度,可使单位体积内的活化分子增多,反应速率加快 |
| D.对于有气体参加的反应,通过压缩容器增大压强,可使单位体积内的活化分子增多,反应速率加快 |
您最近一年使用:0次
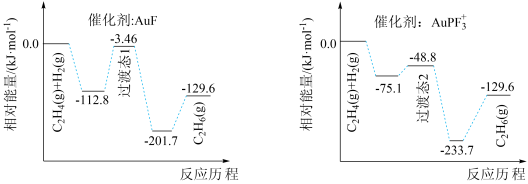
【推荐1】不同含金催化剂催化乙烯加氢的反应历程如图所示[已知反应: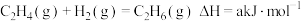 ]。下列说法错误的是
]。下列说法错误的是
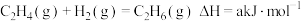 ]。下列说法错误的是
]。下列说法错误的是
A.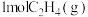 和 和 的键能之和比 的键能之和比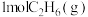 的键能大 的键能大 |
B. |
C.催化剂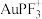 的催化效果较好 的催化效果较好 |
| D.稳定性:过渡态1<过渡态2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】近日,中国科学院化学物理研究所李灿院士团队揭示催化剂(Co3O4)上催化水氧化产氧历程如图所示(注明: s、ms、μs表示秒、毫秒、微秒)。下列叙述错误的是
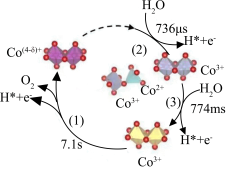

| A.第(1)步反应为总反应的控速反应 |
| B.Co原子价电子排布式为3d74s2,位于周期表中第四周期第Ⅷ族 |
| C.从总反应看,每生成标况22. 4LO2必转移3mol 电子 |
| D.该反应过程中三步都断裂了极性键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】氮氧化物是大气污染物之一,利用碳粉还原消除一氧化氮的反应为C(s)+2NO(g)⇌N2(g) +CO2(g) ΔH<0。对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0. 1mol/L。不同温度下,测得反应2小时时,NO去除率如图所示。下列说法正确的是


| A.据图分析,温度在500℃以内,三种情况下反应的活化能最小的是La2O3/C |
| B.A点是平衡点 |
| C.上述实验中400℃时,若要实现反应2小时La2O3/C对NO的去除率达到36%,可压缩体积或恒容下,向体系中通入氦气 |
| D.400℃时此反应的平衡常数Kp= 144,则反应到达平衡时NO的去除率为96% |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】可使反应 的反应速率增大的措施是:
的反应速率增大的措施是:
①增大压强②增加碳的用量③通入H2O(g)④恒压下充入Ne⑤恒容下充入Ne⑥升高温度
 的反应速率增大的措施是:
的反应速率增大的措施是:①增大压强②增加碳的用量③通入H2O(g)④恒压下充入Ne⑤恒容下充入Ne⑥升高温度
| A.①③⑤ | B.②④⑥ | C.①③⑤⑥ | D.①③⑥ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】水-碳催化制氢的反应为C+H2O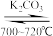 H2+CO,可应用于汽车尾气的净化,下列关于该反应的说法正确的是
H2+CO,可应用于汽车尾气的净化,下列关于该反应的说法正确的是
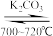 H2+CO,可应用于汽车尾气的净化,下列关于该反应的说法正确的是
H2+CO,可应用于汽车尾气的净化,下列关于该反应的说法正确的是| A.增大压强能减慢化学反应速率 |
| B.合适的催化剂能加快反应速率 |
| C.增大水蒸气的浓度能减慢化学反应速率 |
| D.达化学平衡时,H2O能全部转化为H2 |
您最近一年使用:0次

 N2(g)+2CO2(g)
N2(g)+2CO2(g) 、
、 三种气态物质建立化学平衡:
三种气态物质建立化学平衡: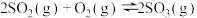
 ,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法正确的是
,改变条件对反应正、逆反应速率的影响如图所示,关于改变的条件下列说法正确的是



