完成下列问题
(1)氢气在化学工业中应用广泛。一定条件下,在某恒容密闭容器中,按投料比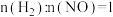 发生如下反应:
发生如下反应: ,下列能够说明该反应已达到化学平衡状态的是___________(填标号)。
,下列能够说明该反应已达到化学平衡状态的是___________(填标号)。
(2)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数Kp。
2NO(g)+2ICl(g) 2NOCl(g)+I2(g) Kp1
2NOCl(g)+I2(g) Kp1
2NOCl(g) 2NO(g)+Cl2(g) Kp2
2NO(g)+Cl2(g) Kp2
得到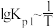 和
和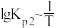 均为线性关系,如下图所示:
均为线性关系,如下图所示:
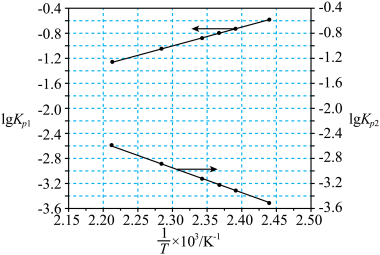
①由图可知,NOCl分解为NO和Cl2反应的ΔH___________ 0(填“大于”或“小于”)
②反应2ICl(g)=Cl2(g)+I2(g)的K=___________ (用KP1、KP2表示):该反应的
___________ 0(填“大于”或“小于”),写出推理过程___________ 。
(3)有机物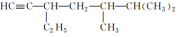 的系统命名是
的系统命名是___________ ,将其在催化剂存在下完全氢化,所得烷烃的系统命名是___________ 。
(4)某化学实验小组从市场上买来一瓶食用白醋(含CH3COOH),用实验室标准NaOH溶液对其进行滴定以测定醋酸浓度,完全反应时所得溶液pH大致为9。
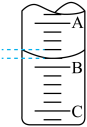
①下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为___________ mL;
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,原因可能是___________ 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(1)氢气在化学工业中应用广泛。一定条件下,在某恒容密闭容器中,按投料比
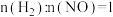 发生如下反应:
发生如下反应: ,下列能够说明该反应已达到化学平衡状态的是___________(填标号)。
,下列能够说明该反应已达到化学平衡状态的是___________(填标号)。| A.2v逆(NO)=v正(N2) | B.混合气体的密度不再变化 |
| C.容器内总压强不再变化 | D.混合气体的平均相对分子质量不再变化 |
(2)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数Kp。
2NO(g)+2ICl(g)
 2NOCl(g)+I2(g) Kp1
2NOCl(g)+I2(g) Kp12NOCl(g)
 2NO(g)+Cl2(g) Kp2
2NO(g)+Cl2(g) Kp2得到
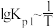 和
和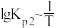 均为线性关系,如下图所示:
均为线性关系,如下图所示:
①由图可知,NOCl分解为NO和Cl2反应的ΔH
②反应2ICl(g)=Cl2(g)+I2(g)的K=

(3)有机物
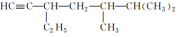 的系统命名是
的系统命名是(4)某化学实验小组从市场上买来一瓶食用白醋(含CH3COOH),用实验室标准NaOH溶液对其进行滴定以测定醋酸浓度,完全反应时所得溶液pH大致为9。
①下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为

②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
更新时间:2023-09-24 16:27:15
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】综合利用CO2、CO对构建低碳社会有重要意义。
(1)已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
①汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) N2(g) + 2CO2(g) △ H=
N2(g) + 2CO2(g) △ H=______ ,该反应能自发进行的条件是_______ 。(填“高温”、“低温”或“任意温度”)。
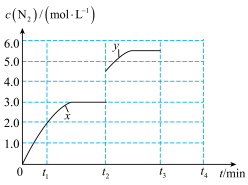
②若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线。______________
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2 CH2=CH2+4H2O
CH2=CH2+4H2O
①不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
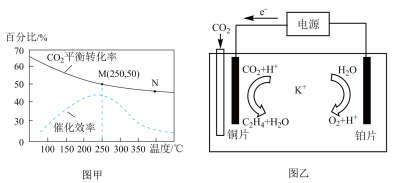
下列有关说法不正确 的是_____ (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
②若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为________ 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为___________________________________ 。
(1)已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
①汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g)
 N2(g) + 2CO2(g) △ H=
N2(g) + 2CO2(g) △ H=②若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线。

(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2
 CH2=CH2+4H2O
CH2=CH2+4H2O①不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。

下列有关说法
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
②若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是
2SO3(g)达到平衡状态的是______ (填序号,下同)。
(2)一定能证明 A(s)+2B(g) C(g)+D(g)达到平衡状态的是
C(g)+D(g)达到平衡状态的是_______ 。(注:B、C、D均为无色物质)
II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
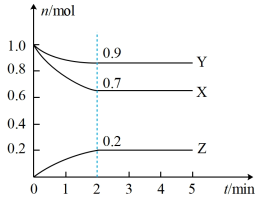
(1)反应开始至2min,以气体Y表示的平均反应速率为________ ;
(2)该反应的化学方程式为___________ ;
(3)X的转化率___________ ,生成的Z的百分含量___________
(4)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________ 。
(1)一定能证明2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的是
2SO3(g)达到平衡状态的是(2)一定能证明 A(s)+2B(g)
 C(g)+D(g)达到平衡状态的是
C(g)+D(g)达到平衡状态的是II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)反应开始至2min,以气体Y表示的平均反应速率为
(2)该反应的化学方程式为
(3)X的转化率
(4)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇是一种可再生能源,又是一种重要的化工原料.具有广阔的开发和应用前景。工业上可用如下方法合成甲醇:CO(g)+2H2(g) CH3OH(g).
CH3OH(g).
(1)已知:①2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1;
2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1;
②2CO(g)+O2(g) 2CO2(g) △H=-566.0kJ·mol-1;
2CO2(g) △H=-566.0kJ·mol-1;
③H2O(l)=H2O(g) △H=+44.0kJ·mol-1.
则甲醇液体不完全燃烧生成CO和液态水的热化学方程式为__________ 。
(2)在一定温度下,向2L密闭容器中充人1mol CO和2mol H2,发生反应CO(g)+2H2(g)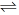 CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
①前5min内甲醇的平均反应速率为__________ ;已知该反应在低温下能自发进行,则反应的△H_______ 0(填“>”“<”或“=”)。
②在该温度下反应的平衡常数K=__________ 。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,则v正__________ v逆(填“>”“=”或“<”)。
④当反应达到平衡时,__________ (填字母)。
a.混合气体的压强不再发生变化b.反应物不再转化为生成物
c.v正(CO)=2v逆(H2) d.v(H2)=2v(CH3OH)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3) "甲醇---过氧化氢燃料电池"的结构主要包括燃料腔、氧化剂腔和质子交换膜三部分.放电过程中其中一个腔中生成了CO2。
①放电过程中生成H+的反应,发生在__________ 腔中,该腔中的电极反应式为__________ .
②该电池工作过程中,当消耗甲醇4.8g时.电路中通过的电量为__________ (法拉第常数F=9.65×104C·mol-1)
 CH3OH(g).
CH3OH(g).(1)已知:①2CH3OH(l)+3O2(g)
 2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1;
2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1;②2CO(g)+O2(g)
 2CO2(g) △H=-566.0kJ·mol-1;
2CO2(g) △H=-566.0kJ·mol-1;③H2O(l)=H2O(g) △H=+44.0kJ·mol-1.
则甲醇液体不完全燃烧生成CO和液态水的热化学方程式为
(2)在一定温度下,向2L密闭容器中充人1mol CO和2mol H2,发生反应CO(g)+2H2(g)
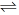 CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。①前5min内甲醇的平均反应速率为
②在该温度下反应的平衡常数K=
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,则v正
④当反应达到平衡时,
a.混合气体的压强不再发生变化b.反应物不再转化为生成物
c.v正(CO)=2v逆(H2) d.v(H2)=2v(CH3OH)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3) "甲醇---过氧化氢燃料电池"的结构主要包括燃料腔、氧化剂腔和质子交换膜三部分.放电过程中其中一个腔中生成了CO2。
①放电过程中生成H+的反应,发生在
②该电池工作过程中,当消耗甲醇4.8g时.电路中通过的电量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】运用化学反应原理研究碳、氮的化合物的反应对缓解环境污染、能源危机具有重要意义。
Ⅰ.冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放,用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △ H1=a kJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+66H2O(l) △ H2=b kJ·mol-1
③C(s)+O2(g)=CO2(g) △ H3=c kJ·mol-1
则反应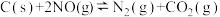 的△H=
的△H=___________ kJ·mol-1(用a、b、c表示)。
(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g) ⇌N2(g)+CO2(g) △H =Q kJ·mol-1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是________________ (填字母序号)
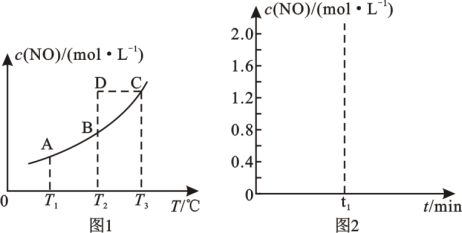
A.其他条件不变,容器内压强不再改变时,反应达到平衡状态
B.温度为T2时,若反应体系处于状态D,则此时v正>v逆
C.该反应的Q>0,T1、T2、T3对应的平衡常数:K1< K2< K3
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
(3)已知某温度时,反应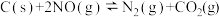 的平衡常数K=
的平衡常数K= 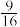 ,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间的变化曲线
,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间的变化曲线_______ 。
Ⅱ.汽车尾气脱硝脱碳主要原理为: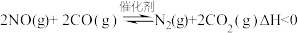 。
。
(4)该反应在__________ (填“低温”或“高温”)下可自发反应。
(5)一定条件下的密闭容器中,充入10 mol CO和8 mol NO,发生上述反应,如图为平衡时NO的体积分数与温度、压强的关系。
①该反应达到平衡后,为提高反应速率同时提高NO的转化率,可采取的措施有______ (填字母序号)。

a.缩小容器的体积 b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②压强恒定为10 MPa、温度恒定为T1的条件下,反应进行到30 min达到平衡状态,该温度下平衡常数Kp=________________ (压强以MPa为单位进行计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;结果保留两位有效数字)。
Ⅰ.冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放,用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △ H1=a kJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+66H2O(l) △ H2=b kJ·mol-1
③C(s)+O2(g)=CO2(g) △ H3=c kJ·mol-1
则反应
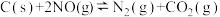 的△H=
的△H=(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g) ⇌N2(g)+CO2(g) △H =Q kJ·mol-1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是

A.其他条件不变,容器内压强不再改变时,反应达到平衡状态
B.温度为T2时,若反应体系处于状态D,则此时v正>v逆
C.该反应的Q>0,T1、T2、T3对应的平衡常数:K1< K2< K3
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
(3)已知某温度时,反应
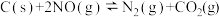 的平衡常数K=
的平衡常数K= 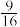 ,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间的变化曲线
,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间的变化曲线Ⅱ.汽车尾气脱硝脱碳主要原理为:
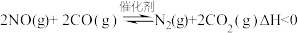 。
。(4)该反应在
(5)一定条件下的密闭容器中,充入10 mol CO和8 mol NO,发生上述反应,如图为平衡时NO的体积分数与温度、压强的关系。
①该反应达到平衡后,为提高反应速率同时提高NO的转化率,可采取的措施有

a.缩小容器的体积 b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②压强恒定为10 MPa、温度恒定为T1的条件下,反应进行到30 min达到平衡状态,该温度下平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJ•mol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJ•mol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____ kJ•mol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___ 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1___ T2(填“>”、“<”或“=”);
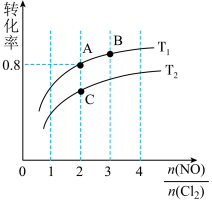
②图中纵坐标为物质___ 的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是____ (填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____ 。
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJ•mol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJ•mol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)
 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:①图中T1、T2的关系为:T1

②图中纵坐标为物质
③图中A、B、C三点对应的NOCl体积分数最大的是
④若容器容积为2L,则B点的平衡常数的值为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】2020年中国宣布碳中和计划,CO2排放力争于2030年达到峰值2060年实现碳中和。用CO2制备甲醇的反应原理为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。该反应进程可通过如图所示的两步反应实现。
CH3OH(g)+H2O(g)。该反应进程可通过如图所示的两步反应实现。
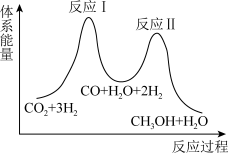
回答下列问题:
(1)反应I为_______ (填“吸热”或“放热”)反应。
(2)由图可知相同条件下化学反应速率:反应I_______ 反应II(填“<”或“>”)。
(3)反应I的化学方程式是_______ 。
(4)在容积可变的密闭容器中投入1molCO和2molH2,发生反应:CO(g)+2H2(g) CH3OH(g),测得平衡时CH3OH的物质的量随温度、压强变化如图所示。
CH3OH(g),测得平衡时CH3OH的物质的量随温度、压强变化如图所示。
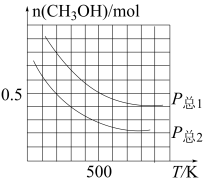
①
_______  (填“>”“<”或“=”),判断理由是
(填“>”“<”或“=”),判断理由是_______ 。
②若 =1MPa,则500K时,CH3OH的分压p(CH3OH)=
=1MPa,则500K时,CH3OH的分压p(CH3OH)=_______ MPa,该反应的平衡常数Kp=_______ MPa-2。
③下列措施中,能够同时增大反应速率和提高CO转化率的是_______ (填序号)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应体系中分离出来
 CH3OH(g)+H2O(g)。该反应进程可通过如图所示的两步反应实现。
CH3OH(g)+H2O(g)。该反应进程可通过如图所示的两步反应实现。
回答下列问题:
(1)反应I为
(2)由图可知相同条件下化学反应速率:反应I
(3)反应I的化学方程式是
(4)在容积可变的密闭容器中投入1molCO和2molH2,发生反应:CO(g)+2H2(g)
 CH3OH(g),测得平衡时CH3OH的物质的量随温度、压强变化如图所示。
CH3OH(g),测得平衡时CH3OH的物质的量随温度、压强变化如图所示。
①

 (填“>”“<”或“=”),判断理由是
(填“>”“<”或“=”),判断理由是②若
 =1MPa,则500K时,CH3OH的分压p(CH3OH)=
=1MPa,则500K时,CH3OH的分压p(CH3OH)=③下列措施中,能够同时增大反应速率和提高CO转化率的是
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应体系中分离出来
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)
(1)a点溶液中pH约为________ ,此时溶液中H2O电离出的c(H+)为________ 。
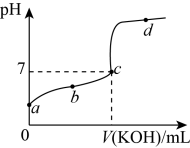
(2)a、b、c、d四点中水的电离程度最大的是________ 点,滴定过程中宜选用__________ 作指示剂,滴定终点在________ (填“c点以上”或“c点以下”)。
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_________________(填字母序号)。
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____ mol/L。
(1)a点溶液中pH约为

(2)a、b、c、d四点中水的电离程度最大的是
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_________________(填字母序号)。
| A.滴定前碱式滴定管未用标准NaOH溶液润洗 |
| B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定 |
| C.滴定过程中,溶液出现变色后,立即停止滴定 |
| D.滴定结束后,仰视液面,读取NaOH溶液体积 |
| 实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
| 1 | 21.01 | 20.00 |
| 2 | 20.99 | 20.00 |
| 3 | 21.60 | 20.00 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】滴定实验是化学学科中重要的定量实验。请回答下列问题:
Ⅰ.酸碱中和滴定—已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用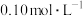 的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
(1)用______________ 滴定管(填“酸式”或“碱式”)盛装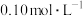 的盐酸标准液。
的盐酸标准液。
(2)试样中NaOH的质量分数为________________ 。
(3)若出现下列情况,测定结果偏高的是_________ (填序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点时,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:
I、取20.00mL0.250mol/L H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
(4)滴定时,KMnO4溶液应装在______ 滴定管中(选填:酸式、碱式).
(5)滴定终点的判断方法是:______ .
(6)根据上述数据计算,该KMnO4溶液的浓度为______ mol/L.
(7)下列操作中使得KMnO4溶液浓度偏低的是______.
Ⅰ.酸碱中和滴定—已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用
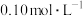 的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:滴定序号 |
| 所消耗盐酸标准液的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0. 50 | 20. 60 |
2 | 25.00 | 6. 00 | 26. 00 |
3 | 25.00 | 1. 10 | 21.00 |
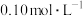 的盐酸标准液。
的盐酸标准液。(2)试样中NaOH的质量分数为
(3)若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点时,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:
I、取20.00mL0.250mol/L H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 1.50 | 23.70 |
2 | 20.00 | 1.02 | 21.03 |
3 | 20.00 | 2.00 | 21.99 |
(5)滴定终点的判断方法是:
(6)根据上述数据计算,该KMnO4溶液的浓度为
(7)下列操作中使得KMnO4溶液浓度偏低的是______.
| A.滴定管用水洗净后直接注入KMnO4溶液 |
| B.滴定前盛放标准H2C2O4溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.滴定管内在滴定前有气泡,滴定后气泡消失 |
| D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________ 。直到因加入一滴盐酸后,溶液由黄色变为橙色,并________ 为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( ) 。
A 酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C 酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
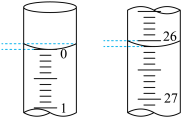
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________ mL,终点读数为________ mL;所用盐酸溶液的体积为________ mL。
(4)某学生根据3次实验分别记录有关数据如表:
依据上表数据列式计算该NaOH溶液的物质的量浓度_______________ 。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A 酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C 酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为

(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
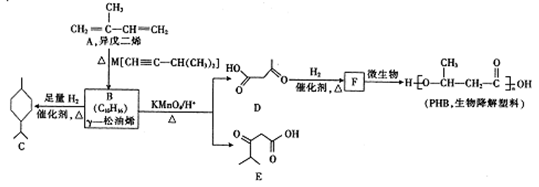
【推荐1】聚一3一羟基丁酸醋(PHB)是目前公认最有希望的生物降解塑料之一,主要用作食物软硬包装材料等,以异戊二烯为原料制取PHB的流程如图所示。
已知:①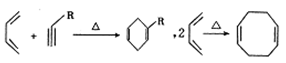
②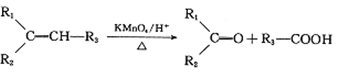
回答下列问题:
(1)用系统命令法命名,M 的名称是______ , F中含有的官能团是____ (填名称)。
(2)Q是C的同分异构体,核磁共振氮谱显示Q有2组峰,且峰面积之比为9:1,则Q,的结
构简式为________ 。
(3)F生成PHB的化学方程式是__________ ,该反应的反应类型为_________ 。
(4)F除了可以合成PHB外,还可在浓H2SO4催化下生成一种八元环状化合物,写出该反应的化学方程式:__________ 。
(5)E的同分异构体中,既能发生银镜反应,又能与碳酸氢钠溶液反应的共有_____ 种(不考虑立体异构)。
(6)参照上述合成路线设计一条由l,3一丁二烯和甲醇合成丁二酸甲酯(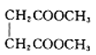 )的路线:
)的路线:______________ 。
已知:①

②

回答下列问题:
(1)用系统命令法命名,M 的名称是
(2)Q是C的同分异构体,核磁共振氮谱显示Q有2组峰,且峰面积之比为9:1,则Q,的结
构简式为
(3)F生成PHB的化学方程式是
(4)F除了可以合成PHB外,还可在浓H2SO4催化下生成一种八元环状化合物,写出该反应的化学方程式:
(5)E的同分异构体中,既能发生银镜反应,又能与碳酸氢钠溶液反应的共有
(6)参照上述合成路线设计一条由l,3一丁二烯和甲醇合成丁二酸甲酯(
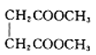 )的路线:
)的路线:
您最近一年使用:0次
【推荐2】(1)按要求表示下列有机物:
①相对分子质量为72且沸点最低的烷烃的结构简式:____ 。
②顺-2-丁烯的结构简式:____________ 。
③某炔烃经催化加氢后可得到2-甲基丁烷,则该炔烃的名称是(按系统命名法命名):______ 。
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%。已知该物质可与FeCl3溶液发生显色反应,则X的分子式为_____ ;若1molX与浓溴水反应时可消耗3molBr2,则X的结构简式为_____ 。
(3)按要求写出下列反应的化学方程式:
①实验室制备乙炔的化学方程式:__________ 。
②2-溴丙烷与氢氧化钠水溶液共热的化学方程式:_____ 。
①相对分子质量为72且沸点最低的烷烃的结构简式:
②顺-2-丁烯的结构简式:
③某炔烃经催化加氢后可得到2-甲基丁烷,则该炔烃的名称是(按系统命名法命名):
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%。已知该物质可与FeCl3溶液发生显色反应,则X的分子式为
(3)按要求写出下列反应的化学方程式:
①实验室制备乙炔的化学方程式:
②2-溴丙烷与氢氧化钠水溶液共热的化学方程式:
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.乙烯是重要的有机化工原料,其产量是衡量国家石油化工水平发展的标志。以乙烯和淀粉为原料可以实现下列转化:
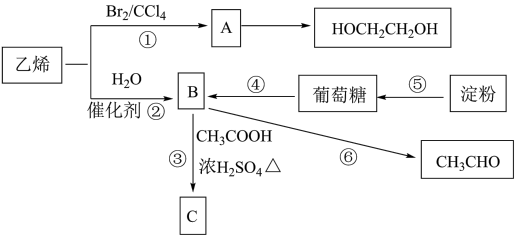
(1)乙烯的电子式___________ 。
(2)反应⑥的反应类型为___________ 。
(3)写出反应③的化学方程式:___________ 。
(4)丙烯( )与乙烯具有相似的化学性质。
)与乙烯具有相似的化学性质。
①聚丙烯的结构简式为___________ ;
②在一定条件下丙烯与 的加成产物可能为
的加成产物可能为___________ 。
Ⅱ.完成下列问题
(5)某有机物的结构简式为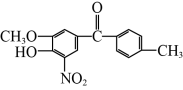 ,该有机物中含氧官能团有:
,该有机物中含氧官能团有:___________ 、___________ 、___________ 、___________ 。(写官能团名称)
(6)有机物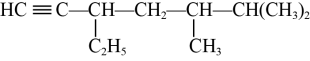 的系统命名是
的系统命名是___________ ,将其在催化剂存在下完全氢化,所得烷烃的系统命名是___________ 。
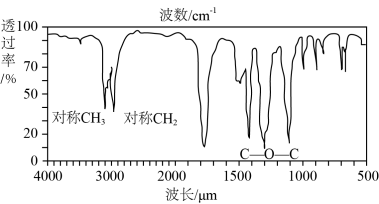
(7)下图是某一有机物的红外光谱图,该有机物的相对分子质量为74,则其结构简式为___________ 。

(1)乙烯的电子式
(2)反应⑥的反应类型为
(3)写出反应③的化学方程式:
(4)丙烯(
 )与乙烯具有相似的化学性质。
)与乙烯具有相似的化学性质。①聚丙烯的结构简式为
②在一定条件下丙烯与
 的加成产物可能为
的加成产物可能为Ⅱ.完成下列问题
(5)某有机物的结构简式为
 ,该有机物中含氧官能团有:
,该有机物中含氧官能团有:(6)有机物
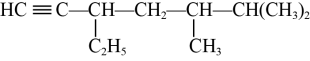 的系统命名是
的系统命名是(7)下图是某一有机物的红外光谱图,该有机物的相对分子质量为74,则其结构简式为

您最近一年使用:0次




