实验室用二氧化硫和氯气制取硫酰氯( )的实验装置如图所示。
)的实验装置如图所示。

已知:
(ⅰ)
 ;
;
(ⅱ)硫酰氯( )的熔点为-54.1℃,沸点为69.1℃;
)的熔点为-54.1℃,沸点为69.1℃;
(ⅲ)硫酰氯在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 。
。
回答下列问题:
(1)仪器X的名称为___________ ;冷凝管的进水口为___________ (填“b”或“c”)。
(2)玻璃弯管a的作用是___________ ;碱石灰的作用是___________ 。
(3)装置A中发生反应的离子方程式为___________ 。
(4)装置F中若用稀硫酸代替70%浓硫酸的缺点为___________ 。
(5)装置C和E的作用为___________ 。若撤去装置C或E会导致 ,发生的反应是
,发生的反应是___________ 。
 )的实验装置如图所示。
)的实验装置如图所示。
已知:
(ⅰ)

 ;
;(ⅱ)硫酰氯(
 )的熔点为-54.1℃,沸点为69.1℃;
)的熔点为-54.1℃,沸点为69.1℃;(ⅲ)硫酰氯在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
 和
和 。
。回答下列问题:
(1)仪器X的名称为
(2)玻璃弯管a的作用是
(3)装置A中发生反应的离子方程式为
(4)装置F中若用稀硫酸代替70%浓硫酸的缺点为
(5)装置C和E的作用为
 ,发生的反应是
,发生的反应是
更新时间:2023-11-08 20:52:47
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇(CH3OH)的合成与应用具有广阔的发展前景。
合成甲醇的部分工艺流程如下:原料气→预热装置→合成反应器→甲醇
(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。
CH4(g)+H2O(g)=CO(g)+3H2(g) ∆H =+206.2 kJ·mol-1
CO(g) + H2O(g) =CO2(g) + H2(g) ∆H =˗41.0 kJ·mol-1
甲烷与水蒸气反应生成CO2和H2的热化学方程式为__________________ 。
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:
ⅰ.CO(g)+2H2(g)⇌CH3OH(g) ∆H<0
ⅱ.CO2(g)+3H2(g)⇌CH3OH(g) + H2O(g) ∆H<0
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线_______ 是合成反应器出口样品的温度。

②在催化剂的作用下,200~300℃时,合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。
CO和H2生成二甲醚的化学方程式是______________ 。
(3)图为甲醇燃料电池的示意图。
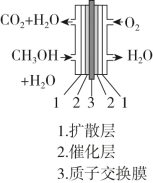
负极的电极反应式为______________ ;
正极的电极反应式为_______________ 。
合成甲醇的部分工艺流程如下:原料气→预热装置→合成反应器→甲醇
(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。
CH4(g)+H2O(g)=CO(g)+3H2(g) ∆H =+206.2 kJ·mol-1
CO(g) + H2O(g) =CO2(g) + H2(g) ∆H =˗41.0 kJ·mol-1
甲烷与水蒸气反应生成CO2和H2的热化学方程式为
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:
ⅰ.CO(g)+2H2(g)⇌CH3OH(g) ∆H<0
ⅱ.CO2(g)+3H2(g)⇌CH3OH(g) + H2O(g) ∆H<0
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线

②在催化剂的作用下,200~300℃时,合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。
CO和H2生成二甲醚的化学方程式是
(3)图为甲醇燃料电池的示意图。

负极的电极反应式为
正极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:2SO2(g)+2CO(NH2)2(aq)+4H2O(l)+O2(g)=2(NH4)SO4(aq)+ 2CO2(g),已知该反应能自发进行,则条件是_______ (填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为_______ 。

(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3):n(NO)的变化如图。臭氧量对反应SO2(g)+O2(g)= SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因_______ 。

(4)通过控制变量法研究脱除效率的影响因素得到数据如图所示,下列说法正确的是_______ 。

A.烟气在尿素溶液中的反应:v(脱硫) <v(脱硝)
B.尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C.强酸性条件下不利于尿素对氮氧化物的脱除
D.pH=7的尿素溶液脱硫效果最佳
(5)尿素的制备:2NH3(g)+ CO2(g) CO(NH2)2(s)+H2O(g) ∆H<0。一定条件下,往10 L恒容密闭容器中充入2 molNH3和1 molCO2。
CO(NH2)2(s)+H2O(g) ∆H<0。一定条件下,往10 L恒容密闭容器中充入2 molNH3和1 molCO2。
①该反应10 min后达到平衡,测得容器中气体密度为4.8g/L,平衡常数K=_______ 。
②如图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min时,迅速将体系升温,请在图中画出3-10min内容器中尿素的物质的量的变化趋势曲线_______ 。

(1)脱硫总反应:2SO2(g)+2CO(NH2)2(aq)+4H2O(l)+O2(g)=2(NH4)SO4(aq)+ 2CO2(g),已知该反应能自发进行,则条件是
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为

(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3):n(NO)的变化如图。臭氧量对反应SO2(g)+O2(g)= SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因

(4)通过控制变量法研究脱除效率的影响因素得到数据如图所示,下列说法正确的是

A.烟气在尿素溶液中的反应:v(脱硫) <v(脱硝)
B.尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C.强酸性条件下不利于尿素对氮氧化物的脱除
D.pH=7的尿素溶液脱硫效果最佳
(5)尿素的制备:2NH3(g)+ CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H<0。一定条件下,往10 L恒容密闭容器中充入2 molNH3和1 molCO2。
CO(NH2)2(s)+H2O(g) ∆H<0。一定条件下,往10 L恒容密闭容器中充入2 molNH3和1 molCO2。①该反应10 min后达到平衡,测得容器中气体密度为4.8g/L,平衡常数K=
②如图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min时,迅速将体系升温,请在图中画出3-10min内容器中尿素的物质的量的变化趋势曲线

您最近一年使用:0次
【推荐3】硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ/mol
2SO3(g)△H=-196.6kJ/mol
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中 与O2的体积比为4:1):3FeS2+8O2=Fe3O4+6SO2,4FeS2+11O2=2Fe2O3+8SO2
与O2的体积比为4:1):3FeS2+8O2=Fe3O4+6SO2,4FeS2+11O2=2Fe2O3+8SO2
(1) 550℃时,6.4 gSO2(g)与足量O2(g)充分反应生成SO3(g),放出热量___ 9.83 kJ (填“大于”、“等于”或“小于”)。
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是____ 。(填字母)
a.向平衡混合物中充入Ar b.向平衡混合物中充入O2
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe2O3,生产时要使用过量的空气,则当空气过量50%时,所得炉气中 的体积分数是
的体积分数是__________ 。
(4)720 g纯净的FeS2在空气中完全煅烧,所得固体中 和
和 的物质的量之比n(
的物质的量之比n( ):n(
):n( )=6:
)=6: ,此时消耗空气为
,此时消耗空气为 mol。
mol。
①试写出a与b的关系式:___ 。
②请在右图中画出 与
与 的关系曲线
的关系曲线___ 。
已知:①550℃时,2SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ/mol
2SO3(g)△H=-196.6kJ/mol②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中
 与O2的体积比为4:1):3FeS2+8O2=Fe3O4+6SO2,4FeS2+11O2=2Fe2O3+8SO2
与O2的体积比为4:1):3FeS2+8O2=Fe3O4+6SO2,4FeS2+11O2=2Fe2O3+8SO2(1) 550℃时,6.4 gSO2(g)与足量O2(g)充分反应生成SO3(g),放出热量
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是
a.向平衡混合物中充入Ar b.向平衡混合物中充入O2
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe2O3,生产时要使用过量的空气,则当空气过量50%时,所得炉气中
 的体积分数是
的体积分数是(4)720 g纯净的FeS2在空气中完全煅烧,所得固体中
 和
和 的物质的量之比n(
的物质的量之比n( ):n(
):n( )=6:
)=6: ,此时消耗空气为
,此时消耗空气为 mol。
mol。①试写出a与b的关系式:
②请在右图中画出
 与
与 的关系曲线
的关系曲线
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]· 2H2O},微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。
(Ⅰ)用氧化铜和草酸为原料制备二草酸合铜(II)酸钾晶体的流程如下:
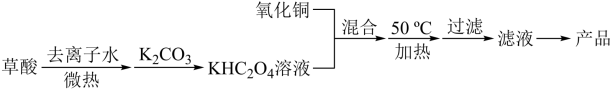
已知:H2C2O4 CO↑+CO2↑+H2O。回答下列问题:
CO↑+CO2↑+H2O。回答下列问题:
(1)将H2C2O4晶体加入去离子水中,微热,溶解过程中温度不能太高,原因是_____ 。
(2)将CuO与KHC2O4的混合液在50°C下充分反应,该反应的化学方程式为_____ 。
(3)50 °C时,加热至反应充分后的操作是_____ (填字母)。
A放于冰水中冷却后过滤B自然冷却后过滤C趁热过滤D蒸发浓缩、冷却后过滤
(Ⅱ)以CuSO4· 5H2O晶体和K2C2O4固体为原料制备二草酸合铜(II)酸钾晶体。
实验步骤:将CuSO4· 5H2O晶体和K2C2O4固体分别用去离子水溶解后,将K2C2O4溶液逐滴加入硫酸铜溶液中,有晶体析出后放在冰水中冷却,过滤,用酒精洗涤,在水浴锅上炒干。炒时不断搅拌,得到产品。
(4)用酒精而不用冷水洗涤的目的是_____
(Ⅲ)产品纯度的测定:准确称取制得的晶体试样ag溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL,再加入10 mL的稀硫酸,用b mol· L-1的KMnO4标准液滴定,消耗KMnO4标准液V mL。
(5)滴定时,下列滴定方式中,最合理的是_____ (填字母)。(夹持部分略去)
A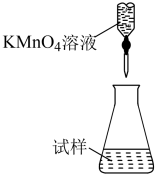 B
B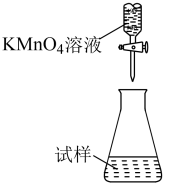 C
C
(6)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果会_____ (填“偏大”偏小”或“无影响”)。
(Ⅰ)用氧化铜和草酸为原料制备二草酸合铜(II)酸钾晶体的流程如下:

已知:H2C2O4
 CO↑+CO2↑+H2O。回答下列问题:
CO↑+CO2↑+H2O。回答下列问题:(1)将H2C2O4晶体加入去离子水中,微热,溶解过程中温度不能太高,原因是
(2)将CuO与KHC2O4的混合液在50°C下充分反应,该反应的化学方程式为
(3)50 °C时,加热至反应充分后的操作是
A放于冰水中冷却后过滤B自然冷却后过滤C趁热过滤D蒸发浓缩、冷却后过滤
(Ⅱ)以CuSO4· 5H2O晶体和K2C2O4固体为原料制备二草酸合铜(II)酸钾晶体。
实验步骤:将CuSO4· 5H2O晶体和K2C2O4固体分别用去离子水溶解后,将K2C2O4溶液逐滴加入硫酸铜溶液中,有晶体析出后放在冰水中冷却,过滤,用酒精洗涤,在水浴锅上炒干。炒时不断搅拌,得到产品。
(4)用酒精而不用冷水洗涤的目的是
(Ⅲ)产品纯度的测定:准确称取制得的晶体试样ag溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL,再加入10 mL的稀硫酸,用b mol· L-1的KMnO4标准液滴定,消耗KMnO4标准液V mL。
(5)滴定时,下列滴定方式中,最合理的是
A
 B
B C
C
(6)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果会
您最近一年使用:0次
【推荐2】 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有
形式存在,还含有 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备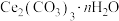 的工艺流程如下:
的工艺流程如下:

回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为___________ 。
(2)为提高“水浸”效率,可采取的措施有___________ (至少写两条)。
(3)滤渣Ⅰ为磷酸钙、磷酸铁和___________ (填化学式),滤渣Ⅲ的主要成分是___________ (填化学式)。
(4)判断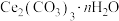 沉淀洗涤干净的实验操作和现象是
沉淀洗涤干净的实验操作和现象是___________ 。
(5)“沉铈”过程中,生成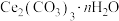 的离子方程式为
的离子方程式为___________
(6)滤渣Ⅱ的主要成分为 ,在高温条件下,
,在高温条件下, 、葡萄糖
、葡萄糖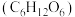 和
和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以
可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有
形式存在,还含有 、
、 、
、 、
、 等物质。以独居石为原料制备
等物质。以独居石为原料制备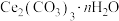 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为
(2)为提高“水浸”效率,可采取的措施有
(3)滤渣Ⅰ为磷酸钙、磷酸铁和
(4)判断
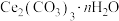 沉淀洗涤干净的实验操作和现象是
沉淀洗涤干净的实验操作和现象是(5)“沉铈”过程中,生成
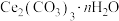 的离子方程式为
的离子方程式为(6)滤渣Ⅱ的主要成分为
 ,在高温条件下,
,在高温条件下, 、葡萄糖
、葡萄糖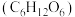 和
和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】镍、钴均是一种重要的战略资源,广泛应用于飞机发动机、锂离子电池等领域。以红土镍矿常压盐酸浸液(含 、
、 、
、 、
、 、
、 和
和 )为原料提取Ni、Co。工艺流程如下:
)为原料提取Ni、Co。工艺流程如下:
回答下列问题:
(1)滤渣1的成分是 、
、___________ 。
(2)“调 ”时,发生反应的主要化学方程式为
”时,发生反应的主要化学方程式为___________ 。
(3)“碱性氧化”时,由 转化为
转化为 的离子方程式为
的离子方程式为___________ ,常温下,若pH控制为9,则溶液中 浓度最多为
浓度最多为___________ mol·L 。
。
(4)“析晶”时,通入的酸性气体A为___________ (化学式)。
(5)①“电解”时Ni在___________ (“阴”或“阳”)极析出。
②Ni可以进一步制备超导体 ,其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为
,其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为___________ (“顶点”“面心”或“体心”),晶体中一个C周围与其最近的Ni的个数为___________ 。
 、
、 、
、 、
、 、
、 和
和 )为原料提取Ni、Co。工艺流程如下:
)为原料提取Ni、Co。工艺流程如下: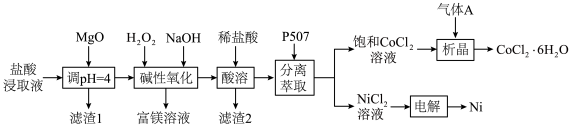
| 物质 |  |  |  |  |  |  |
 |  | 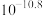 | 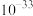 | 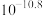 |  |  |
(1)滤渣1的成分是
 、
、(2)“调
 ”时,发生反应的主要化学方程式为
”时,发生反应的主要化学方程式为(3)“碱性氧化”时,由
 转化为
转化为 的离子方程式为
的离子方程式为 浓度最多为
浓度最多为 。
。(4)“析晶”时,通入的酸性气体A为
(5)①“电解”时Ni在
②Ni可以进一步制备超导体
 ,其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为
,其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为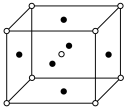
您最近一年使用:0次



