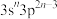A、B、C、D是原子序数依次增大的短周期主族元素。A元素的单质是一种清洁燃料,B元素的原子最外层电子数为次外层电子数的3倍,C元素的+1价离子与B元素的简单离子的电子层结构相同,D与B位于同一主族。根据上述内容判断:
(1)A为___________ (填元素符号),D的原子结构示意图为___________ 。
(2)对这四种元素的原子半径从小到大排序___________ (填元素符号)。
(3)B元素在元素周期表中的位置为___________ ,其氢化物属于___________ (填下列字母)。该氢化物比D元素氢化物的沸点___________ (填“高”或“低”)。
A.非电解质 B.强电解质 C.弱电解质 D.离子化合物 E.共价化合物
(4)C的最高价氧化物的水化物所含化学键的类型为___________ ,其与D的最高价氧化物的水化物发生反应的化学方程式为___________ 。
(1)A为
(2)对这四种元素的原子半径从小到大排序
(3)B元素在元素周期表中的位置为
A.非电解质 B.强电解质 C.弱电解质 D.离子化合物 E.共价化合物
(4)C的最高价氧化物的水化物所含化学键的类型为
更新时间:2023-10-05 07:25:19
|
相似题推荐
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y的氢化物能与其最高价氧化物对应的水化物反应生成一种盐;Z原子最外层电子数与核外电子总数之比为3: 4;X与Y、Z均可以形成电子总数为10的分子;M是短周期主族元素中原子半径最大的;N原子的最外层电子数与次外电子数之比为3: 4;据此回答:
(1)硒与N同主族,比N多一个电子层,则硒的原子序数为:_______ 。
(2)X与Z、X与N均可形成18电子分子,这两种分子在水溶液中反应可观察到有浅黄色沉淀生成,反应的化学方程式是_____________ 。
(3)由X、Z、M、N四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式__________________ 。
(4)Y有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_____ 。
(5)与Y同主族元素的化合物亚磷酸H3PO3是二元弱酸,写出H3PO3与过量的NaOH溶液反应的离子方程式:__________________ 。
(1)硒与N同主族,比N多一个电子层,则硒的原子序数为:
(2)X与Z、X与N均可形成18电子分子,这两种分子在水溶液中反应可观察到有浅黄色沉淀生成,反应的化学方程式是
(3)由X、Z、M、N四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式
(4)Y有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
(5)与Y同主族元素的化合物亚磷酸H3PO3是二元弱酸,写出H3PO3与过量的NaOH溶液反应的离子方程式:
您最近一年使用:0次
【推荐2】X、Y、Z、Q、T代表五种元素,相关信息如表所示:
请回答下列问题:
(1)X的元素符号为______ ,其基态原子的电子排布式为______ 。
(2)Y的元素名称为______ ,其基态原子的轨道表示式为______ 。
(3)Z的基态原子的价层电子的轨道表示式为______ ;
(4)Q其简单离子的结构示意图为______ 。
(5)T的基态原子的价层电子排布式为______ ;其单质在X的常见单质中燃烧的化学方程式为______ 。
元素 | 信息 |
X | 基态原子最外层电子数是其电子层数的3倍 |
Y | 基态原子的L层上有2个空轨道 |
Z | 基态原子的M层的p能级上有3个未成对电子 |
Q | 基态原子的价层电子排布式为 |
T | 正三价离子的3d能级为半充满状态 |
(1)X的元素符号为
(2)Y的元素名称为
(3)Z的基态原子的价层电子的轨道表示式为
(4)Q其简单离子的结构示意图为
(5)T的基态原子的价层电子排布式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐3】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1) D元素在周期表中的位置是___________ ,乙物质的电子式是___________ 。
(2) A、B、C、D、E五种元素的原子半径由小到大的顺序是_________ (用元素符号填写)。
(3) E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是:____________________________ 。
(4)简述比较D与E金属性强弱的实验方法:_________________________ 。
(1) D元素在周期表中的位置是
(2) A、B、C、D、E五种元素的原子半径由小到大的顺序是
(3) E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是:
(4)简述比较D与E金属性强弱的实验方法:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】下表是元素周期表的一部分,回答下列有关问题:
(1)在①~⑫元素中,非金属性最强的元素是______________ 。(填元素符号)
(2) 元素⑤的最高价氧化物的水化物分别与元素③、⑧的最高价氧化物的水化物反应的离子方程式_______________________ ;_______________________ 。
(3)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素它们可以形成化合物,用电子式表示其形成过程__________________________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
|
|
(2) 元素⑤的最高价氧化物的水化物分别与元素③、⑧的最高价氧化物的水化物反应的离子方程式
(3)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素它们可以形成化合物,用电子式表示其形成过程
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
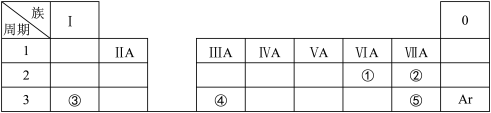
(1)①的元素符号是________ ;②的氢化物电子式________
(2)②和⑤的原子半径大小关系是②________ ⑤(填“>”“<”或“=”);
(3)③和⑤形成的化合物含有的化学键是__________ (填“离子键”或“共价键”);
(4)③、④的最高价氧化物对应的水化物相互反应的离子方程式为_____________________ 。

(1)①的元素符号是
(2)②和⑤的原子半径大小关系是②
(3)③和⑤形成的化合物含有的化学键是
(4)③、④的最高价氧化物对应的水化物相互反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)由以上元素中两两形成的化合物:
①溶于水显碱性的气态氢化物的结构式为_______
②含有非极性共价键的离子化合物的电子式为_______
(2)由X、Y、Z所形成的常见离子化合物是_______ (写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______ 。
(3)用电子式表示W与Z形成W2Z的过程:_______ 。
(4)Y、Z、W对应的离子半径由大到小的顺序为_______ (用离子符号表示)。
(1)由以上元素中两两形成的化合物:
①溶于水显碱性的气态氢化物的结构式为
②含有非极性共价键的离子化合物的电子式为
(2)由X、Y、Z所形成的常见离子化合物是
(3)用电子式表示W与Z形成W2Z的过程:
(4)Y、Z、W对应的离子半径由大到小的顺序为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】几种主族元素在周期表中的位置如下:
(1)⑤元素的最简单氢化物是________ (填化学式),①和⑦形成的化合物中存在的化学键类型为_______ ,④和⑧形成的化合物中存在的化学键类型为________ 。
(2)①③⑥三种元素原子半径由大到小的顺序是________ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的离子结构示意图为_______ ,该元素在周期表中的位置是________ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的物质的电子式是________ ,③的单质与其反应的离子方程式为________ 。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是________ (填字母,下同)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑧的气态氢化物溶于水形成的酸酸性比⑦的气态氢化物溶于水形成的酸酸性强
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦氧化物对应的水化物的酸性强于⑧氧化物对应的水化物的酸性
(6)用电子式表示①的单质与⑨的单质形成化合物的过程:_______ 。
族 周期 | IA | 0 | ||||||
| 1 | ④ | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑨ | ⑦ | ||||
| 4 | ② | ⑧ | ||||||
(2)①③⑥三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的离子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的物质的电子式是
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑧的气态氢化物溶于水形成的酸酸性比⑦的气态氢化物溶于水形成的酸酸性强
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦氧化物对应的水化物的酸性强于⑧氧化物对应的水化物的酸性
(6)用电子式表示①的单质与⑨的单质形成化合物的过程:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】A、B、C、D、E是五种短周期主族元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3,表示这种核素组成的符号为___________ 。
(2)把D的单质放到NaOH溶液中,反应的离子方程式为___________ 。
(3)甲的电子式为___________ ,丁的化学式为___________ 。
(4)有200 mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-)=1.3 mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1NaOH溶液体积是___________ mL。
(5)在密闭容器中充入BC2、BC和乙的混合气体共w g,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重w g,则BC2与乙的质量比值为___________ 。
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1∶1 | B和A 1∶4 | D和E 1∶3 | B和E 1∶4 |
(1)若元素E的某种核素中中子数比质子数多3,表示这种核素组成的符号为
(2)把D的单质放到NaOH溶液中,反应的离子方程式为
(3)甲的电子式为
(4)有200 mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-)=1.3 mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1NaOH溶液体积是
(5)在密闭容器中充入BC2、BC和乙的混合气体共w g,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重w g,则BC2与乙的质量比值为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】下表为元素周期表的一部分,请根据所学知识回答下列问题:

(1)写出J在周期表中的位置___________ 。
(2)B、D、E的简单离子半径由大到小的顺序是___________ (填离子符号)。
(3)上述元素的原子中,写出未成对电子数最多的元素基态原子的核外电子排布式:___________ 。
(4)上述7种元素中金属性最强的元素与B可形成原子个数比为1:1的化合物甲,则甲的电子式为___________ 。
(5)判断B和D的非金属性强弱,并从结构角度说明原因:___________ 。

(1)写出J在周期表中的位置
(2)B、D、E的简单离子半径由大到小的顺序是
(3)上述元素的原子中,写出未成对电子数最多的元素基态原子的核外电子排布式:
(4)上述7种元素中金属性最强的元素与B可形成原子个数比为1:1的化合物甲,则甲的电子式为
(5)判断B和D的非金属性强弱,并从结构角度说明原因:
您最近一年使用:0次