某学生用已知物质的量浓度的 标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
(1)配制 标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、
标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、___________ 。
(2)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③装标准溶液和待测液并调整液面(记录初始读数);
④用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
⑤用蒸馏水洗涤玻璃仪器;
⑥滴定操作
正确的操作顺序为:___________ 。
(3)盛装NaOH标准溶液的仪器名称为___________ ,若滴定开始和结束时,该仪器中溶液读数如图所示,所用NaOH标准溶液的体积为___________  。
。

(4)滴定过程中边滴加边摇动锥形瓶,直到加入最后一滴 溶液后,
溶液后,___________ ,表明已经到达滴定终点。
(5)某学生根据3次实验分别记录有关数据如表所示:
依据表中数据计算该盐酸的物质的量浓度为___________  。
。
(6)在上述实验中,下列操作会造成测定结果:(填 “偏高”、“ 偏低”、 “无影响”)。
a.滴定结束后盛装标准液的滴定管有气泡___________ ;
b.碱式滴定管水洗后末用标准溶液润洗___________ ;
c.若锥形瓶盛装标准溶液,滴定管内为待测溶液,并滴定终点时俯视读数___________ 。
 标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:(1)配制
 标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、
标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、(2)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③装标准溶液和待测液并调整液面(记录初始读数);
④用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
⑤用蒸馏水洗涤玻璃仪器;
⑥滴定操作
正确的操作顺序为:
(3)盛装NaOH标准溶液的仪器名称为
 。
。
(4)滴定过程中边滴加边摇动锥形瓶,直到加入最后一滴
 溶液后,
溶液后,(5)某学生根据3次实验分别记录有关数据如表所示:
| 滴定次数 | 待测盐酸的体积 | 标准 溶液体积 溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.01 |
| 第二次 | 25.00 | 1.40 | 29.85 |
| 第三次 | 25.00 | 0.46 | 26.45 |
 。
。(6)在上述实验中,下列操作会造成测定结果:(填 “偏高”、“ 偏低”、 “无影响”)。
a.滴定结束后盛装标准液的滴定管有气泡
b.碱式滴定管水洗后末用标准溶液润洗
c.若锥形瓶盛装标准溶液,滴定管内为待测溶液,并滴定终点时俯视读数
更新时间:2023-10-26 19:03:44
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组用滴定分析测某品牌食醋中醋酸含量,下列说法正确的是_______ 。
A.用NaOH溶液滴定时反应的离子方程式为:
B.食醋试样需稀释一定倍数后再进行滴定
C.若测得该品牌食醋的物质的量浓度为0.75mol/L,则该食醋的总酸量为4.5g/100mL
(2)常温下,用 溶液分别滴定
溶液分别滴定 溶液和
溶液和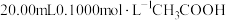 溶液,得到2条滴定曲线如图所示。滴定醋酸溶液的曲线是
溶液,得到2条滴定曲线如图所示。滴定醋酸溶液的曲线是_______ (填“图1”或“图2”);滴定曲线中a=_______ mL。

(3)现欲粗略测定一未知浓度的 溶液的电离度,应做的实验和所需的试剂(或试纸)是_______。
溶液的电离度,应做的实验和所需的试剂(或试纸)是_______。
(4)NaOH溶液滴定 溶液,选用
溶液,选用_______ 作指示剂,终点的现象为_______ 。
(5)在滴定实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。
A. 滴定终点时俯视读数
B. 称量前NaOH固体中混有 固体
固体
C. 锥形瓶水洗后未干燥
D. 移液管水洗后未用食醋溶液润洗
E. 滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失
(1)某研究小组用滴定分析测某品牌食醋中醋酸含量,下列说法正确的是
A.用NaOH溶液滴定时反应的离子方程式为:

B.食醋试样需稀释一定倍数后再进行滴定
C.若测得该品牌食醋的物质的量浓度为0.75mol/L,则该食醋的总酸量为4.5g/100mL
(2)常温下,用
 溶液分别滴定
溶液分别滴定 溶液和
溶液和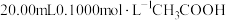 溶液,得到2条滴定曲线如图所示。滴定醋酸溶液的曲线是
溶液,得到2条滴定曲线如图所示。滴定醋酸溶液的曲线是
(3)现欲粗略测定一未知浓度的
 溶液的电离度,应做的实验和所需的试剂(或试纸)是_______。
溶液的电离度,应做的实验和所需的试剂(或试纸)是_______。| A.电解,NaOH溶液 | B.蒸馏, 溶液 溶液 |
| C.酯化反应,石蕊试液 | D.中和滴定,pH试纸 |
(4)NaOH溶液滴定
 溶液,选用
溶液,选用(5)在滴定实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A. 滴定终点时俯视读数
B. 称量前NaOH固体中混有
 固体
固体C. 锥形瓶水洗后未干燥
D. 移液管水洗后未用食醋溶液润洗
E. 滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是_______ (填编号)。若测定结果偏高,其原因可能是_______ (多选填字母)。
A.滴定过程中振荡时有液滴溅出
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是_______ 。
(3)如图是某次滴定时滴定管中的液面,其读数为_______ mL。

(4)根据表中数据,请计算待测盐酸的浓度:_______ mol·L-1(保留四位有效数字)。
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是
A.滴定过程中振荡时有液滴溅出
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是
(3)如图是某次滴定时滴定管中的液面,其读数为

(4)根据表中数据,请计算待测盐酸的浓度:
| 滴定次数 | 待测体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】滴定分析法是重要的化学分析方法,通常有酸碱中和滴定法、氧化还原滴定法、沉淀滴定法等。
I.某实验小组用中和滴定法测定某盐酸的物质的量浓度:用酚酞作指示剂,以0.1000mol·L-1的标准NaOH溶液滴定,实验数据记录如下表,请分析数据并计算盐酸的物质的量浓度=____ mol·L-1。
II.硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某化学兴趣小组测定某工业生产硫代硫酸钠产品纯度:

(1)准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000mol·L-1碘的标准溶液滴定,反应原理为2 +I2=
+I2= +2I-,滴定起始和终点的滴定管液面位置如图所示,则:滴定时盛装0.1000mol·L-1碘的标准溶液的仪器的名称是
+2I-,滴定起始和终点的滴定管液面位置如图所示,则:滴定时盛装0.1000mol·L-1碘的标准溶液的仪器的名称是____ (选填:碱式或酸式)滴定管,当滴定至终点时的现象为____ ,消耗碘的标准溶液体积为____ mL,产品的纯度为_____ 。
(2)若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果_______ (填“偏高”“偏低”或“不变”)。
III.含有 的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的
的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:

 Cr3+、Fe3+
Cr3+、Fe3+ Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾(FeSO4.7H2O)和稀硫酸,发生反应的离子方程式为_____ 。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为____ 。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
I.某实验小组用中和滴定法测定某盐酸的物质的量浓度:用酚酞作指示剂,以0.1000mol·L-1的标准NaOH溶液滴定,实验数据记录如下表,请分析数据并计算盐酸的物质的量浓度=
| 实验编号 | 待测液体体积/mL | 标准碱液 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| ① | 20.0 | 0.40 | 20.41 |
| ② | 20.0 | 0.10 | 20.60 |
| ③ | 20.0 | 4.00 | 23.99 |

(1)准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000mol·L-1碘的标准溶液滴定,反应原理为2
 +I2=
+I2= +2I-,滴定起始和终点的滴定管液面位置如图所示,则:滴定时盛装0.1000mol·L-1碘的标准溶液的仪器的名称是
+2I-,滴定起始和终点的滴定管液面位置如图所示,则:滴定时盛装0.1000mol·L-1碘的标准溶液的仪器的名称是(2)若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果
III.含有
 的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的
的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
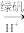 Cr3+、Fe3+
Cr3+、Fe3+ Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3(1)该废水中加入绿矾(FeSO4.7H2O)和稀硫酸,发生反应的离子方程式为
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】滴定操作
(1)滴定管的使用方法
①滴定管使用前应检查_______________ .
②量取一定体积的下列液体时,哪些必须使用如右图所示的滴定管盛装?
_______________ .
a.氨水 b.醋酸钠溶液 c.氯化铵溶液 d.硫代硫酸钠溶液 e.高锰酸钾溶液
③洁净的滴定管在加入酸、碱反应液之前,先用蒸馏水将滴定管洗涤干净,然后用所要盛装的溶液润洗2~3次.
④将反应液加入相应的滴定管中,使液面位于“0”刻度以上_______________ 处.
⑤调节活塞或挤压玻璃球,使滴定管尖嘴部分充满反应液,并使液面处于_______________ ,并记录读数.
⑥滴定时的操作
(2)关于锥形瓶的使用
①锥形瓶用蒸馏水洗净后,能否用待测液润洗?_______________ .
②中和滴定实验中,锥形瓶内盛放什么物质?_______________ .
(3)关于滴定过程
①测定 溶液的物质的量浓度,若将滴有2滴酚酞的待测液置于锥形瓶中,滴定终点时,锥形瓶内颜色变化为
溶液的物质的量浓度,若将滴有2滴酚酞的待测液置于锥形瓶中,滴定终点时,锥形瓶内颜色变化为_______________ .
若将滴有2滴酚酞的标准液置于锥形瓶中,描述滴定终点现象:_______________ .
②待滴定管中液面稳定后,记录读数.
(4)数据处理
按上述操作重复_______________ 次,先算出每一次待测液的浓度,再求浓度的平均值.
(1)滴定管的使用方法
①滴定管使用前应检查
②量取一定体积的下列液体时,哪些必须使用如右图所示的滴定管盛装?

a.氨水 b.醋酸钠溶液 c.氯化铵溶液 d.硫代硫酸钠溶液 e.高锰酸钾溶液
③洁净的滴定管在加入酸、碱反应液之前,先用蒸馏水将滴定管洗涤干净,然后用所要盛装的溶液润洗2~3次.
④将反应液加入相应的滴定管中,使液面位于“0”刻度以上
⑤调节活塞或挤压玻璃球,使滴定管尖嘴部分充满反应液,并使液面处于
⑥滴定时的操作
| 左手 | 控制酸式 |
| 右手 | 轻轻摇动 |
| 眼睛 | 注视 |
①锥形瓶用蒸馏水洗净后,能否用待测液润洗?
②中和滴定实验中,锥形瓶内盛放什么物质?
(3)关于滴定过程
①测定
 溶液的物质的量浓度,若将滴有2滴酚酞的待测液置于锥形瓶中,滴定终点时,锥形瓶内颜色变化为
溶液的物质的量浓度,若将滴有2滴酚酞的待测液置于锥形瓶中,滴定终点时,锥形瓶内颜色变化为若将滴有2滴酚酞的标准液置于锥形瓶中,描述滴定终点现象:
②待滴定管中液面稳定后,记录读数.
(4)数据处理
按上述操作重复
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】酸碱中和滴定是一种重要的实验方法,用 溶液滴定未知浓度的盐酸,其操作可分为如下几步:
溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.用待测的溶液润洗酸式滴定管
D.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
E.取下碱式滴定管用NaOH标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上 处,再把碱式滴定管固定好,并排出尖嘴部分的气泡,调节液面至“0”刻度或“0”刻度以下
处,再把碱式滴定管固定好,并排出尖嘴部分的气泡,调节液面至“0”刻度或“0”刻度以下
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作2~3次
完成以下填空:
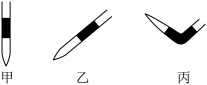
(1)排除碱式滴定管中气泡的方法应采用如图所示操作中的___________ (填“甲”“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。___________ 色变为___________ 色,且半分钟内不变色。
(3)如图是第一次滴定时的滴定管中的液面,其读数为X=___________ mL。___________ mol/L。
(5)在上述实验过程中,出现了以下操作(其他操作正确),其中会造成测定结果(待测液浓度值)偏高的有___________(填序号,下同)。
(6)有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,现把管内液体全部放出,用量筒接收,得到溶液的体积是___________。
 溶液滴定未知浓度的盐酸,其操作可分为如下几步:
溶液滴定未知浓度的盐酸,其操作可分为如下几步:A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.用待测的溶液润洗酸式滴定管
D.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
E.取下碱式滴定管用NaOH标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上
 处,再把碱式滴定管固定好,并排出尖嘴部分的气泡,调节液面至“0”刻度或“0”刻度以下
处,再把碱式滴定管固定好,并排出尖嘴部分的气泡,调节液面至“0”刻度或“0”刻度以下F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作2~3次
完成以下填空:
(1)排除碱式滴定管中气泡的方法应采用如图所示操作中的
(3)如图是第一次滴定时的滴定管中的液面,其读数为X=
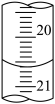
| 滴定次数 | 待测液体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.60 | X |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次' | 20.00 | 4.00 | 24.00 |
| A.量取标准液的碱式滴定管未润洗 |
| B.锥形瓶水洗后直接装待测液 |
| C.酸式滴定管水洗后未用待测稀盐酸润洗 |
| D.滴定到达终点时,俯视读出滴定管读数 |
| E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失 |
| A.不能确定 | B.为40mL |
| C.为10mL | D.大于40mL |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
(1)反应生成的CH3COONa显_________ f性,用离子方程式解释原因:____________ ,则实验中应选用上表中的__________ 作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:_________________ 。
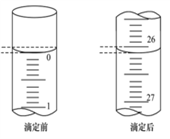
(3)第一次滴定前后,碱式滴定管中的液面位置如右图所示,请将有关数据填入下面表格的空白处。
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是________ 。
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=______________ 。
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:
(3)第一次滴定前后,碱式滴定管中的液面位置如右图所示,请将有关数据填入下面表格的空白处。

| 滴定次数 | 待食用白醋的体积/mL | 0.1000 mol/L NaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0 mL于锥形瓶,加入10.0 mL KI溶液(足量),发生反应为(Cl2+2I-=I2+2Cl-),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1的Na2S2O3标准液,调整液面。记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是_______ 。
(2)步骤③当待测液由_______ 色变为_______ 色且30 s不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为_______ 。
(3)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度_______ (填“偏大”“偏小”或“相等”)。
(4)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度_______ (填“偏大”“偏小”或“相等”)。
①取废水样10.0 mL于锥形瓶,加入10.0 mL KI溶液(足量),发生反应为(Cl2+2I-=I2+2Cl-),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1的Na2S2O3标准液,调整液面。记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是
(2)步骤③当待测液由
(3)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度
(4)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
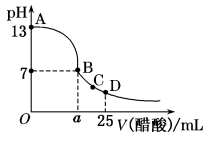
【推荐2】I.在25 mL的氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如图所示。
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式_______ 。
(2)该氢氧化钠溶液浓度为_______ 。
(3)在B点,a_______ 12.5 mL(填“<”“>”或“=”)
(4)在D点,溶液中离子浓度大小关系为_______ 。
II.乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。利用KMnO4溶液滴定可测定物质纯度。
①准确称量5.000 g乙二酸样品,配成250mL溶液。
②取所配溶液25.00 mL于锥形瓶中,加入少量硫酸酸化。
③用0.1000 mol/L KMnO4溶液滴定至草酸恰好全部氧化成二氧化碳。
④重复实验操作2-3次。
(5)若滴定前,酸式滴定管尖端有气泡,滴定后气泡消失,则所测结果_______ (填“偏高”“偏低”或“不变”);若对酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果_______ (填“偏高”“偏低”或“不变”)。
(6)判断滴定终点的现象是:_______ 。
(7)若消耗KMnO4溶液20.00 mL。计算此样品的纯度为_______ 。

(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式
(2)该氢氧化钠溶液浓度为
(3)在B点,a
(4)在D点,溶液中离子浓度大小关系为
II.乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。利用KMnO4溶液滴定可测定物质纯度。
①准确称量5.000 g乙二酸样品,配成250mL溶液。
②取所配溶液25.00 mL于锥形瓶中,加入少量硫酸酸化。
③用0.1000 mol/L KMnO4溶液滴定至草酸恰好全部氧化成二氧化碳。
④重复实验操作2-3次。
(5)若滴定前,酸式滴定管尖端有气泡,滴定后气泡消失,则所测结果
(6)判断滴定终点的现象是:
(7)若消耗KMnO4溶液20.00 mL。计算此样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】 具有选择性杀菌,澄清溶液、抗氧化性以及增酸等作用,是唯一在葡萄酒生产中普遍应用的添加剂,但是
具有选择性杀菌,澄清溶液、抗氧化性以及增酸等作用,是唯一在葡萄酒生产中普遍应用的添加剂,但是 过量或不当使用也会带来一些问题。葡萄酒业规定葡萄酒中
过量或不当使用也会带来一些问题。葡萄酒业规定葡萄酒中 最大使用量不超过为0.25 g/L。实验小组利用下列实验检验某种葡萄酒中
最大使用量不超过为0.25 g/L。实验小组利用下列实验检验某种葡萄酒中 的含量。请回答下列问题:
的含量。请回答下列问题:
(1)碘的标准溶液(溶质为碘单质):准确称量一定量的碘单质固体,配成250 mL 0.04 碘的标准溶液。配置上述溶液所需的玻璃仪器除烧杯和玻璃棒外,还有
碘的标准溶液。配置上述溶液所需的玻璃仪器除烧杯和玻璃棒外,还有___________ 。
(2)滴定:准确量取10.00 mL葡萄酒于锥形瓶中,加入过量碘的标准溶液(体积如图所示),滴加几滴指示剂,用0.05 mol/L 溶液(显碱性)滴定上述混合溶液。(已知:
溶液(显碱性)滴定上述混合溶液。(已知: )
)
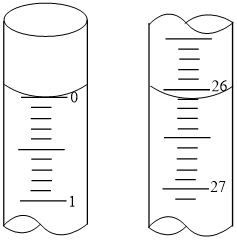
①所加碘的标准溶液的体积为___________ mL。
②指示剂为___________ 。
③滴定前排气泡时,应选择如图中的___________ (填选项字母)。
a.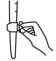 b.
b.  c.
c. 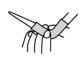 d.
d. 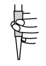
④滴定终点的实验现象为___________ 。
(3)数据处理:重复上述操作3次,记录实验数据如下。
该葡萄酒中 含量为
含量为___________ g/L(精确到小数点后两位)。
(4)误差分析(填“偏大”、“偏小”或“无影响”);
①未用葡萄酒润洗锥形瓶,会导致 含量
含量___________ 。
②滴定终点读数时俯视,会导致 含量
含量___________ 。
 具有选择性杀菌,澄清溶液、抗氧化性以及增酸等作用,是唯一在葡萄酒生产中普遍应用的添加剂,但是
具有选择性杀菌,澄清溶液、抗氧化性以及增酸等作用,是唯一在葡萄酒生产中普遍应用的添加剂,但是 过量或不当使用也会带来一些问题。葡萄酒业规定葡萄酒中
过量或不当使用也会带来一些问题。葡萄酒业规定葡萄酒中 最大使用量不超过为0.25 g/L。实验小组利用下列实验检验某种葡萄酒中
最大使用量不超过为0.25 g/L。实验小组利用下列实验检验某种葡萄酒中 的含量。请回答下列问题:
的含量。请回答下列问题:(1)碘的标准溶液(溶质为碘单质):准确称量一定量的碘单质固体,配成250 mL 0.04
 碘的标准溶液。配置上述溶液所需的玻璃仪器除烧杯和玻璃棒外,还有
碘的标准溶液。配置上述溶液所需的玻璃仪器除烧杯和玻璃棒外,还有(2)滴定:准确量取10.00 mL葡萄酒于锥形瓶中,加入过量碘的标准溶液(体积如图所示),滴加几滴指示剂,用0.05 mol/L
 溶液(显碱性)滴定上述混合溶液。(已知:
溶液(显碱性)滴定上述混合溶液。(已知: )
)
①所加碘的标准溶液的体积为
②指示剂为
③滴定前排气泡时,应选择如图中的
a.
 b.
b.  c.
c.  d.
d. 
④滴定终点的实验现象为
(3)数据处理:重复上述操作3次,记录实验数据如下。
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 37.98 |
| 2 | 0.22 | 41.36 |
| 3 | 1.56 | 39.57 |
| 4 | 5.00 | 43.01 |
 含量为
含量为(4)误差分析(填“偏大”、“偏小”或“无影响”);
①未用葡萄酒润洗锥形瓶,会导致
 含量
含量②滴定终点读数时俯视,会导致
 含量
含量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某研究性学习小组欲测定室温下(25℃,101kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
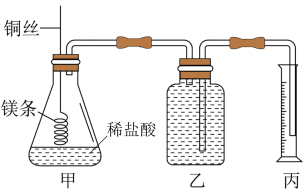
该实验的主要操作步骤如下:
①配制100 mL 1.0mol/L的盐酸溶液:.
②用_______________ (填仪器名称并注明规格)量取7.5mL 1.0mol/L的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为__________ ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,忽略导管中的水,读出量筒中水的体积为91.9mL
请将上述步骤补充完整并回答下列问题。
(1)步骤①中所需要带刻度的仪器为__________ ,若用36.5%的浓盐酸(密度为1.20g/mL)
进行稀释配制,则需要量取该浓盐酸___________ mL
(2)步骤①中,配制100 mL 1.0mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏低___________ (填写字母).
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液.
C.未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后;发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线.
F.烧杯中有少量水.
(3)请填写操作步骤中的空格:步骤②_________ 步骤③_______________
(4)实验步骤5中应选用______________ (填字母)的量筒。.'
A.100 mL B.200mL C.500mL
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积为Vm=_____________ L/mol(保留2位小数)

该实验的主要操作步骤如下:
①配制100 mL 1.0mol/L的盐酸溶液:.
②用
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,忽略导管中的水,读出量筒中水的体积为91.9mL
请将上述步骤补充完整并回答下列问题。
(1)步骤①中所需要带刻度的仪器为
进行稀释配制,则需要量取该浓盐酸
(2)步骤①中,配制100 mL 1.0mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏低
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液.
C.未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后;发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线.
F.烧杯中有少量水.
(3)请填写操作步骤中的空格:步骤②
(4)实验步骤5中应选用
A.100 mL B.200mL C.500mL
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积为Vm=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】I.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
①使用容量瓶的第一步操作是_____________________ 。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是_________ 。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________ 。
④若用上述仪器进行中和滴定,则缺少的仪器是__________ 。
Ⅱ某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:

试回答下列问题:
(1)用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是____________ 。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是_____ ,理由是________________ 。
(3)从滤液E中得到绿矾晶体的实验操作是________________ 。
(4)写出用滤渣F制备胆矾晶体的有关化学方程式_______________________ 。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理_________ ,理由是__________________ 。
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
①使用容量瓶的第一步操作是
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、
④若用上述仪器进行中和滴定,则缺少的仪器是
Ⅱ某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:

试回答下列问题:
(1)用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是
(3)从滤液E中得到绿矾晶体的实验操作是
(4)写出用滤渣F制备胆矾晶体的有关化学方程式
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】化学是以实验为基础的一门自然学科,化学实验是研究和学习物质及其变化的基本方法,是科学探究的一种重要途径,实验室欲配制235mL0.3mol·L-1的碳酸钠溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取___ gNa2CO3·10H2O固体。
(2)配制过程需用到的仪器:胶头滴管、托盘天平、药匙、烧杯、玻璃棒,还缺少的仪器是___ 。
(3)在配制过程中其他操作都正确,下列操作中会引起误差且使浓度偏小的是___ (填序号)。
①没有洗涤烧杯和玻璃棒
②容量瓶不干燥,含有少量蒸馏水
③未冷却到室温就将溶液转移到容量瓶并定容
④定容时俯视刻度线
(4)下列操作中,容量瓶所具备的功能有___ (填序号)。
①配制一定体积准确浓度的标准溶液
②长期贮存溶液
③用来溶解固体溶质
④常用来代替量筒量取一定体积的液体
(5)如图所示是分离混合物时常用的仪器,回答下列问题:
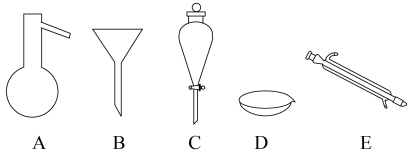
I.写出上述仪器的名称:A___ ,E___ 。
II.选择下列方法分离物质,将分离方法的序号填在横线上。
A.萃取B.分液C.冷却结晶D.蒸发结晶E.蒸馏F.过滤
①分离水和植物油的混合物:___ ;
②从硝酸钾中除去氯化钠杂质:___ ;
③分离饱和食盐水和碳酸钙的混合物:___ ;
④分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物:___ 。
(1)通过计算可知,应用托盘天平称取
(2)配制过程需用到的仪器:胶头滴管、托盘天平、药匙、烧杯、玻璃棒,还缺少的仪器是
(3)在配制过程中其他操作都正确,下列操作中会引起误差且使浓度偏小的是
①没有洗涤烧杯和玻璃棒
②容量瓶不干燥,含有少量蒸馏水
③未冷却到室温就将溶液转移到容量瓶并定容
④定容时俯视刻度线
(4)下列操作中,容量瓶所具备的功能有
①配制一定体积准确浓度的标准溶液
②长期贮存溶液
③用来溶解固体溶质
④常用来代替量筒量取一定体积的液体
(5)如图所示是分离混合物时常用的仪器,回答下列问题:

I.写出上述仪器的名称:A
II.选择下列方法分离物质,将分离方法的序号填在横线上。
A.萃取B.分液C.冷却结晶D.蒸发结晶E.蒸馏F.过滤
①分离水和植物油的混合物:
②从硝酸钾中除去氯化钠杂质:
③分离饱和食盐水和碳酸钙的混合物:
④分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物:
您最近一年使用:0次



