铁元素是人体必需的元素之一,补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表;第二代口服补铁剂以乳酸亚铁、富马酸亚铁等为代表。
(1)铁元素位于元素周期表的_____。
(2)基态Fe2+的核外电子排布式是_____。
(3)实验室配制FeSO4溶液时,常加入少量的_____。
(4)检验FeSO4溶液是否变质的试剂可用_____。
(5)血红蛋白是红细胞内运输氧的特殊蛋白质。血红蛋白中电负性最大的元素是______ (填写元素符号);O2通过配位键与血红蛋白中的Fe2+结合,O2提供_______ ,Fe2+提供_______ 。
(6)某兴趣小组用酸性KMnO4溶液滴定Fe2+,通过测定Fe2+的含量来计算某补铁剂中[CH3CH(OH)COO]2Fe·3H2O(乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是______ 。
(7)富马酸( )和马来酸(
)和马来酸( )为顺反异构体,两者的熔点及电离平衡常数如下表:
)为顺反异构体,两者的熔点及电离平衡常数如下表:
①富马酸分子中的σ键和π键个数比为______ 。
②氢键不仅存在于分子之间,也可以存在于分子内。解释富马酸的熔点比马来酸的熔点高的原因_______ 。预测a____ b(填“>”、“<”或“=”)。
(1)铁元素位于元素周期表的_____。
| A.s区 | B.d区 | C.p区 | D.f区 |
(2)基态Fe2+的核外电子排布式是_____。
| A.[Ar]3d54s2 | B.[Ar]3d54s1 | C.[Ar]3d5 | D.[Ar]3d6 |
(3)实验室配制FeSO4溶液时,常加入少量的_____。
| A.铁粉 | B.铜粉 | C.盐酸 | D.硫酸 |
(4)检验FeSO4溶液是否变质的试剂可用_____。
| A.稀盐酸 | B.酚酞试液 | C.KSCN溶液 | D.苯酚 |
(5)血红蛋白是红细胞内运输氧的特殊蛋白质。血红蛋白中电负性最大的元素是
(6)某兴趣小组用酸性KMnO4溶液滴定Fe2+,通过测定Fe2+的含量来计算某补铁剂中[CH3CH(OH)COO]2Fe·3H2O(乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是
(7)富马酸(
 )和马来酸(
)和马来酸( )为顺反异构体,两者的熔点及电离平衡常数如下表:
)为顺反异构体,两者的熔点及电离平衡常数如下表:| 物质名称 | 熔点 | Ka1 |
| 富马酸 | 300℃ | a |
| 马来酸 | 140℃ | b |
②氢键不仅存在于分子之间,也可以存在于分子内。解释富马酸的熔点比马来酸的熔点高的原因
更新时间:2024-01-17 15:00:17
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】稀土元素是指钪(Sc)、钇(Y)和镧系元素,共17种,位于元素周期表中第ⅢB族,均为金属元素,在工业生产中有重要的作用。回答下列问题:
(1)基态钪(Sc)元素的原子核外电子占据的轨道数目共_____ 个,钇(Y)位于元素周期表中钪(Sc)的下一周期,钇(Y)的价电子轨道表达式为_____ 。
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA( )是
)是_____ 齿配位体,EDTA所含元素原子第一电离能由大到小顺序为_____ 。
(3)钪(Sc)离子在水中以稳定对称的 存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为
存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为_____ 。
(4)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中铜原子的杂化类型为_____ (填“ ”或“
”或“ ”)。
”)。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是_____ 。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。铁酸钇( )的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
)的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
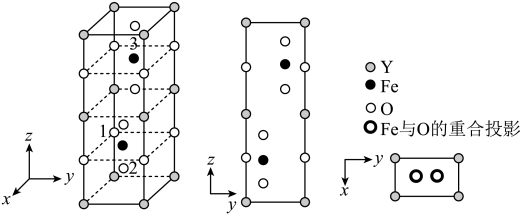
一个晶胞中有_____ 个O。已知1号O原子分数坐标为 ,2号O原子分数坐标为
,2号O原子分数坐标为 ,则3号Fe原子的分数坐标为
,则3号Fe原子的分数坐标为_____ 。
(1)基态钪(Sc)元素的原子核外电子占据的轨道数目共
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(
 )是
)是(3)钪(Sc)离子在水中以稳定对称的
 存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为
存在,其中O-Sc-O的键角只有90度和180度两种,其空间构型为(4)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。

①甘氨酸铜中铜原子的杂化类型为
 ”或“
”或“ ”)。
”)。②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。铁酸钇(
 )的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
)的正交相晶胞结构以及各原子的投影位置如图所示,晶胞棱边夹角均为90°。
一个晶胞中有
 ,2号O原子分数坐标为
,2号O原子分数坐标为 ,则3号Fe原子的分数坐标为
,则3号Fe原子的分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】在生命体系中,铜元素也发挥着至关重要的作用。其中,双核铜物种存在于细胞色素c和N2O还原酶中。在模拟生命体系进行双核铜物种的研究中,合成得到了如图5.1所示的大环配合物A,A中铜的价态可以发生变化,对应地,整个配合物显示不同的电荷数(n=0,1,2),记作 或
或 ,其中,L代表大环配体,后一表示中分别标识出两个Cu的价态x和y,x和y可取Ⅰ或Ⅱ。A的某些形式可以与气体如CO进一步发生配合作用。A及其可能羰基衍生物可以发生电子内转移、彼此作用,也可以与其他物种之间进行氧化还原反应。
,其中,L代表大环配体,后一表示中分别标识出两个Cu的价态x和y,x和y可取Ⅰ或Ⅱ。A的某些形式可以与气体如CO进一步发生配合作用。A及其可能羰基衍生物可以发生电子内转移、彼此作用,也可以与其他物种之间进行氧化还原反应。

在DMF溶液中,对相关物种的电化学研究得到如下数据:
注:电极电势E可近似当作标准电极电势 使用。
使用。
(1)分别写出n=0,1时A的表达式 及其中金属离子的价层电子组态(用
及其中金属离子的价层电子组态(用 表示),并预测其磁性(顺磁或抗磁)。实验测得,n=2时A的磁矩为
表示),并预测其磁性(顺磁或抗磁)。实验测得,n=2时A的磁矩为 ,简述原因
,简述原因___________ 。
(2)通过计算,确定25℃下反应 平衡常数
平衡常数 =
=___________ 。
(3)通过计算,确定反应 的结合常数
的结合常数 =
=___________ 。
(4)可以形成 和
和 ,但
,但 和CO不络合,简述原因
和CO不络合,简述原因___________ 。(提示:需要考虑金属离子的价态、配位特性、配体的特点等)。
 或
或 ,其中,L代表大环配体,后一表示中分别标识出两个Cu的价态x和y,x和y可取Ⅰ或Ⅱ。A的某些形式可以与气体如CO进一步发生配合作用。A及其可能羰基衍生物可以发生电子内转移、彼此作用,也可以与其他物种之间进行氧化还原反应。
,其中,L代表大环配体,后一表示中分别标识出两个Cu的价态x和y,x和y可取Ⅰ或Ⅱ。A的某些形式可以与气体如CO进一步发生配合作用。A及其可能羰基衍生物可以发生电子内转移、彼此作用,也可以与其他物种之间进行氧化还原反应。
在DMF溶液中,对相关物种的电化学研究得到如下数据:
| 电极反应 | 电极电势E注 | 电极反应 | 电极电势E |
1) | -0.518V | 3) | -0.380V |
2) | -0.908V | 4) | -0.876V |
 使用。
使用。(1)分别写出n=0,1时A的表达式
 及其中金属离子的价层电子组态(用
及其中金属离子的价层电子组态(用 表示),并预测其磁性(顺磁或抗磁)。实验测得,n=2时A的磁矩为
表示),并预测其磁性(顺磁或抗磁)。实验测得,n=2时A的磁矩为 ,简述原因
,简述原因(2)通过计算,确定25℃下反应
 平衡常数
平衡常数 =
=(3)通过计算,确定反应
 的结合常数
的结合常数 =
=(4)可以形成
 和
和 ,但
,但 和CO不络合,简述原因
和CO不络合,简述原因
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置是__ 。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:

①δ、α两种晶体晶胞中铁原子的配位数之比为__ ,γ晶胞中实际拥有___ 个原子。
②若Fe原子半径为rpm,NA表示阿伏加 德罗常数的值,则δ-Fe单质的密度为___ g/cm3(列出算式即可)。
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___ 。
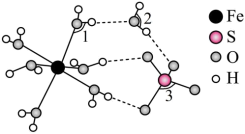
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
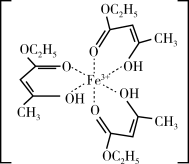
①此配合物中碳原子的杂化轨道类型有___ 。
②此配离子中含有的化学键有___ (填字母代号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.δ键 H.π键
(1)Fe元素在元素周期表中的位置是
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:

①δ、α两种晶体晶胞中铁原子的配位数之比为
②若Fe原子半径为rpm,NA表示阿伏加 德罗常数的值,则δ-Fe单质的密度为
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。

①此配合物中碳原子的杂化轨道类型有
②此配离子中含有的化学键有
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.δ键 H.π键
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】科学家合成非石墨烯型碳单质——联苯烯的过程如下。

(1)物质a中处于同一直线的碳原子个数最多为___________ 。
(2)物质b中元素电负性从大到小的顺序为___________ 。
(3)物质b之间可采取“ 拉链”相互识别活化位点的原因可能为
拉链”相互识别活化位点的原因可能为___________ 。
(4)物质c→联苯烯的反应类型为___________ 。
(5)锂离子电池负极材料中,锂离子嵌入数目越多,电池容量越大。石墨烯和联苯烯嵌锂的对比图如下。

①图a中
___________ 。
②对比石墨烯嵌锂,联苯烯嵌锂的能力___________ (填“更大”,“更小”或“不变”)。

(1)物质a中处于同一直线的碳原子个数最多为
(2)物质b中元素电负性从大到小的顺序为
(3)物质b之间可采取“
 拉链”相互识别活化位点的原因可能为
拉链”相互识别活化位点的原因可能为(4)物质c→联苯烯的反应类型为
(5)锂离子电池负极材料中,锂离子嵌入数目越多,电池容量越大。石墨烯和联苯烯嵌锂的对比图如下。

①图a中

②对比石墨烯嵌锂,联苯烯嵌锂的能力
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】空气明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。(已知阿伏加 德罗常数的值为NA)
(1)基态 Zn原子核外的最高能层符号是________ ,基态Zn2+最外层电子排布式为________ 。
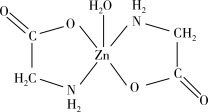
(2)乳酸锌[ ]是一种很好的食品锌强化剂,其中存在的作用力有
]是一种很好的食品锌强化剂,其中存在的作用力有________ (填编号)。1mol乳酸锌中含有________ 个σ键。
a.离子键 b.极性共价键 c.金属键 d.配位键 e.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是________ ,H2O分子的空间构型为________ 形,Zn2+的配位数为________ 。甘氨酸(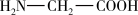 )中N原子的杂化轨道类型为
)中N原子的杂化轨道类型为________ ;甘氨酸易溶于水,试从结构角度解释________ 。
(4)Zn与S形成某种化合物的晶胞如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(0,0,0),则原子2的坐标为________ 。
②已知晶体密度为dg·cm-3,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为________ pm(写计算表达式)。
(1)基态 Zn原子核外的最高能层符号是
(2)乳酸锌[
 ]是一种很好的食品锌强化剂,其中存在的作用力有
]是一种很好的食品锌强化剂,其中存在的作用力有a.离子键 b.极性共价键 c.金属键 d.配位键 e.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是
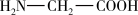 )中N原子的杂化轨道类型为
)中N原子的杂化轨道类型为
(4)Zn与S形成某种化合物的晶胞如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(0,0,0),则原子2的坐标为
②已知晶体密度为dg·cm-3,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】已知A、B、C、D、E、F、G是元素周期表前四周期的元素,且原子序数依次增大,其相关信息如下表所示:
回答下列问题:
(1)C元素位于第___________ 族___________ 区。
(2)A、B、C三种原子半径由大到小为___________ (用元素符号表示)。
(3)F元素基态原子的最高能级具有的原子轨道数为___________ ,该原子轨道呈___________ 形。
(4)D、E元素第一电离能大小比较为:___________ (用元素符号表示),原因是___________ 。
(5) 的电子排布式为
的电子排布式为___________ 。
(6)B、D形成的化合物能与水反应,化学方程式为___________ 。
| 元素代号 | 相关信息 |
| A | 原子核外有6种运动状态不同的电子 |
| B | 基态原子的最外层为3个未成对电子 |
| C | 电负性为4.0 |
| D | 其第一至第四电离能分别是: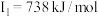 , ,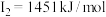 , ,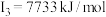 , ,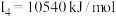 |
| E | 价层电子数等于其电子层数 |
| F | 基态原子的价层电子排布式为 |
| G | 基态原子核外有7个能级上有电子,且能量最高的能级上有6个电子 |
(1)C元素位于第
(2)A、B、C三种原子半径由大到小为
(3)F元素基态原子的最高能级具有的原子轨道数为
(4)D、E元素第一电离能大小比较为:
(5)
 的电子排布式为
的电子排布式为(6)B、D形成的化合物能与水反应,化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】氧化锌广泛应用于有机高分子材料、医药、食品等领域。以氧化锌烟灰(含 及少量
及少量 、
、 、
、 等)为原料制备氧化锌的工艺流程如下:
等)为原料制备氧化锌的工艺流程如下:

已知:用有机溶剂 从水溶液中萃取A时,
从水溶液中萃取A时,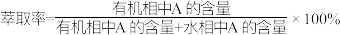
(1)为了提高酸浸效果,可采取的措施有______________________ (任写一点)。
(2)“滤渣1”的主要成分除了 还有
还有_________________________________ 。
(3)“沉铁”操作时不能用 代替
代替 ,原因是
,原因是_________________________________ 。
(4)若 、
、 时,用
时,用 萃取
萃取 溶液,
溶液, (水相)
(水相)
 (有机相)的平衡常数
(有机相)的平衡常数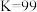 ,则用等体积的
,则用等体积的 一次性萃取
一次性萃取 溶液,
溶液, 萃取率为
萃取率为___________ (答案保留3位有效数字)
(5)“沉锌”时,可生成碱式碳酸锌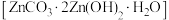 固体,请写出该反应的离子方程式
固体,请写出该反应的离子方程式_________________________________ 。
(6)锌可形成多种配合物。某种含锌配合物一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图1所示。请画出基态 的价电子排布图
的价电子排布图______________________ , 的配位数为
的配位数为___________ ;甘氨酸(如图2)易溶于水,原因是______________________ 。

 及少量
及少量 、
、 、
、 等)为原料制备氧化锌的工艺流程如下:
等)为原料制备氧化锌的工艺流程如下:
已知:用有机溶剂
 从水溶液中萃取A时,
从水溶液中萃取A时,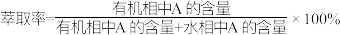
(1)为了提高酸浸效果,可采取的措施有
(2)“滤渣1”的主要成分除了
 还有
还有(3)“沉铁”操作时不能用
 代替
代替 ,原因是
,原因是(4)若
 、
、 时,用
时,用 萃取
萃取 溶液,
溶液, (水相)
(水相)
 (有机相)的平衡常数
(有机相)的平衡常数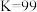 ,则用等体积的
,则用等体积的 一次性萃取
一次性萃取 溶液,
溶液, 萃取率为
萃取率为(5)“沉锌”时,可生成碱式碳酸锌
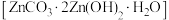 固体,请写出该反应的离子方程式
固体,请写出该反应的离子方程式(6)锌可形成多种配合物。某种含锌配合物一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图1所示。请画出基态
 的价电子排布图
的价电子排布图 的配位数为
的配位数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】铜及其化合物在机械制造、国防建设中有着广泛的应用。回答下列问题:
(1)写出氢氧化铜溶于氨水的离子方程式___________ 。
(2)若[Cu(NH3)4]2+中两个NH3分别被C1-取代,能得到(m)、(n)两种不同结构的Cu(NH3)2C12:

则[Cu(NH3)4]2+的空间构型是___________ ;不同结构的Cu(NH3)2C12在水中的溶解度:(m)___________ (n)(填“>”、“=”或“<”)。
(3)Cu2+与乙二胺可形成如图所示配离子。

Cu2+的配位数为___________ ;Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是___________ (填字母代号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,理由是___________ 。
(1)写出氢氧化铜溶于氨水的离子方程式
(2)若[Cu(NH3)4]2+中两个NH3分别被C1-取代,能得到(m)、(n)两种不同结构的Cu(NH3)2C12:

则[Cu(NH3)4]2+的空间构型是
(3)Cu2+与乙二胺可形成如图所示配离子。

Cu2+的配位数为
a.配位键 b.极性键 c.离子键 d.非极性键
(4)NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,理由是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】 是重要的化工原料,可发生如下转化:
是重要的化工原料,可发生如下转化: ,可得到氮肥硫酸铵,写出该反应的化学方程式
,可得到氮肥硫酸铵,写出该反应的化学方程式______ 。
(2)氨气可经途径II的多步反应制得硝酸,下列有关说法正确的是______。
(3)醋酸(熔点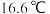 )、硝酸(熔点
)、硝酸(熔点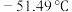 )这两种相对分子质量相近的分子熔沸点相差较大的主要原因是
)这两种相对分子质量相近的分子熔沸点相差较大的主要原因是______ 。
(4) 与
与 性质相似,写出足量
性质相似,写出足量 与稀硫酸反应所得产物的化学式
与稀硫酸反应所得产物的化学式______ 。
(5)途径 中
中 过量,用离子方程式解释途径
过量,用离子方程式解释途径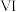 中溶液颜色变化的原因
中溶液颜色变化的原因______ 。
(6) 可与
可与 反应得到化合物
反应得到化合物 和一种无机盐,设计实验验证产物中分离出的化合物
和一种无机盐,设计实验验证产物中分离出的化合物 中含有氮元素
中含有氮元素______ 。
 是重要的化工原料,可发生如下转化:
是重要的化工原料,可发生如下转化: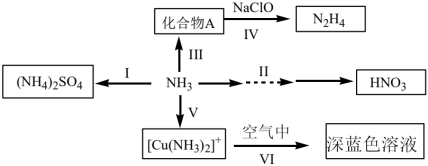
①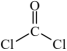
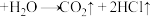 ;②
;② (无色)容易被空气氧化
(无色)容易被空气氧化
 ,可得到氮肥硫酸铵,写出该反应的化学方程式
,可得到氮肥硫酸铵,写出该反应的化学方程式(2)氨气可经途径II的多步反应制得硝酸,下列有关说法正确的是______。
A.工业生产得到的浓硝酸,常因溶解了 而略显黄色 而略显黄色 |
B.氨气先经过催化氧化得到 , , 再与水反应生成硝酸 再与水反应生成硝酸 |
C.浓硝酸与甘油在一定条件下反应生成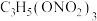 ,该反应为酯化反应 ,该反应为酯化反应 |
| D.工业上常用铁罐车或铝罐车运送浓硝酸,是因为常温下它们和浓硝酸不反应 |
(3)醋酸(熔点
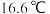 )、硝酸(熔点
)、硝酸(熔点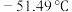 )这两种相对分子质量相近的分子熔沸点相差较大的主要原因是
)这两种相对分子质量相近的分子熔沸点相差较大的主要原因是(4)
 与
与 性质相似,写出足量
性质相似,写出足量 与稀硫酸反应所得产物的化学式
与稀硫酸反应所得产物的化学式(5)途径
 中
中 过量,用离子方程式解释途径
过量,用离子方程式解释途径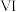 中溶液颜色变化的原因
中溶液颜色变化的原因(6)
 可与
可与 反应得到化合物
反应得到化合物 和一种无机盐,设计实验验证产物中分离出的化合物
和一种无机盐,设计实验验证产物中分离出的化合物 中含有氮元素
中含有氮元素
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】硼、砷、铁等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A.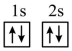 B.
B.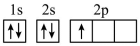
C.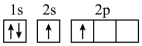 D.
D.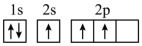
(2)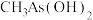 与
与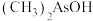 两种含砷有机酸中沸点较高的是
两种含砷有机酸中沸点较高的是_______ (填化学式),原因为_______ 。
(3)LiZnAs晶体的立方晶胞结构如下图1所示,N点原子分数坐标为 ;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体
;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体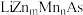 ,其立方晶胞结构如下图2所示。
,其立方晶胞结构如下图2所示。
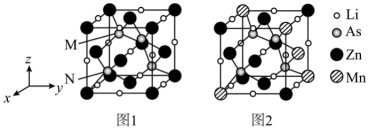
①M点原子分数坐标为_______ 。
②m=_______ 。
③已知 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,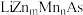 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为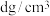 。晶胞中As原子与Mn原子之间的最短距离为
。晶胞中As原子与Mn原子之间的最短距离为_______ nm(列出计算式)。
(4) 的结构如下图所示。
的结构如下图所示。
图示 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是_______ (填序号)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B.
C.
 D.
D.
(2)
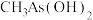 与
与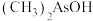 两种含砷有机酸中沸点较高的是
两种含砷有机酸中沸点较高的是(3)LiZnAs晶体的立方晶胞结构如下图1所示,N点原子分数坐标为
 ;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体
;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体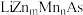 ,其立方晶胞结构如下图2所示。
,其立方晶胞结构如下图2所示。
①M点原子分数坐标为
②m=
③已知
 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,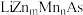 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为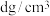 。晶胞中As原子与Mn原子之间的最短距离为
。晶胞中As原子与Mn原子之间的最短距离为(4)
 的结构如下图所示。
的结构如下图所示。
图示
 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高频、大功率和抗辐射等优点。请回答:
(1)Ga的第一电离能失去的是___________ 能级的电子。
(2)B、C、N的电负性由大到小排列为___________ 。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H-N=C=S),其原因是___________ 。
(4)卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为___________ ;I 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为___________ 。
(5)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为___________ 。
(6)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为___________ (填序号)。
III.金属铁是生活中最常见的金属,其晶胞为体心立方堆积。
(7)其晶胞的俯视图为____ (填字母序号)。
(8)若铁的密度为a g/cm3,则铁晶胞中最近的两个铁原子的核间距离是____ pm(列表达式即可)。
(1)Ga的第一电离能失去的是
(2)B、C、N的电负性由大到小排列为
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H-N=C=S),其原因是
(4)卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为
 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(5)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为
(6)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为
III.金属铁是生活中最常见的金属,其晶胞为体心立方堆积。
(7)其晶胞的俯视图为____ (填字母序号)。
A. | B. | C.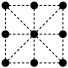 | D. |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】超导材料和超导技术是2世纪最伟大的发现之一,有着广阔的应用前景。我国科学家发现了一种新型的超导体材料 ,由
,由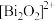 和
和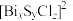 交替堆叠构成。其中A层是由
交替堆叠构成。其中A层是由 无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。
无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。

(1)画出基态S的价电子排布图_______ 。
(2)写出A层离子的化学式_______ 。A层各元素的第一电离能由大到小的顺序为_______ 。
(3)“依布硒”( )具有良好的抗炎活性。下列说法正确的是
)具有良好的抗炎活性。下列说法正确的是_______ 。
a.Se采用sp3的方式杂化
b.分子中各个C原子的杂化方式不同
c.分子中既含有极性共价键,又含有非极性共价键
d.分子中 和
和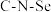 的键角相同
的键角相同
(4)H2O和H2S都是分子晶体,熔沸点较高的是_______ ,原因是_______ 。
(5)83Bi是第_______ 周期VA族元素, 是一种极少数不溶性的钠盐,其阴离子的立体构型为
是一种极少数不溶性的钠盐,其阴离子的立体构型为_______ 。
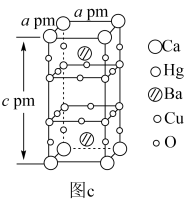
(6)汞钡铜氧晶体通过掺杂Ca2+可以获得具有更高临界温度的超导材料,如图c所示。其密度为_______  (列式表示、设NA为阿伏加德罗常数的值)。
(列式表示、设NA为阿伏加德罗常数的值)。
 ,由
,由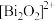 和
和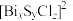 交替堆叠构成。其中A层是由
交替堆叠构成。其中A层是由 无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。
无限四方平面层构成,S原子位于八面体上下顶点上(如图a),其俯视图如图b。
(1)画出基态S的价电子排布图
(2)写出A层离子的化学式
(3)“依布硒”(
 )具有良好的抗炎活性。下列说法正确的是
)具有良好的抗炎活性。下列说法正确的是a.Se采用sp3的方式杂化
b.分子中各个C原子的杂化方式不同
c.分子中既含有极性共价键,又含有非极性共价键
d.分子中
 和
和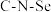 的键角相同
的键角相同(4)H2O和H2S都是分子晶体,熔沸点较高的是
(5)83Bi是第
 是一种极少数不溶性的钠盐,其阴离子的立体构型为
是一种极少数不溶性的钠盐,其阴离子的立体构型为(6)汞钡铜氧晶体通过掺杂Ca2+可以获得具有更高临界温度的超导材料,如图c所示。其密度为
 (列式表示、设NA为阿伏加德罗常数的值)。
(列式表示、设NA为阿伏加德罗常数的值)。
您最近一年使用:0次



