亚铁盐由于具有较强的还原性,久置于空气中容易氧化变质,日常实验中常以复盐硫酸亚铁铵晶体 代替绿矾(
代替绿矾( )等亚铁盐使用,这样可以延长保存时间,不易氧化变质。已知:硫酸亚铁铵晶体在蒸馏水中的溶解情况如下表:
)等亚铁盐使用,这样可以延长保存时间,不易氧化变质。已知:硫酸亚铁铵晶体在蒸馏水中的溶解情况如下表:
(1)①在制备硫酸亚铁铵晶体时,为了防止被氧化,需除去溶解氧,所配制 溶液、
溶液、 溶液等都必须预先经过
溶液等都必须预先经过___________ (操作)处理后再使用。向 溶液中加入饱和
溶液中加入饱和 溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得到一种浅蓝绿色的晶体,此晶体即为硫酸亚铁铵晶体。
溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得到一种浅蓝绿色的晶体,此晶体即为硫酸亚铁铵晶体。
②在上述洗涤操作步骤中,下列蒸馏水最适合作为洗涤剂的是___________ (填字母)。
A.沸水 B.冰水 C.温水 D.常温
(2)取少量制得晶体按下图进行实验,
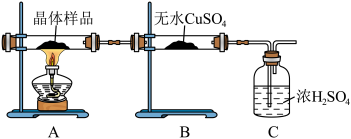
①若B装置中无水 变蓝证明含有结晶水,C装置的作用是
变蓝证明含有结晶水,C装置的作用是___________ 。
②另取少量晶体于试管中,加水溶解,___________ (填操作与现象),证明晶体中有 ,用相关的离子方程式说明产生该现象的原理:
,用相关的离子方程式说明产生该现象的原理:___________ 。
 代替绿矾(
代替绿矾( )等亚铁盐使用,这样可以延长保存时间,不易氧化变质。已知:硫酸亚铁铵晶体在蒸馏水中的溶解情况如下表:
)等亚铁盐使用,这样可以延长保存时间,不易氧化变质。已知:硫酸亚铁铵晶体在蒸馏水中的溶解情况如下表:| 溶剂 | 蒸馏水 | ||||
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 9.8 | 22.0 | 28.2 | 35.7 | 45.2 |
(1)①在制备硫酸亚铁铵晶体时,为了防止被氧化,需除去溶解氧,所配制
 溶液、
溶液、 溶液等都必须预先经过
溶液等都必须预先经过 溶液中加入饱和
溶液中加入饱和 溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得到一种浅蓝绿色的晶体,此晶体即为硫酸亚铁铵晶体。
溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得到一种浅蓝绿色的晶体,此晶体即为硫酸亚铁铵晶体。②在上述洗涤操作步骤中,下列蒸馏水最适合作为洗涤剂的是
A.沸水 B.冰水 C.温水 D.常温
(2)取少量制得晶体按下图进行实验,

①若B装置中无水
 变蓝证明含有结晶水,C装置的作用是
变蓝证明含有结晶水,C装置的作用是②另取少量晶体于试管中,加水溶解,
 ,用相关的离子方程式说明产生该现象的原理:
,用相关的离子方程式说明产生该现象的原理:
更新时间:2024-01-29 14:32:18
|
相似题推荐
【推荐1】某种催化剂为铁的氧化物。化学兴趣小组对该催化剂中铁元素的价态进行了探究。请回答下列实验方案中的有关问题:
(一)实验仪器与试剂
仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
试剂:3mol·L-1H2SO4、6mol·L-1HNO3、0.01mol·L-1KMnO4、NaOH稀溶液、20%KSCN溶液、蒸馏水。
(二)实验原理
Fe2+能使酸性KMnO4溶液紫色褪去;Fe3+溶液中滴加KSCN溶液变红色。
(1)一位同学将少许样品溶于稀硝酸中,取少许溶液滴加KSCN溶液后出现红色。由此得出为铁元素为+3价的结论。该结论是否合理___ ,并说明理由___ 。
(三)实验设计
(2)提出合理假设。
假设1:催化剂中铁元素全部为+3价;
假设2:催化剂中铁元素全部为+2价;
假设3:___ 。
(3)设计实验证明假设。请完成下表中的实验操作步骤,预期现象与结论。
(一)实验仪器与试剂
仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
试剂:3mol·L-1H2SO4、6mol·L-1HNO3、0.01mol·L-1KMnO4、NaOH稀溶液、20%KSCN溶液、蒸馏水。
(二)实验原理
Fe2+能使酸性KMnO4溶液紫色褪去;Fe3+溶液中滴加KSCN溶液变红色。
(1)一位同学将少许样品溶于稀硝酸中,取少许溶液滴加KSCN溶液后出现红色。由此得出为铁元素为+3价的结论。该结论是否合理
(三)实验设计
(2)提出合理假设。
假设1:催化剂中铁元素全部为+3价;
假设2:催化剂中铁元素全部为+2价;
假设3:
(3)设计实验证明假设。请完成下表中的实验操作步骤,预期现象与结论。
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用滴管取一定量3mol·L-1H2SO4于试管中,加热煮沸数分钟以出去溶于其中的氧气。 | 无明显现象 |
| 步骤2:用药匙取少量样品于试管中,用滴管加入除氧的3mol·L-1H2SO4,并加热,充分反应后得A溶液。 | 固体溶解,溶液颜色发生变化 |
| 步骤3:取少许A溶液于试管中滴加1~2滴20%KSCN溶液,振荡 | 若溶液不呈红色,则假设2成立;若溶液呈红色,则假设1或假设3成立 |
| 步骤4:另取少许A溶液于试管中, | 结合③,若 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】铁及其化合物在日常生活中应用十分广泛,在国民经济的发展中起着举足轻重的作用。特制的纯净的四氧化三铁可用来作录音磁带和电讯器材的原材料,在自然界中存在的磁铁矿,其主要成分就是Fe3O4。高铁酸盐(如高铁酸钾:K2FeO4)可作为新一代水处理剂,其制备方法如下:将Na2O2和FeSO4按物质的量之比3:1的比例依次投入密闭反应器中,在氮气流中于700℃下反应一小时得到Na2FeO4粉末,将其溶于NaOH溶液,快速过滤。滤液转移至另容器中,加入等物质的量的KOH固体,析出K2FeO4晶体。过滤后用95%乙醇洗涤,真空干燥得成品K2FeO4
(1)用铁的+2价、+3价的氧化物形式表示Fe3O4可写成_____________________________
(2)Fe3O4能与稀硫酸反应生成两种盐,验证反应后溶液中含有Fe3+所用的试剂是______ (填写编号):验证反应后溶液中还含有Fe2+所需要的试剂是 ________ (填写编号)。
可供选择的试剂有:
①氯水;②高锰酸钾溶液;③硫氰化钾溶液;④稀硫酸 ;⑤NaOH溶液
(3)在酸性条件下,用绿色试剂H2O2可将Fe2+氧化为Fe3+,写出反应的离子方程式____________________________________________
(4)K2FeO4在酸性条件下不稳定,会产生一种无色无味的气体,反应如下。请完成并配平离子反应方程式
( )H++( )FeO42- ===( )Fe3++( ) +( )H2O_____________
(5)在K2FeO4制备过程中选择的洗涤剂是95%乙醇,该洗涤操作的过程是_______________
(1)用铁的+2价、+3价的氧化物形式表示Fe3O4可写成
(2)Fe3O4能与稀硫酸反应生成两种盐,验证反应后溶液中含有Fe3+所用的试剂是
可供选择的试剂有:
①氯水;②高锰酸钾溶液;③硫氰化钾溶液;④稀硫酸 ;⑤NaOH溶液
(3)在酸性条件下,用绿色试剂H2O2可将Fe2+氧化为Fe3+,写出反应的离子方程式
(4)K2FeO4在酸性条件下不稳定,会产生一种无色无味的气体,反应如下。请完成并配平离子反应方程式
( )H++( )FeO42- ===( )Fe3++( ) +( )H2O
(5)在K2FeO4制备过程中选择的洗涤剂是95%乙醇,该洗涤操作的过程是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题:
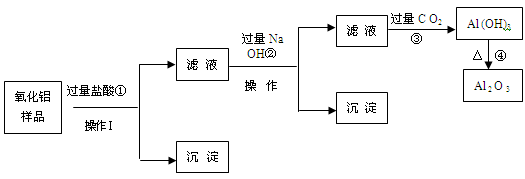
(1)沉淀A的成分是_______ (填化学式),沉淀B的成分是_______ (填化学式);
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为:_______ 、 _______ ;
(3)在操作Ⅰ的名称是_______ ,其中玻璃棒的作用是_______ 。

(1)沉淀A的成分是
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为:
(3)在操作Ⅰ的名称是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
I.掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为一套实验装置。

(1)写出仪器的名称:①_______
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器_______ ;该分离操作的名称为_______ ;进行分离操作时进水口为_______ (填f或g)。
II.
(3)某同学按下列步骤配制500mL0.200mol∙L-1KCl溶液,请回答有关问题。
I.掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为一套实验装置。

(1)写出仪器的名称:①
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器
II.
(3)某同学按下列步骤配制500mL0.200mol∙L-1KCl溶液,请回答有关问题。
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要KCl的质量为 |
| ②称量KCl固体 | 称量过程中主要用到的仪器是: |
| ③将KCl加入100mL烧杯中,并加入适量水溶解 | 为了加快溶解速率,可以采取的措施有: |
| ④将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取的措施是 |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意: |
您最近一年使用:0次
【推荐3】工业上常利用含硫废水生产 Na2S2O3·5H2O,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(Ⅱ)
S(g)+Na2SO3(aq) Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液柱,若___________ ,则整个装置气密性良好,装置 D 的作用是___________ 。
(2)装置 B 的作用之一是观察 SO2 的生成速率,其中的液体最好选择___________
a.蒸馏水 b.饱和 Na2SO3 溶液 c.饱和 NaHSO3 溶液 d.饱和 NaHCO3 溶液
实验中,为使 SO2 缓慢进入烧瓶 C,采用的操作是___________ ,已知反应(Ⅲ)相对较慢,则烧瓶 C 中反应达到终点的现象是___________ 。
(3)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3 恰好完全反应,则烧瓶 C 中 Na2S 和 Na2SO3 物质的量之比为___________ 。
(4)反应终止后,烧瓶 C 中的溶液经蒸发浓缩、冷却结晶即可析出 Na2S2O3•5H2O,其中可能含有 Na2SO3、 Na2SO4 等杂质,利用所给试剂设计实验,检测产品中是否存在 Na2SO4,简要说明实验操作、现象和结论:___________ 。
已知 Na2S2O3•5H2O 遇酸易分解:S2O +2H+=S↓+SO2↑+H2O,供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2 溶液、AgNO3 溶液。
+2H+=S↓+SO2↑+H2O,供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2 溶液、AgNO3 溶液。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(Ⅱ)
S(g)+Na2SO3(aq)
 Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)(1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液柱,若
(2)装置 B 的作用之一是观察 SO2 的生成速率,其中的液体最好选择
a.蒸馏水 b.饱和 Na2SO3 溶液 c.饱和 NaHSO3 溶液 d.饱和 NaHCO3 溶液
实验中,为使 SO2 缓慢进入烧瓶 C,采用的操作是
(3)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3 恰好完全反应,则烧瓶 C 中 Na2S 和 Na2SO3 物质的量之比为
(4)反应终止后,烧瓶 C 中的溶液经蒸发浓缩、冷却结晶即可析出 Na2S2O3•5H2O,其中可能含有 Na2SO3、 Na2SO4 等杂质,利用所给试剂设计实验,检测产品中是否存在 Na2SO4,简要说明实验操作、现象和结论:
已知 Na2S2O3•5H2O 遇酸易分解:S2O
 +2H+=S↓+SO2↑+H2O,供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2 溶液、AgNO3 溶液。
+2H+=S↓+SO2↑+H2O,供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2 溶液、AgNO3 溶液。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】某酸性废液中含有Fe3+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对该废液进行处理(所加试剂均稍过量),以回收金属,保护环境。

请回答:
(1)沉淀a中含有的单质是________ 。 沉淀c的化学式是________ 。
(2)铁屑加入废液中反应的离子方程式____________ 。
(3)H2O2溶液的作用______ 。 溶液A与H2O2溶液在酸性条件下反应的离子方程式是__ 。

请回答:
(1)沉淀a中含有的单质是
(2)铁屑加入废液中反应的离子方程式
(3)H2O2溶液的作用
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。如图是海水综合利用的部分流程图,据图回答问题:
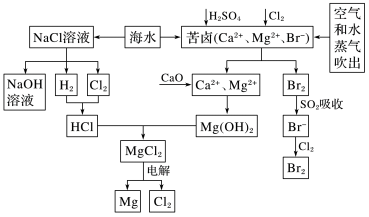
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、 等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):
等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):________________________ 。
(2)①电解饱和食盐水的化学方程式为___________ 。
②海水提取的单质Mg可以在二氧化碳中燃烧,该反应的化学方程式为__________ 。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生反应的离子方程式:_____________ ,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为_____________ 。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是__________ ;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用________ 方法得到单质Br2。

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、
 等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):
等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):(2)①电解饱和食盐水的化学方程式为
②海水提取的单质Mg可以在二氧化碳中燃烧,该反应的化学方程式为
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生反应的离子方程式:
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。
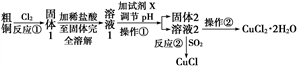
按要求回答下列问题:
(1)操作①的名称是________ ,检验溶液2中是否含有杂质离子的试剂是________ 。操作②需在氯化氢气流中经过加热浓缩、________ 、过滤、洗涤、干燥。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是________________________ ;溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)________ 。
a.NaOH b.NH3·H2O
c.CuO d.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:_______________ 。

按要求回答下列问题:
(1)操作①的名称是
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是
a.NaOH b.NH3·H2O
c.CuO d.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】以碳酸锰矿(主要成分为MnCO3、MnS、MgO、CaO)和软锰矿(主要成分为MnO2)为原料制取大颗粒的电池用Mn3O4。其工艺主要包括“联合浸锰”、“沉淀除杂”、“溶解转化”、“氧化分解”。
(1)联合浸锰。向反应器中加入一定量稀硫酸,然后依次加入软锰矿、碳酸锰矿,充分反应后过滤得到含MnSO4的酸浸液。其中生成单质S反应的离子方程式为____ 。若碳酸锰矿先于软锰矿加入,会产生一种有毒气体,该气体的化学式为____ 。
(2)沉淀除杂。向上述酸浸液中加入pH调节剂再通入CO2,过滤,洗涤,干燥得到MnCO3。“洗涤”步骤中,证明MnCO3已经洗涤干净的实验操作及现象是____ 。
(3)溶解转化、氧化分解。MnCO3经过溶解、沉淀,得到Mn(OH)2沉淀。向该沉淀中加水,边加热边持续通空气可得到Mn3O4。其中生成Mn3O4的化学方程式为____ 。
(4)Mn3O4含量测定:准确称取0.4580 g Mn3O4样品于锥形瓶中,加入25.00 mL 0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+ +8H+=3Mn2++2CO2↑+4H2O、
+8H+=3Mn2++2CO2↑+4H2O、 +
+ +H+→Mn2++CO2↑+H2O(未配平)
+H+→Mn2++CO2↑+H2O(未配平)
计算Mn3O4样品的纯度(写出计算过程)____ 。
(1)联合浸锰。向反应器中加入一定量稀硫酸,然后依次加入软锰矿、碳酸锰矿,充分反应后过滤得到含MnSO4的酸浸液。其中生成单质S反应的离子方程式为
(2)沉淀除杂。向上述酸浸液中加入pH调节剂再通入CO2,过滤,洗涤,干燥得到MnCO3。“洗涤”步骤中,证明MnCO3已经洗涤干净的实验操作及现象是
(3)溶解转化、氧化分解。MnCO3经过溶解、沉淀,得到Mn(OH)2沉淀。向该沉淀中加水,边加热边持续通空气可得到Mn3O4。其中生成Mn3O4的化学方程式为
(4)Mn3O4含量测定:准确称取0.4580 g Mn3O4样品于锥形瓶中,加入25.00 mL 0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+
 +8H+=3Mn2++2CO2↑+4H2O、
+8H+=3Mn2++2CO2↑+4H2O、 +
+ +H+→Mn2++CO2↑+H2O(未配平)
+H+→Mn2++CO2↑+H2O(未配平)计算Mn3O4样品的纯度(写出计算过程)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铁是应用最广泛的金属,铁的卤化物,氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)铁元素在周期表中的位置为_______ 。
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=_____ 。
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为_____ 。
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为________ 。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_______ 。
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式__________ 。
(1)铁元素在周期表中的位置为
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式
您最近一年使用:0次
【推荐3】纳米铜粉具有比表面大、表面活性中心数目多、颗粒极细且软等性能在众多领域有着巨大的潜在应用价值。常用热分解、还原法、电解法来制取纳米铜粉。
(1)草酸铜(CuC2O4)在氩气中热分解可制备纳米铜粉,其化学方程式为________________________ 。
(2)一定温度和pH条件下,将水合肼溶液与硫酸四氨合铜溶液按照适当比例混合发生氧化还原反应,制备纳米铜粉。
已知:Cu2++4NH3 [Cu(NH3)4]2+ ,Cu2++2N2H4
[Cu(NH3)4]2+ ,Cu2++2N2H4 [Cu(N2H4)2]2+
[Cu(N2H4)2]2+
①[Cu(NH3)4]2+中铜离子基态核外电子排布式为________________________ 。
②固定水温70°C,反应时间1h,水合肼溶液浓度和pH值对铜产率的影响如图所示。

当水合肼浓度继续增加到3.25 mol·L-1时,铜产率下降的原因是___________________________________ ;当pH值继续上升时,铜产率有下降的趋势,这原因是________________________________________ 。
(3)制取纳米铜粉都需要硫酸铜溶液,通过下列方法可测定硫酸铜晶体(CuSO4·5H2O)的纯度:准确称取5.000 g硫酸铜晶体于烧杯中,加入5mL l mol·L-1H2SO4溶液和少量水,配成250.00 mL溶液。取上述25.00 mL溶液至碘量瓶中,加入10 mL10%足量KI溶液(2Cu2++4I-=2CuI↓+I2),加入淀粉作指示剂,用0.1000 mol·L-1Na2S2O3溶液滴定至浅蓝色(I2+2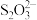 =
=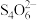 +2I-),再加入10%KSCN溶液10mL,使CuI沉淀完全转化为CuSCN沉淀,(目的是释放出吸附在CuI表面上的I2),溶液蓝色加深,再继续用Na2S2O3溶液滴定至蓝色刚好消失,共消耗Na2S2O3溶液19.80 mL,计算CuSO4·5H2O样品的纯度(写出计算过程)
+2I-),再加入10%KSCN溶液10mL,使CuI沉淀完全转化为CuSCN沉淀,(目的是释放出吸附在CuI表面上的I2),溶液蓝色加深,再继续用Na2S2O3溶液滴定至蓝色刚好消失,共消耗Na2S2O3溶液19.80 mL,计算CuSO4·5H2O样品的纯度(写出计算过程) ______________________
(1)草酸铜(CuC2O4)在氩气中热分解可制备纳米铜粉,其化学方程式为
(2)一定温度和pH条件下,将水合肼溶液与硫酸四氨合铜溶液按照适当比例混合发生氧化还原反应,制备纳米铜粉。
已知:Cu2++4NH3
 [Cu(NH3)4]2+ ,Cu2++2N2H4
[Cu(NH3)4]2+ ,Cu2++2N2H4 [Cu(N2H4)2]2+
[Cu(N2H4)2]2+①[Cu(NH3)4]2+中铜离子基态核外电子排布式为
②固定水温70°C,反应时间1h,水合肼溶液浓度和pH值对铜产率的影响如图所示。

当水合肼浓度继续增加到3.25 mol·L-1时,铜产率下降的原因是
(3)制取纳米铜粉都需要硫酸铜溶液,通过下列方法可测定硫酸铜晶体(CuSO4·5H2O)的纯度:准确称取5.000 g硫酸铜晶体于烧杯中,加入5mL l mol·L-1H2SO4溶液和少量水,配成250.00 mL溶液。取上述25.00 mL溶液至碘量瓶中,加入10 mL10%足量KI溶液(2Cu2++4I-=2CuI↓+I2),加入淀粉作指示剂,用0.1000 mol·L-1Na2S2O3溶液滴定至浅蓝色(I2+2
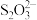 =
=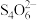 +2I-),再加入10%KSCN溶液10mL,使CuI沉淀完全转化为CuSCN沉淀,(目的是释放出吸附在CuI表面上的I2),溶液蓝色加深,再继续用Na2S2O3溶液滴定至蓝色刚好消失,共消耗Na2S2O3溶液19.80 mL,计算CuSO4·5H2O样品的纯度(写出计算过程)
+2I-),再加入10%KSCN溶液10mL,使CuI沉淀完全转化为CuSCN沉淀,(目的是释放出吸附在CuI表面上的I2),溶液蓝色加深,再继续用Na2S2O3溶液滴定至蓝色刚好消失,共消耗Na2S2O3溶液19.80 mL,计算CuSO4·5H2O样品的纯度(写出计算过程)
您最近一年使用:0次



