乙二胺四乙酸常用作络合剂,可简写为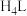 ,常用
,常用 、
、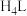 、
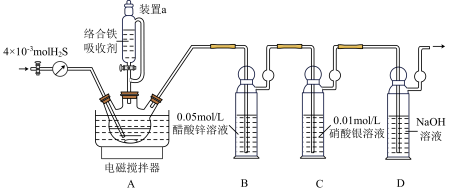
、 制备络合铁吸收剂,利用络合铁法脱硫设计如下装置。
制备络合铁吸收剂,利用络合铁法脱硫设计如下装置。
已知:
i.25℃时,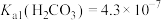 ,
,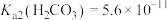 ,
,
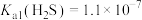 ,
,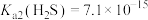 ,
, .
.
ii.25℃时, ,
,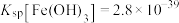 .
.
(1)装置a名称为____________ ,其作用是____________ .
(2)“络合铁吸收剂”中铁元素主要存在形式为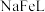 ,制备的反应为
,制备的反应为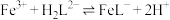 ,其平衡常数表达式
,其平衡常数表达式
____________ .
(3)“络合铁吸收剂”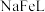 脱硫时溶液
脱硫时溶液 为8.5,将
为8.5,将 转化为
转化为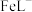 的目的是
的目的是____________ .
(4)开始时,A中 与
与 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为____________ ,后续发生反应为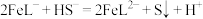 .
.
(5)B中发生反应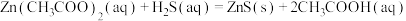 ,其目的是吸收A中未反应的
,其目的是吸收A中未反应的 ,该反应平衡常数
,该反应平衡常数
____________ (列出计算式).
(6)滴入络合铁吸收剂,打开电磁搅拌器并恒温至25℃.通入 反应结束后,取出B中的溶液,加入
反应结束后,取出B中的溶液,加入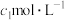 碘标准液
碘标准液 ,用
,用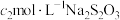 溶液滴定,待溶液变为淡黄色后,加入
溶液滴定,待溶液变为淡黄色后,加入 滴淀粉指示剂,继续滴定,消耗
滴淀粉指示剂,继续滴定,消耗 .
.
已知:滴定反应为 .
.
①滴定终点的现象为____________ .
②络合铁吸收剂对 的脱硫率为
的脱硫率为____________ (列出计算式).
③滴定结束后,若滴定管尖嘴处产生气泡,则测得脱硫率____________ (填“偏大”“偏小”或“不变”).
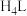 ,常用
,常用 、
、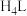 、
、 制备络合铁吸收剂,利用络合铁法脱硫设计如下装置。
制备络合铁吸收剂,利用络合铁法脱硫设计如下装置。
已知:
i.25℃时,
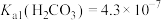 ,
,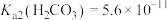 ,
,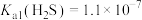 ,
, ,
, .
.ii.25℃时,
 ,
,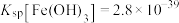 .
.(1)装置a名称为
(2)“络合铁吸收剂”中铁元素主要存在形式为
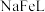 ,制备的反应为
,制备的反应为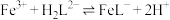 ,其平衡常数表达式
,其平衡常数表达式
(3)“络合铁吸收剂”
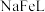 脱硫时溶液
脱硫时溶液 为8.5,将
为8.5,将 转化为
转化为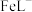 的目的是
的目的是(4)开始时,A中
 与
与 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为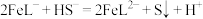 .
.(5)B中发生反应
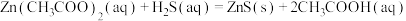 ,其目的是吸收A中未反应的
,其目的是吸收A中未反应的 ,该反应平衡常数
,该反应平衡常数
(6)滴入络合铁吸收剂,打开电磁搅拌器并恒温至25℃.通入
 反应结束后,取出B中的溶液,加入
反应结束后,取出B中的溶液,加入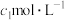 碘标准液
碘标准液 ,用
,用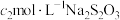 溶液滴定,待溶液变为淡黄色后,加入
溶液滴定,待溶液变为淡黄色后,加入 滴淀粉指示剂,继续滴定,消耗
滴淀粉指示剂,继续滴定,消耗 .
.已知:滴定反应为
 .
.①滴定终点的现象为
②络合铁吸收剂对
 的脱硫率为
的脱硫率为③滴定结束后,若滴定管尖嘴处产生气泡,则测得脱硫率
更新时间:2024-02-17 09:05:18
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】 溶液可用于消毒、杀菌及水的处理等。25℃时,有关物质的电离常数如下表所示:
溶液可用于消毒、杀菌及水的处理等。25℃时,有关物质的电离常数如下表所示:
回答下列问题:
(1)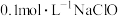 溶液中,离子浓度从大到小的顺序是
溶液中,离子浓度从大到小的顺序是_ ;25℃时,反应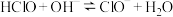 的平衡常数K=
的平衡常数K=_ 。
(2) 溶液在空气中吸收
溶液在空气中吸收 的离子方程式为
的离子方程式为_______ 。
(3)反应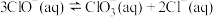 在室温下能自发进行。
在室温下能自发进行。
①T℃时,该反应的平衡常数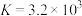 。若某混合溶液中
。若某混合溶液中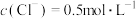 ,
,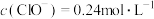 ,
,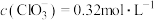 ,则
,则 (正)
(正)_______  (逆)(填“
(逆)(填“ ”“
”“ ”或“
”或“ ”)。
”)。
②已知能够一步完成的反应称为基元反应,基元反应 的速率方程为
的速率方程为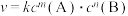 (
( 为只与温度有关的速度常数),一般反应的速率由基元反应中的慢反应决定。反应
为只与温度有关的速度常数),一般反应的速率由基元反应中的慢反应决定。反应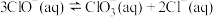 可能的机理如下:
可能的机理如下:
I.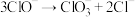
II.(一)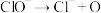 (慢反应);(二)
(慢反应);(二) (快反应);(三)
(快反应);(三)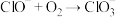 (快反应)
(快反应)
III.(一)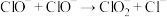 (慢反应);(二)
(慢反应);(二)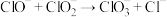 (快反应)
(快反应)
IV.(一)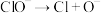 (慢反应);(二)
(慢反应);(二)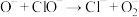 (快反应);(三)
(快反应);(三)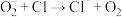 (快反应);(四)
(快反应);(四)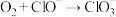 (快反应)
(快反应)
V.(一)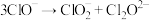 (慢反应);(二)
(慢反应);(二)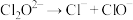 (快反应);(三)
(快反应);(三)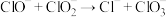 (快反应)
(快反应)
机理II的中间体是__ 。若反应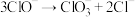 的速率方程为
的速率方程为 ,则该反应的历程可能是
,则该反应的历程可能是__ (填标号)。
 溶液可用于消毒、杀菌及水的处理等。25℃时,有关物质的电离常数如下表所示:
溶液可用于消毒、杀菌及水的处理等。25℃时,有关物质的电离常数如下表所示:| 弱酸 |  |  |
电离常数 | 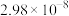 | 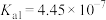 , , |
回答下列问题:
(1)
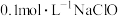 溶液中,离子浓度从大到小的顺序是
溶液中,离子浓度从大到小的顺序是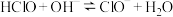 的平衡常数K=
的平衡常数K=(2)
 溶液在空气中吸收
溶液在空气中吸收 的离子方程式为
的离子方程式为(3)反应
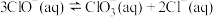 在室温下能自发进行。
在室温下能自发进行。①T℃时,该反应的平衡常数
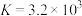 。若某混合溶液中
。若某混合溶液中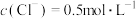 ,
,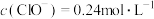 ,
,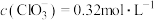 ,则
,则 (正)
(正) (逆)(填“
(逆)(填“ ”“
”“ ”或“
”或“ ”)。
”)。②已知能够一步完成的反应称为基元反应,基元反应
 的速率方程为
的速率方程为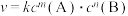 (
( 为只与温度有关的速度常数),一般反应的速率由基元反应中的慢反应决定。反应
为只与温度有关的速度常数),一般反应的速率由基元反应中的慢反应决定。反应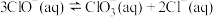 可能的机理如下:
可能的机理如下:I.
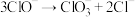
II.(一)
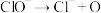 (慢反应);(二)
(慢反应);(二) (快反应);(三)
(快反应);(三)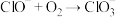 (快反应)
(快反应)III.(一)
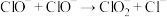 (慢反应);(二)
(慢反应);(二)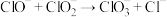 (快反应)
(快反应)IV.(一)
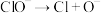 (慢反应);(二)
(慢反应);(二) (快反应);(三)
(快反应);(三)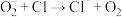 (快反应);(四)
(快反应);(四)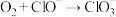 (快反应)
(快反应)V.(一)
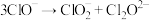 (慢反应);(二)
(慢反应);(二)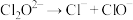 (快反应);(三)
(快反应);(三)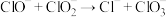 (快反应)
(快反应)机理II的中间体是
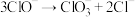 的速率方程为
的速率方程为 ,则该反应的历程可能是
,则该反应的历程可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】研究CO2、CO是处理方法对环境保护用重要意义。
(1)已知:①CO2(g)+H2(g) CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
②C(g)+2H2(g) CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1
③2CO(g) C(g)+CO2(g) △H=-171kJ·mol-1
C(g)+CO2(g) △H=-171kJ·mol-1
则CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=
CH4(g)+2H2O(g) △H=__________ 。
(2)CO2与H2反应可合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
某温度下,将1molCO2和3molH2充入探究不变的2L密闭容器中,发生上述反应。测得不同时刻的反应前后压强关系如下:
①用CO2表示第1小时反应的平均速率v(CO2)=_______ mol·L-1·h-1。
②该温度下的H2平衡转化率为______________ 。
(3)CO2与NH3反应可合成尿素:CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
在T1℃时,将1molCO2和2molNH3置于1L密闭容器中,发生上述反应,在t时刻,测得容器中CO2转化率约为73%。保护其他初始实验条件不变,分别在温度为T2℃、T3℃、T4℃、T5℃时,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线如图所示:
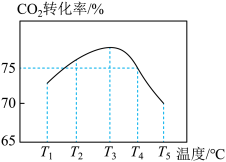
①该反应的△H______ 0(填“>”或“<”)
②T4℃时该反应的平衡常数K=___________ 。
③在T1℃~T3℃之间,CO2转化率逐渐增大,其原因是____________________ 。
(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示

①阳极区产生CO2的原因是______________ (用离子方程式表示)。
②利用平衡移动原理,简述CO 在阴极区再生的原因
在阴极区再生的原因_____________ 。
(1)已知:①CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1②C(g)+2H2(g)
 CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1③2CO(g)
 C(g)+CO2(g) △H=-171kJ·mol-1
C(g)+CO2(g) △H=-171kJ·mol-1则CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H=
CH4(g)+2H2O(g) △H=(2)CO2与H2反应可合成甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)某温度下,将1molCO2和3molH2充入探究不变的2L密闭容器中,发生上述反应。测得不同时刻的反应前后压强关系如下:
| 时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
①用CO2表示第1小时反应的平均速率v(CO2)=
②该温度下的H2平衡转化率为
(3)CO2与NH3反应可合成尿素:CO2(g)+2NH3(g)
 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)在T1℃时,将1molCO2和2molNH3置于1L密闭容器中,发生上述反应,在t时刻,测得容器中CO2转化率约为73%。保护其他初始实验条件不变,分别在温度为T2℃、T3℃、T4℃、T5℃时,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线如图所示:

①该反应的△H
②T4℃时该反应的平衡常数K=
③在T1℃~T3℃之间,CO2转化率逐渐增大,其原因是
(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示

①阳极区产生CO2的原因是
②利用平衡移动原理,简述CO
 在阴极区再生的原因
在阴极区再生的原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】甲烷和二氧化碳均是温室气体,综合利用甲烷和二氧化碳是科学家研究的热点话题。
(1)甲烷可以处理二氧化硫气体,热化学方程式为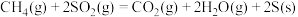
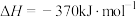 。已知:
。已知: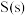 的燃烧热
的燃烧热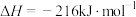 ,
,
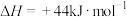 ,甲烷的燃烧热
,甲烷的燃烧热
______ 。
(2)一定温度下,在某恒容密闭容器中甲烷和二氧化硫发生反应:
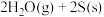 ,部分物质的物质的量随时间的变化如图所示:
,部分物质的物质的量随时间的变化如图所示: 点的
点的 (逆)
(逆)______  点的
点的 (正)(填“大于”或“小于")。
(正)(填“大于”或“小于")。
② 时可能改变的条件是
时可能改变的条件是______ (填字母)。
A.降低温度 B.使用高效催化剂 C.减小压强 D.充入甲烷
(3)二氧化碳甲烷化反应是有效利用二氧化碳的途径。在密闭容器中发生反应:
a.
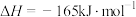
b.
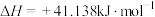
① 甲烷化在热力学上具有很大的优势,理由是
甲烷化在热力学上具有很大的优势,理由是______ 。
②有学者提出在催化剂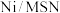 上的
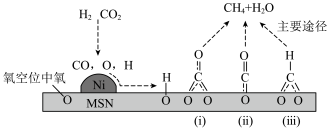
上的 加氢反应机理,他们认为催化剂中存在氧空位是表面碳物种形成的必要条件,并且碳物种可与载体上的氧空位直接作用形成活性中间体,进一步加氢生成
加氢反应机理,他们认为催化剂中存在氧空位是表面碳物种形成的必要条件,并且碳物种可与载体上的氧空位直接作用形成活性中间体,进一步加氢生成 和
和 。
。______ 。
③一定催化剂条件下,将 和
和 按照体积比
按照体积比 混合,总物质的量是
混合,总物质的量是 ,在某密闭容器中发生反应
,在某密闭容器中发生反应 、
、 ,测得相同时间内二氧化碳的转化率、产物的选择性随温度的变化如图1、2所示:
,测得相同时间内二氧化碳的转化率、产物的选择性随温度的变化如图1、2所示: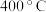 以前二氧化碳的转化率升高的原因是
以前二氧化碳的转化率升高的原因是______ 。
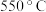 ,反应
,反应 、
、 均达到平衡状态,反应
均达到平衡状态,反应 的化学平衡常数
的化学平衡常数
______ (结果不必化简)。
(1)甲烷可以处理二氧化硫气体,热化学方程式为
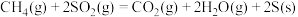
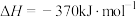 。已知:
。已知: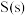 的燃烧热
的燃烧热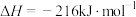 ,
,
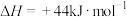 ,甲烷的燃烧热
,甲烷的燃烧热
(2)一定温度下,在某恒容密闭容器中甲烷和二氧化硫发生反应:

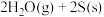 ,部分物质的物质的量随时间的变化如图所示:
,部分物质的物质的量随时间的变化如图所示:
 点的
点的 (逆)
(逆) 点的
点的 (正)(填“大于”或“小于")。
(正)(填“大于”或“小于")。②
 时可能改变的条件是
时可能改变的条件是A.降低温度 B.使用高效催化剂 C.减小压强 D.充入甲烷
(3)二氧化碳甲烷化反应是有效利用二氧化碳的途径。在密闭容器中发生反应:
a.

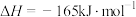
b.

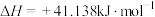
①
 甲烷化在热力学上具有很大的优势,理由是
甲烷化在热力学上具有很大的优势,理由是②有学者提出在催化剂
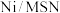 上的
上的 加氢反应机理,他们认为催化剂中存在氧空位是表面碳物种形成的必要条件,并且碳物种可与载体上的氧空位直接作用形成活性中间体,进一步加氢生成
加氢反应机理,他们认为催化剂中存在氧空位是表面碳物种形成的必要条件,并且碳物种可与载体上的氧空位直接作用形成活性中间体,进一步加氢生成 和
和 。
。
③一定催化剂条件下,将
 和
和 按照体积比
按照体积比 混合,总物质的量是
混合,总物质的量是 ,在某密闭容器中发生反应
,在某密闭容器中发生反应 、
、 ,测得相同时间内二氧化碳的转化率、产物的选择性随温度的变化如图1、2所示:
,测得相同时间内二氧化碳的转化率、产物的选择性随温度的变化如图1、2所示:
 以前二氧化碳的转化率升高的原因是
以前二氧化碳的转化率升高的原因是 ,反应
,反应 、
、 均达到平衡状态,反应
均达到平衡状态,反应 的化学平衡常数
的化学平衡常数
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示。已知:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示。已知: ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。

回答下列问题:
(1)装置C的作用是观察气泡流速,以便控制加热温度,则C中所选用的最佳试剂是______ 。
(2)装置D中三颈烧瓶的左侧导气管口必须插入下层 液体中,其目的是
液体中,其目的是______ 。
(3)制备 溶液:熄灭A处的酒精灯,关闭
溶液:熄灭A处的酒精灯,关闭 ,保持三颈烧瓶内液温105℃一段时间,其目的是
,保持三颈烧瓶内液温105℃一段时间,其目的是______ ,然后打开 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液,写出装置D中生成
溶液,写出装置D中生成 的化学方程式:
的化学方程式:______ 。
(4)装置E的作用为吸收尾气,防止污染环境,写出吸收 时的离子方程式
时的离子方程式______ 。
(5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再在减压条件下______ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(6)测定晶体中 的含量:称取
的含量:称取 样品。配成
样品。配成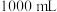 溶液量取
溶液量取 于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用
于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用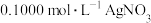 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液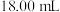 。已知:滴定时发生的反应:
。已知:滴定时发生的反应: (白色)。
(白色)。
①滴定过程的指示剂a为______ 。
②晶体中 的质量分数为
的质量分数为______ 。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示。已知:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示。已知: ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。
回答下列问题:
(1)装置C的作用是观察气泡流速,以便控制加热温度,则C中所选用的最佳试剂是
(2)装置D中三颈烧瓶的左侧导气管口必须插入下层
 液体中,其目的是
液体中,其目的是(3)制备
 溶液:熄灭A处的酒精灯,关闭
溶液:熄灭A处的酒精灯,关闭 ,保持三颈烧瓶内液温105℃一段时间,其目的是
,保持三颈烧瓶内液温105℃一段时间,其目的是 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液,写出装置D中生成
溶液,写出装置D中生成 的化学方程式:
的化学方程式:(4)装置E的作用为吸收尾气,防止污染环境,写出吸收
 时的离子方程式
时的离子方程式(5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再在减压条件下
(6)测定晶体中
 的含量:称取
的含量:称取 样品。配成
样品。配成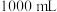 溶液量取
溶液量取 于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用
于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用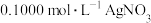 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液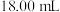 。已知:滴定时发生的反应:
。已知:滴定时发生的反应: (白色)。
(白色)。①滴定过程的指示剂a为
②晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
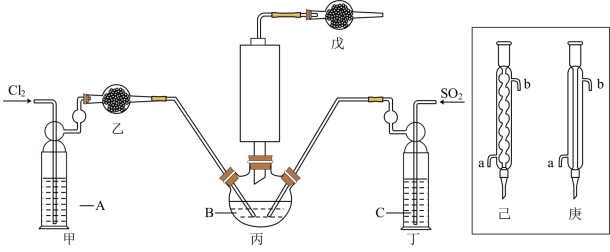
【推荐2】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
资料卡片:
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的离子方程式是:______________ 。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________ (填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______ (填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有_____________________________ 。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是_________________________ 。
(5)产品经提纯后仍含少量PCl3杂质,通过佛尔哈德法可测定产品中POCl3的含量:准确称取1.500g样品在碘量瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是_____________________________________________________ 。
②POCl3的质量分数为________________________ 。
③已知:KSP(AgC1)=3.2×10-10 mol2·L-2,KSP(AgSCN)=2×10-12 mol2·L-2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将___________ (填“偏大”、“偏小”、“无影响”)。
 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
资料卡片:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
| POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
| SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的离子方程式是:
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是
(5)产品经提纯后仍含少量PCl3杂质,通过佛尔哈德法可测定产品中POCl3的含量:准确称取1.500g样品在碘量瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是
②POCl3的质量分数为
③已知:KSP(AgC1)=3.2×10-10 mol2·L-2,KSP(AgSCN)=2×10-12 mol2·L-2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】随着我国钛材生产技术的提高,航空航天、军事、汽车等领域钛用量也在快速增长。四氯化钛是生产海绵钛的重要中间原料,某小组同学利用如下装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。 的盐酸溶液可以与
的盐酸溶液可以与 反应;
反应;
②有关物质的性质。
请回答下列问题:
(1)基态钛原子的价电子排布式为__________ ,仪器b的名称为__________ 。
(2)装置D中发生两个反应,其中副反应为 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式__________ 。
(3)装置C中的药品为__________ ,装置G的作用为__________ ,若没有装置G,为达到相同效果也可采用的操作是__________ 。
(4)装置F的作用是__________ 。
(5)进一步提纯E中产物的方法是__________ 。
(6)测定 的含量:取1.0g产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成100mL溶液。取20.00mL于锥形瓶中,滴加2∼3滴
的含量:取1.0g产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成100mL溶液。取20.00mL于锥形瓶中,滴加2∼3滴 溶液为指示剂,用
溶液为指示剂,用 的
的 标准溶液滴定至终点,消耗溶液40.00mL。该产品纯度为
标准溶液滴定至终点,消耗溶液40.00mL。该产品纯度为__________ 。下列实验操作会导致产品纯度测定结果偏低的有__________ 。
C.滴定终点时仰视读数 D.滴加过多的 溶液
溶液
 (夹持装置略去)。
(夹持装置略去)。
 的盐酸溶液可以与
的盐酸溶液可以与 反应;
反应;②有关物质的性质。
熔点/℃ | 沸点/℃ | 密度 | 水溶性 | |
| -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| -23 | 76.8 | 1.6 | 难溶于水 |
(1)基态钛原子的价电子排布式为
(2)装置D中发生两个反应,其中副反应为
 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式(3)装置C中的药品为
(4)装置F的作用是
(5)进一步提纯E中产物的方法是
(6)测定
 的含量:取1.0g产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成100mL溶液。取20.00mL于锥形瓶中,滴加2∼3滴
的含量:取1.0g产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成100mL溶液。取20.00mL于锥形瓶中,滴加2∼3滴 溶液为指示剂,用
溶液为指示剂,用 的
的 标准溶液滴定至终点,消耗溶液40.00mL。该产品纯度为
标准溶液滴定至终点,消耗溶液40.00mL。该产品纯度为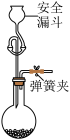
C.滴定终点时仰视读数 D.滴加过多的
 溶液
溶液
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X 的化学式是__________ 。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是__________ 。
(3)白色沉淀用途广泛,请列举一例:__________ 。

请回答:
(1)X 的化学式是
(2)白色粉末溶于氢氧化钠溶液的离子方程式是
(3)白色沉淀用途广泛,请列举一例:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】炼铁的矿石主要有赤铁矿、磁铁矿和菱铁矿等。在测定磁铁矿中铁的含量前,通常要对矿石进行预处理。对矿样进行预处理后,用重铬酸钾标准溶液可测定铁矿石的含铁量,现有两种对矿样进行预处理的方法如下:

已知:
I.Sn、Hg、Ti在溶液中可存在的形式有 (无色)、
(无色)、 (无色)、
(无色)、 、
、 、
、 (紫色)、
(紫色)、 (无色),
(无色), 能与
能与 反应,且
反应,且 也能与
也能与 反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
II.钨酸钠 可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
III. 和
和 均具有还原性,氧化性:
均具有还原性,氧化性: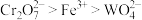 ;
;
IV.二苯胺硫磺钠本身无色,被氧化后呈现紫红色
请回答下列问题:
(1)反应②后得到的悬浊液中固体物质为_______ (写化学式)。
(2)过程①发生反应的离子方程式为_______ 。
(3)反应③中含铁元素的离子发生的反应:_______ ;反应(3)中溶液变蓝,说明_______ 。
(4)矿样预处理后,加入 混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当
混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当_______ 现象,说明达到了滴定终点。
(5)现称取 矿样进行实验,最终消耗
矿样进行实验,最终消耗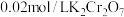 标准溶液
标准溶液 ,则矿样中含铁的质量分数为
,则矿样中含铁的质量分数为_______ 。

已知:
I.Sn、Hg、Ti在溶液中可存在的形式有
 (无色)、
(无色)、 (无色)、
(无色)、 、
、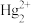 、
、 (紫色)、
(紫色)、 (无色),
(无色), 能与
能与 反应,且
反应,且 也能与
也能与 反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
反应,氯化汞溶于水,氯化亚汞是白色难溶固体;II.钨酸钠
 可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;III.
 和
和 均具有还原性,氧化性:
均具有还原性,氧化性: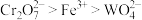 ;
;IV.二苯胺硫磺钠本身无色,被氧化后呈现紫红色
请回答下列问题:
(1)反应②后得到的悬浊液中固体物质为
(2)过程①发生反应的离子方程式为
(3)反应③中含铁元素的离子发生的反应:
(4)矿样预处理后,加入
 混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当
混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当(5)现称取
 矿样进行实验,最终消耗
矿样进行实验,最终消耗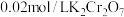 标准溶液
标准溶液 ,则矿样中含铁的质量分数为
,则矿样中含铁的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】氮化铝(AlN)是一种新型无机非金属材料,为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
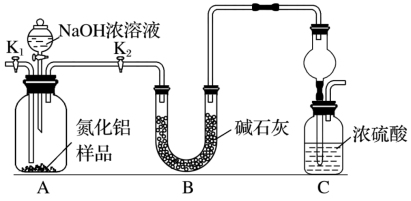
(1)上图C装置中球形干燥管的作用是________________________ 。
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是________ ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_______________ 。
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见_________________ 。
【方案2】按以下步骤测定样品中A1N的纯度:

(4)步骤②生成沉淀的离子方程式为___________________ 。
(5)步骤③的操作是__________ 。A1N的纯度是___________ (用m1、m2表示)。
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见
【方案2】按以下步骤测定样品中A1N的纯度:

(4)步骤②生成沉淀的离子方程式为
(5)步骤③的操作是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】硫代硫酸钠晶体 具有脱敏作用,临床上用于氰化物及腈类中毒,它又名“大苏打”、“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,遇强酸发生剧烈反应。某化学兴趣小组通过查阅资料,对它的制备和性质进行了探究,探究过程如下:
具有脱敏作用,临床上用于氰化物及腈类中毒,它又名“大苏打”、“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,遇强酸发生剧烈反应。某化学兴趣小组通过查阅资料,对它的制备和性质进行了探究,探究过程如下:

请回答下列问题:
Ⅰ. 的制备:已知烧瓶C中发生如下三个反应:
的制备:已知烧瓶C中发生如下三个反应:
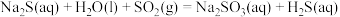
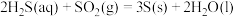
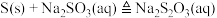
(1)仪器组装完成后,是否能利用装置B检查整套装置的气密性_______ (填“是”或“否”)
(2)装置A中发生的化学反应方程式为_______ 。
(3)装置B中盛放浓硫酸,除干燥气体外,还起到的作用有_______ ,C装置中放入无水乙醇的目的是_______ 。
(4)为提高产品纯度,应使烧瓶C中 和
和 恰好完全反应,则烧瓶C中
恰好完全反应,则烧瓶C中 和
和 物质的量之比为
物质的量之比为_______ 。
(5)装置D的作用是_______ 。
 具有脱敏作用,临床上用于氰化物及腈类中毒,它又名“大苏打”、“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,遇强酸发生剧烈反应。某化学兴趣小组通过查阅资料,对它的制备和性质进行了探究,探究过程如下:
具有脱敏作用,临床上用于氰化物及腈类中毒,它又名“大苏打”、“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,遇强酸发生剧烈反应。某化学兴趣小组通过查阅资料,对它的制备和性质进行了探究,探究过程如下:
请回答下列问题:
Ⅰ.
 的制备:已知烧瓶C中发生如下三个反应:
的制备:已知烧瓶C中发生如下三个反应: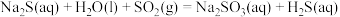
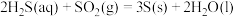
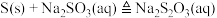
(1)仪器组装完成后,是否能利用装置B检查整套装置的气密性
(2)装置A中发生的化学反应方程式为
(3)装置B中盛放浓硫酸,除干燥气体外,还起到的作用有
(4)为提高产品纯度,应使烧瓶C中
 和
和 恰好完全反应,则烧瓶C中
恰好完全反应,则烧瓶C中 和
和 物质的量之比为
物质的量之比为(5)装置D的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2=2ClO2+2NaCl,如图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体。

(1)仪器P的名称是_______
(2)写出装置A中烧瓶内发生反应的化学方程式:_______
(3)E装置中所盛试剂的作用是_______
(4)F处应选用的收集装置是_______ (填序号),其中与E装置导管相连的导管口是_______ (填接口字母)。

(5)图中是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是_______
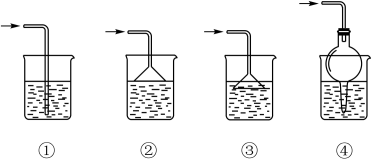
A.①② B.②③ C.③④ D.②④
(6)若用100mL 2mol•L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是_______ (填序号)。
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断。
(7) ClO2也可由KClO3在H2SO4溶液存在下与Na2SO3反应制得。请写出反应的离子方程式:_______ 。

(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的化学方程式:
(3)E装置中所盛试剂的作用是
(4)F处应选用的收集装置是

(5)图中是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是

A.①② B.②③ C.③④ D.②④
(6)若用100mL 2mol•L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断。
(7) ClO2也可由KClO3在H2SO4溶液存在下与Na2SO3反应制得。请写出反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】铁及其化合物的制备与性质探究。
I.乳酸亚铁[CH3CH(OH)COO]2Fe是一种常见的补血剂,可由FeCO3与乳酸反应制得,实验室经常采用如图装置制备FeCO3(夹持装置略)。
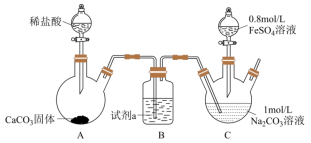
具体实验流程如下:装置C中,先通入CO2至pH约为7,滴加一定量FeSO4,将所得白色沉淀过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a为_____ 。
(2)写出C中pH约为7后,滴入FeSO4溶液制备FeCO3反应的离子方程式:_____ 。
(3)某实验小组依据酸性高锰酸钾标准液与亚铁离子的反应,来测定乳酸亚铁的质量分数,经过反复多次测定乳酸亚铁的质量分数总是大于100%,其原因是_____ 。
II.无水FeCl3是一种常见的化工原料,实验室可采用下列装置制备。
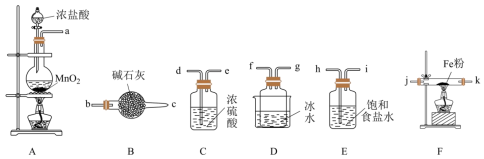
已知:①FeCl3极易水解;②FeCl3在300℃以上升华。
(4)装置的连接顺序为a→h,i→_____ →j,k→f,g→_____ (按气流方向,用小写字母表示)。
(5)将所得无水FeCl3溶于_____ ,再稀释得到所需的FeCl3溶液。
(6)某兴趣小组在FeCl3溶液中通入SO2,观察到的主要现象为随着SO2的通入,溶液迅速由黄色变为红棕色,静置一小时后溶液变为浅绿色。通过查阅资料得知,溶液中主要有两种变化,反应1:Fe2+与SO2会生成一种络合物[Fe(SO2)6]3+(红棕色);反应2:Fe3+与SO2发生氧化还原反应。
①写出第二种情况下反应的离子方程式:_____ 。
②这两种反应平衡常数的大小关系为K1_____ K2(填“<”“>”或“=”)。
I.乳酸亚铁[CH3CH(OH)COO]2Fe是一种常见的补血剂,可由FeCO3与乳酸反应制得,实验室经常采用如图装置制备FeCO3(夹持装置略)。

具体实验流程如下:装置C中,先通入CO2至pH约为7,滴加一定量FeSO4,将所得白色沉淀过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a为
(2)写出C中pH约为7后,滴入FeSO4溶液制备FeCO3反应的离子方程式:
(3)某实验小组依据酸性高锰酸钾标准液与亚铁离子的反应,来测定乳酸亚铁的质量分数,经过反复多次测定乳酸亚铁的质量分数总是大于100%,其原因是
II.无水FeCl3是一种常见的化工原料,实验室可采用下列装置制备。

已知:①FeCl3极易水解;②FeCl3在300℃以上升华。
(4)装置的连接顺序为a→h,i→
(5)将所得无水FeCl3溶于
(6)某兴趣小组在FeCl3溶液中通入SO2,观察到的主要现象为随着SO2的通入,溶液迅速由黄色变为红棕色,静置一小时后溶液变为浅绿色。通过查阅资料得知,溶液中主要有两种变化,反应1:Fe2+与SO2会生成一种络合物[Fe(SO2)6]3+(红棕色);反应2:Fe3+与SO2发生氧化还原反应。
①写出第二种情况下反应的离子方程式:
②这两种反应平衡常数的大小关系为K1
您最近一年使用:0次





