乙烯被广泛用于合成聚乙烯等聚合产品。工业生产的乙烯中含有的少量乙炔会导致聚合催化剂中毒失活,含有的乙烷会使聚合过程终止。因此乙炔的选择加氢制乙烯在生产中有重大经济意义。反应原理如下:
反应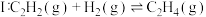 (主反应)
(主反应)
反应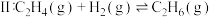 (副反应)
(副反应)
回答下列问题:
(1)分别以 乙炔和
乙炔和  氢气或
氢气或  乙烯为初始原料,在
乙烯为初始原料,在 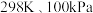 下,使用对反应
下,使用对反应  选择性好的催化剂,分别在恒压容器中反应,达平衡时,以乙炔和氢气为原料,体系向环境放热
选择性好的催化剂,分别在恒压容器中反应,达平衡时,以乙炔和氢气为原料,体系向环境放热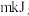 以乙烯为原料,体系从环境吸热
以乙烯为原料,体系从环境吸热 ,忽略副反应热效应,反应焓变
,忽略副反应热效应,反应焓变
___________  。
。
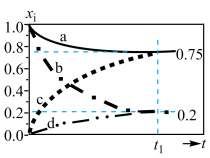
(2)初始条件同上,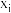 表示某物种
表示某物种  的物质的量与除
的物质的量与除  外其它各物种总物质的量之比,
外其它各物种总物质的量之比,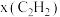 和
和  随时间
随时间 变化关系如图所示,实验测得
变化关系如图所示,实验测得 ,则图中表示
,则图中表示 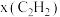 变化的曲线是
变化的曲线是___________ ;反应I平衡常数Kp=___________  ;以乙炔和氢气为原料时,
;以乙炔和氢气为原料时, 时刻
时刻 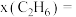
___________ 。
(3) 在催化剂表面逐步加氢,当变成
在催化剂表面逐步加氢,当变成 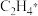 时,
时,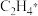 可从催化剂表面脱附生成
可从催化剂表面脱附生成 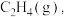 也可以继续加氢。清华大学李亚林团队找到一种催化剂,可使
也可以继续加氢。清华大学李亚林团队找到一种催化剂,可使 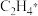 脱附生成
脱附生成 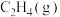 而不继续加氢,使催化产物停留在乙烯而不继续加氢生成乙烷。下面是两种催化剂(①
而不继续加氢,使催化产物停留在乙烯而不继续加氢生成乙烷。下面是两种催化剂(① 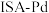 和②
和②  )分别催化乙炔加氢的反应机理:
)分别催化乙炔加氢的反应机理:
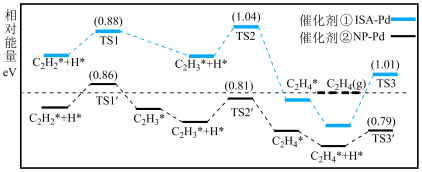
在催化剂② 作用下,
作用下,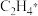 倾向于
倾向于___________ (填“脱附”或“加氢”),结合图中数据,推测清华大学团队找到的理想催化剂是___________ (填“①”或“②”),原因是在该催化剂上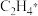 的脱附能
的脱附能___________ (填“高于”或“低于”) 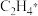 进一步加氢需要突破的能垒,该催化剂具有好的选择性。
进一步加氢需要突破的能垒,该催化剂具有好的选择性。
反应
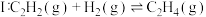 (主反应)
(主反应)反应
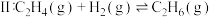 (副反应)
(副反应)回答下列问题:
(1)分别以
 乙炔和
乙炔和  氢气或
氢气或  乙烯为初始原料,在
乙烯为初始原料,在 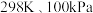 下,使用对反应
下,使用对反应  选择性好的催化剂,分别在恒压容器中反应,达平衡时,以乙炔和氢气为原料,体系向环境放热
选择性好的催化剂,分别在恒压容器中反应,达平衡时,以乙炔和氢气为原料,体系向环境放热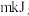 以乙烯为原料,体系从环境吸热
以乙烯为原料,体系从环境吸热 ,忽略副反应热效应,反应焓变
,忽略副反应热效应,反应焓变
 。
。(2)初始条件同上,
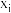 表示某物种
表示某物种  的物质的量与除
的物质的量与除  外其它各物种总物质的量之比,
外其它各物种总物质的量之比,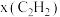 和
和  随时间
随时间 变化关系如图所示,实验测得
变化关系如图所示,实验测得 ,则图中表示
,则图中表示 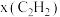 变化的曲线是
变化的曲线是 ;以乙炔和氢气为原料时,
;以乙炔和氢气为原料时, 时刻
时刻 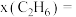

(3)
 在催化剂表面逐步加氢,当变成
在催化剂表面逐步加氢,当变成 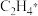 时,
时,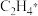 可从催化剂表面脱附生成
可从催化剂表面脱附生成 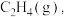 也可以继续加氢。清华大学李亚林团队找到一种催化剂,可使
也可以继续加氢。清华大学李亚林团队找到一种催化剂,可使 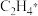 脱附生成
脱附生成 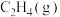 而不继续加氢,使催化产物停留在乙烯而不继续加氢生成乙烷。下面是两种催化剂(①
而不继续加氢,使催化产物停留在乙烯而不继续加氢生成乙烷。下面是两种催化剂(① 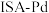 和②
和②  )分别催化乙炔加氢的反应机理:
)分别催化乙炔加氢的反应机理:
在催化剂②
 作用下,
作用下,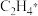 倾向于
倾向于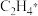 的脱附能
的脱附能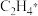 进一步加氢需要突破的能垒,该催化剂具有好的选择性。
进一步加氢需要突破的能垒,该催化剂具有好的选择性。
更新时间:2024-02-24 21:07:30
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】高温下用H2还原CuCl制备活性铜,反应原理如下:
2Cu(s)+Cl2(g) 2CuCl(s) ΔH1=-36 kJ·mol-1①
2CuCl(s) ΔH1=-36 kJ·mol-1①
H2(g)+2CuCl(s) 2Cu(s)+2HCl(g) ΔH2②
2Cu(s)+2HCl(g) ΔH2②
有关物质的键能数据如下表:
(1)ΔH2=________ kJ·mol-1。
(2)经测定反应②制备活性铜的反应趋势大,原因是__________ 。
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。________________________

(4)白色不溶于水的CuCl可以由电解法制得,如图所示:

①装置中用的交换膜为________ 。
A.阳离子交换膜 B.阴离子交换膜
C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为______________________________________________ 。
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:
________________________________________________________________________ 。
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:____________________________ 。
2Cu(s)+Cl2(g)
 2CuCl(s) ΔH1=-36 kJ·mol-1①
2CuCl(s) ΔH1=-36 kJ·mol-1①H2(g)+2CuCl(s)
 2Cu(s)+2HCl(g) ΔH2②
2Cu(s)+2HCl(g) ΔH2②有关物质的键能数据如下表:
| 物质 | H2 | Cl2 | HCl |
| 键能/kJ·mol-1 | 436 | 243 | 432 |
(1)ΔH2=
(2)经测定反应②制备活性铜的反应趋势大,原因是
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。

(4)白色不溶于水的CuCl可以由电解法制得,如图所示:

①装置中用的交换膜为
A.阳离子交换膜 B.阴离子交换膜
C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g)  2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法正确的是__________ 。
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的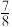 ,则N2的转化率为
,则N2的转化率为______________ 。
(3)工业上合成氨的部分工艺流程如下:
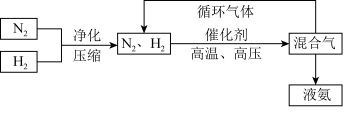
请用平衡移动原理来解释在流程中及时分离出氨气的原因_____________________________ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2_______ T1(填“>”“<”或“=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________ (填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
此条件下该反应的化学平衡常数K=_______________ 。
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g) 2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-1
2H2(g)+O2 (g) 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式________________________________________ 。
 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。(1)下列关于工业合成氨的说法正确的是
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的
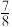 ,则N2的转化率为
,则N2的转化率为(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下该反应的化学平衡常数K=
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g)
 2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1N2(g)+O2(g)
 2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-12H2(g)+O2 (g)
 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1写出氨气催化氧化生成NO和水蒸气的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】对CO2的综合利用可以实现经济社会发展和生态环境保护双赢,对促进低碳社会的构建具有重要意义。回答下列问题:
(1)已知:①C的燃烧热为393.5kJ·mol-1
②H2的燃烧热为286kJ•mol-1
③H2O(g)=H2O(l) △H=-44.0kJ•mol-1
则CO2(g)+2H2(g) C(s)+2H2O(g)△H=
C(s)+2H2O(g)△H=___ kJ•mol-1。
(2)CO2合成甲醇是碳减排的一种重要方法,向1L恒容密闭容器中加入1molCO2、amolH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-48.7kJ•mol-1。平衡时混合气体中CH3OH的体积分数与氢气的物质的量关系如图1所示。
CH3OH(g)+H2O(g) △H=-48.7kJ•mol-1。平衡时混合气体中CH3OH的体积分数与氢气的物质的量关系如图1所示。
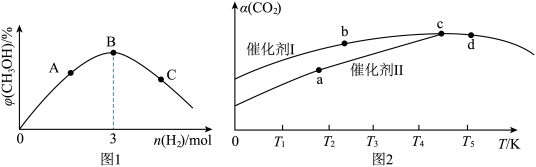
①有利于该反应自发进行的条件是___ (填“低温高压”“高温低压”或“低温低压”)。
②图1中 A、B、C三点对应的体系,CO2的平衡转化率最大的是___ (填字母),判断依据是___ 。
(3)利用 CO2催化加氢制乙烯,反应为 2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H。
C2H4(g)+4H2O(g) △H。
在1L恒容密闭容器中,均加入1molCO2、3molH2,分别选用两种催化剂,反应进行相同时间后,测得CO2转化率[α(CO2)]随反应温度的变化如图2所示。
①使用催化剂Ⅰ时反应的活化能___ (填“高于”或“低于”)使用催化剂Ⅱ。
②c、d两点的平衡常数大小关系为:Kc___ Kd(填“<”“>”或“=”),判断依据是___ 。
(4)常温下,可利用碱性溶液吸收CO2。用100mL0.3mol·L-1Na2CO3溶液完全吸收0.88gCO2气体(忽略溶液体积变化)。所得溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=___ mol•L-1。
(1)已知:①C的燃烧热为393.5kJ·mol-1
②H2的燃烧热为286kJ•mol-1
③H2O(g)=H2O(l) △H=-44.0kJ•mol-1
则CO2(g)+2H2(g)
 C(s)+2H2O(g)△H=
C(s)+2H2O(g)△H=(2)CO2合成甲醇是碳减排的一种重要方法,向1L恒容密闭容器中加入1molCO2、amolH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-48.7kJ•mol-1。平衡时混合气体中CH3OH的体积分数与氢气的物质的量关系如图1所示。
CH3OH(g)+H2O(g) △H=-48.7kJ•mol-1。平衡时混合气体中CH3OH的体积分数与氢气的物质的量关系如图1所示。
①有利于该反应自发进行的条件是
②图1中 A、B、C三点对应的体系,CO2的平衡转化率最大的是
(3)利用 CO2催化加氢制乙烯,反应为 2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H。
C2H4(g)+4H2O(g) △H。在1L恒容密闭容器中,均加入1molCO2、3molH2,分别选用两种催化剂,反应进行相同时间后,测得CO2转化率[α(CO2)]随反应温度的变化如图2所示。
①使用催化剂Ⅰ时反应的活化能
②c、d两点的平衡常数大小关系为:Kc
(4)常温下,可利用碱性溶液吸收CO2。用100mL0.3mol·L-1Na2CO3溶液完全吸收0.88gCO2气体(忽略溶液体积变化)。所得溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】合成氨反应 是目前最有效的工业固氮方法,解决数亿人口生存问题。
是目前最有效的工业固氮方法,解决数亿人口生存问题。
(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。
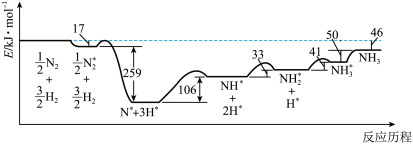
该反应在___________ (填“任何”“较低温”“较高温”)条件下可以自发进行;上述历程中反应速率最慢的步骤的方程式为___________ 。
(2)在T℃、压强为0.9MPa条件下,向一恒压密闭容器中通入 的混合气体,体系中各气体的含量与时间变化关系如图所示。已知:分压=总压×体积分数。
的混合气体,体系中各气体的含量与时间变化关系如图所示。已知:分压=总压×体积分数。
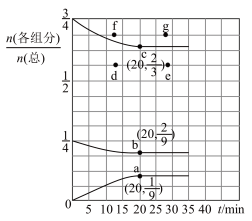
①以下叙述不能 说明该条件下反应达到平衡状态的是___________ (填字母)。
A.氨气的体积分数保持不变 B.容器中 保持不变
保持不变
C.气体平均相对分子质量保持不变 D.气体密度保持不变
E.
②反应20min时达到平衡,则0~20min内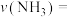
________  ,
,
_________ 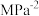 。(
。( 为以分压表示的平衡常数,代入数据列出计算式,不必化简)
为以分压表示的平衡常数,代入数据列出计算式,不必化简)
③若起始条件相同,在恒容容器中发生反应,则达到平衡时 的含量符合图中
的含量符合图中___________ 点(填“d”“e”“f”或“g”)。
(3)氨化脱硝过程发生反应
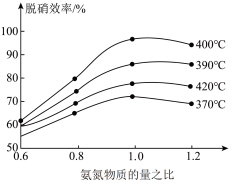
 ,请根据下图分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
,请根据下图分析420℃的脱硝效率低于390℃的脱硝效率可能的原因___________ 。
 是目前最有效的工业固氮方法,解决数亿人口生存问题。
是目前最有效的工业固氮方法,解决数亿人口生存问题。(1)反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。

该反应在
(2)在T℃、压强为0.9MPa条件下,向一恒压密闭容器中通入
 的混合气体,体系中各气体的含量与时间变化关系如图所示。已知:分压=总压×体积分数。
的混合气体,体系中各气体的含量与时间变化关系如图所示。已知:分压=总压×体积分数。
①以下叙述
A.氨气的体积分数保持不变 B.容器中
 保持不变
保持不变C.气体平均相对分子质量保持不变 D.气体密度保持不变
E.

②反应20min时达到平衡,则0~20min内
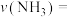
 ,
,
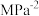 。(
。( 为以分压表示的平衡常数,代入数据列出计算式,不必化简)
为以分压表示的平衡常数,代入数据列出计算式,不必化简)③若起始条件相同,在恒容容器中发生反应,则达到平衡时
 的含量符合图中
的含量符合图中(3)氨化脱硝过程发生反应

 ,请根据下图分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
,请根据下图分析420℃的脱硝效率低于390℃的脱硝效率可能的原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】对主要成分为H2S的工业废气进行回收利用具有重要意义,其反应原理之一为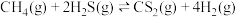 。
。
(1)已知CH4的燃烧热 为
为 ,则表示CH4燃烧热的热化学方程式为
,则表示CH4燃烧热的热化学方程式为___________ 。
(2)已知:反应i.
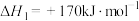
反应ii.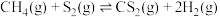
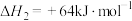
若反应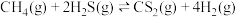 看成由反应i和反应ii两步进行,且反应i的活化能小于反应ii的活化能。请在图中画出反应过程中的能量变化示意图:
看成由反应i和反应ii两步进行,且反应i的活化能小于反应ii的活化能。请在图中画出反应过程中的能量变化示意图:__________ 。

(3)在 和
和 下(
下(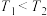 ),向1L恒容密闭容器中充入
),向1L恒容密闭容器中充入
 和
和
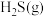 ,仅发生反应
,仅发生反应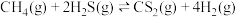 ,测得
,测得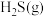 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。

已知:曲线M对应温度下该反应的化学平衡常数为0.05。
①a点和b点对应的容器中,
___________  (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是___________ 。
②曲线N对应温度下该反应的化学平衡常数K为___________ 。
③已知:该反应的速率方程为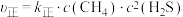 ,
, ,
, 、
、 分别为正、逆反应速率常数,只与温度有关,a点时的
分别为正、逆反应速率常数,只与温度有关,a点时的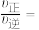
___________ 。
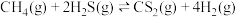 。
。(1)已知CH4的燃烧热
 为
为 ,则表示CH4燃烧热的热化学方程式为
,则表示CH4燃烧热的热化学方程式为(2)已知:反应i.

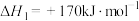
反应ii.
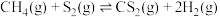
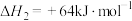
若反应
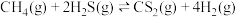 看成由反应i和反应ii两步进行,且反应i的活化能小于反应ii的活化能。请在图中画出反应过程中的能量变化示意图:
看成由反应i和反应ii两步进行,且反应i的活化能小于反应ii的活化能。请在图中画出反应过程中的能量变化示意图:
(3)在
 和
和 下(
下(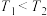 ),向1L恒容密闭容器中充入
),向1L恒容密闭容器中充入
 和
和
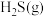 ,仅发生反应
,仅发生反应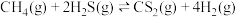 ,测得
,测得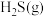 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。
已知:曲线M对应温度下该反应的化学平衡常数为0.05。
①a点和b点对应的容器中,

 (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是②曲线N对应温度下该反应的化学平衡常数K为
③已知:该反应的速率方程为
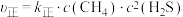 ,
, ,
, 、
、 分别为正、逆反应速率常数,只与温度有关,a点时的
分别为正、逆反应速率常数,只与温度有关,a点时的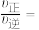
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】氮的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) △H1=-907.0 kJ/mol
4NH3(g) +3O2(g)=2N2(g)+6H2O(g)△H2=-1269.0 kJ/mol
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的正反应活化能为E正kJ/mol,则其逆反应活化能为
5N2(g) +6H2O(g)的正反应活化能为E正kJ/mol,则其逆反应活化能为___________ kJ/mol(用含E正的代数式表示)。
(2)在一定条件下,向某2 L密闭容器中分别投入一定量的NH3、NO发生反应:4NH3(g) +6NO(g) 5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
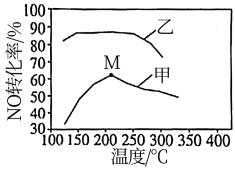
①工业上应选择催化剂___________ (填“甲”或“乙”)。
②M点是否为对应温度下NO的平衡转化率,判断理由是___________ 。温度高于210℃时,NO转化率降低的可能原因是___________ 。
(3)已知:NO2(g) +SO2(g) NO(g)+SO3(g)△H<0.向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
NO(g)+SO3(g)△H<0.向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
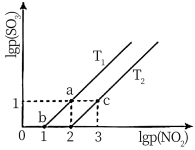
①ab两点体系总压强pa与pb的比值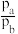 =
=___________ ;同一温度下图象呈线性变化的理由是___________ 。
②温度为T2时化学平衡常数Kp=___________ ,T1___________ T2(填“>”、“<”或“=”)。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) △H1=-907.0 kJ/mol
4NH3(g) +3O2(g)=2N2(g)+6H2O(g)△H2=-1269.0 kJ/mol
若4NH3(g) +6NO(g)
 5N2(g) +6H2O(g)的正反应活化能为E正kJ/mol,则其逆反应活化能为
5N2(g) +6H2O(g)的正反应活化能为E正kJ/mol,则其逆反应活化能为(2)在一定条件下,向某2 L密闭容器中分别投入一定量的NH3、NO发生反应:4NH3(g) +6NO(g)
 5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
①工业上应选择催化剂
②M点是否为对应温度下NO的平衡转化率,判断理由是
(3)已知:NO2(g) +SO2(g)
 NO(g)+SO3(g)△H<0.向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
NO(g)+SO3(g)△H<0.向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
①ab两点体系总压强pa与pb的比值
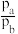 =
=②温度为T2时化学平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】Deacon发明将氯化氢直接转化为氯气:4HCl+O2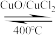 2Cl2+2H2O。
2Cl2+2H2O。
(1)已知:I.上述反应中,1molHCl被氧化放出28.9KJ的热量。
II.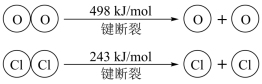
上述反应的热化学方程式是____ ,断开1molH-O键与断开1molH-Cl键所需能量相差为____ kJ。
(2)在恒容密闭容器中,按照进料浓度比c(HCl):c(O2)分别等于7:1、4:1、1:1时,HCl平衡转化率随温度变化的关系如图所示。
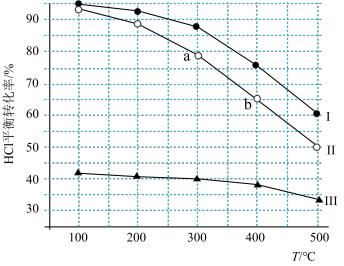
①400℃,进料浓度比为1:1时O2的平衡转化率为_______ 。
②不管按照何种进料浓度比,100℃时HCl的平衡转化率均最大,分析该Cl2制法中选择400℃的可能原因是_______ 。
③500℃时以II曲线所示进料比反应达到平衡时,容器内总压强为PMPa,则反应平衡常数Kp=____ (以分压表示,分压=总压×物质的量分数)。
④使曲线II达到曲线I相同的HCl平衡转化率,不改变投料比,可采取的措施有___ 、___ 。
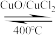 2Cl2+2H2O。
2Cl2+2H2O。(1)已知:I.上述反应中,1molHCl被氧化放出28.9KJ的热量。
II.

上述反应的热化学方程式是
(2)在恒容密闭容器中,按照进料浓度比c(HCl):c(O2)分别等于7:1、4:1、1:1时,HCl平衡转化率随温度变化的关系如图所示。

①400℃,进料浓度比为1:1时O2的平衡转化率为
②不管按照何种进料浓度比,100℃时HCl的平衡转化率均最大,分析该Cl2制法中选择400℃的可能原因是
③500℃时以II曲线所示进料比反应达到平衡时,容器内总压强为PMPa,则反应平衡常数Kp=
④使曲线II达到曲线I相同的HCl平衡转化率,不改变投料比,可采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】甲醚是重要的有机合成原料,甲醇制备甲醚的反应:
 kJ⋅mol
kJ⋅mol ;工业上常用
;工业上常用 或CO催化氢化法合成
或CO催化氢化法合成 。回答下列问题:
。回答下列问题:
(1) 和
和 在某催化剂表面合成
在某催化剂表面合成 :
:
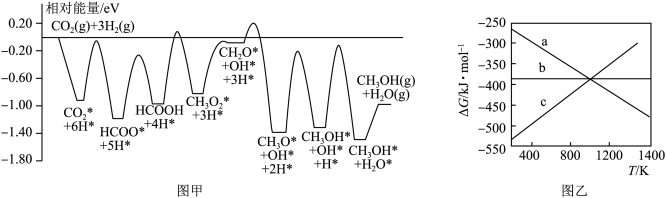
 ,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为
,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为___________ 。已知 (
( 、
、 随温度的变化不大),
随温度的变化不大), 随温度的变化关系如图乙所示,图中表示该反应的直线是
随温度的变化关系如图乙所示,图中表示该反应的直线是___________ (填代号)。
(2)CO催化加氢法合成 ,进而制备
,进而制备 的过程中涉及如下反应:
的过程中涉及如下反应:
反应I:

反应II:

反应III:
 kJ⋅mol-1
kJ⋅mol-1
①在298K,101kPa时, 、
、 、
、 的摩尔燃烧焓分别为akJ⋅mol-1、bkJ⋅mol-1、ckJ⋅mol-1,则
的摩尔燃烧焓分别为akJ⋅mol-1、bkJ⋅mol-1、ckJ⋅mol-1,则
___________ kJ⋅mol-1。
②一定温度下,向2L恒容密闭容器中充入2mol 和4mol
和4mol 制备
制备 ,初始压强为
,初始压强为 Pa,5min达到平衡时
Pa,5min达到平衡时 的转化率为70%,
的转化率为70%,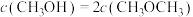 ,且
,且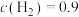 mol⋅L-1。则0~5min内,
mol⋅L-1。则0~5min内,
___________  ;反应I的平衡常数
;反应I的平衡常数
___________ (用 表示);平衡后,保持温度和容器体积不变,向容器中再充入1mol
表示);平衡后,保持温度和容器体积不变,向容器中再充入1mol 和2mol
和2mol ,重新达到平衡后,
,重新达到平衡后, 的物质的量分数
的物质的量分数___________ (填“增大”、“减小”或“不变”)。
③工业生产中,需要在260℃、压强恒为4.0MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01mol 和0.02mol
和0.02mol ,为确保反应的连续性,需向反应釜中以
,为确保反应的连续性,需向反应釜中以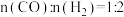 、进气流量0.03mol·min-1持续通入原料,同时控制出气流量为0.02mol·min
、进气流量0.03mol·min-1持续通入原料,同时控制出气流量为0.02mol·min ,单位时间内
,单位时间内 的转化率为60%,则流出气体中
的转化率为60%,则流出气体中 的百分含量为
的百分含量为___________ ;控制出气流量小于进气流量的原因为___________ 。

 kJ⋅mol
kJ⋅mol ;工业上常用
;工业上常用 或CO催化氢化法合成
或CO催化氢化法合成 。回答下列问题:
。回答下列问题:(1)
 和
和 在某催化剂表面合成
在某催化剂表面合成 :
:
 ,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为
,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为 (
( 、
、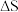 随温度的变化不大),
随温度的变化不大), 随温度的变化关系如图乙所示,图中表示该反应的直线是
随温度的变化关系如图乙所示,图中表示该反应的直线是
(2)CO催化加氢法合成
 ,进而制备
,进而制备 的过程中涉及如下反应:
的过程中涉及如下反应:反应I:


反应II:


反应III:

 kJ⋅mol-1
kJ⋅mol-1①在298K,101kPa时,
 、
、 、
、 的摩尔燃烧焓分别为akJ⋅mol-1、bkJ⋅mol-1、ckJ⋅mol-1,则
的摩尔燃烧焓分别为akJ⋅mol-1、bkJ⋅mol-1、ckJ⋅mol-1,则
②一定温度下,向2L恒容密闭容器中充入2mol
 和4mol
和4mol 制备
制备 ,初始压强为
,初始压强为 Pa,5min达到平衡时
Pa,5min达到平衡时 的转化率为70%,
的转化率为70%,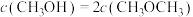 ,且
,且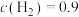 mol⋅L-1。则0~5min内,
mol⋅L-1。则0~5min内,
 ;反应I的平衡常数
;反应I的平衡常数
 表示);平衡后,保持温度和容器体积不变,向容器中再充入1mol
表示);平衡后,保持温度和容器体积不变,向容器中再充入1mol 和2mol
和2mol ,重新达到平衡后,
,重新达到平衡后, 的物质的量分数
的物质的量分数③工业生产中,需要在260℃、压强恒为4.0MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01mol
 和0.02mol
和0.02mol ,为确保反应的连续性,需向反应釜中以
,为确保反应的连续性,需向反应釜中以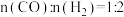 、进气流量0.03mol·min-1持续通入原料,同时控制出气流量为0.02mol·min
、进气流量0.03mol·min-1持续通入原料,同时控制出气流量为0.02mol·min ,单位时间内
,单位时间内 的转化率为60%,则流出气体中
的转化率为60%,则流出气体中 的百分含量为
的百分含量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】I.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,HA- H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系不正确的是_________。
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度________ (填“>”、“<”或“=”)0.11mol·L-1。
II.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(3)①某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+) = 2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是___________ ,
②写出亚磷酸与少量NaOH溶液反应的离子方程式___________ 。
III.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(4)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g) CH2==CH2(g)+4H2O(g) △H="a" kJ·mol-1已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H="-44.0" kJ·mol-1,则a=
CH2==CH2(g)+4H2O(g) △H="a" kJ·mol-1已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H="-44.0" kJ·mol-1,则a=______ kJ·mol-1。
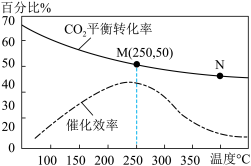
(5)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如右上图,下列有关说法不正确的是_______ (填序号)
①温度越高,催化剂的催化效率越高
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随着温度升高,乙烯的产率增大
④增大压强可提高乙烯的体积分数
⑤N点正反应速率一定大于M点正反应速率
IV.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g) 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(6)若在500℃时,投料 =1且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=
=1且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________ 。
 H++A2-。回答下列问题:
H++A2-。回答下列问题:(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系不正确的是_________。
| A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 |
| B.c(OH-)=c(H+)+c(HA-) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) |
| D.c(Na+)=2c(A2-)+2c(HA-) |
II.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3
 H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。(3)①某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+) = 2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是
②写出亚磷酸与少量NaOH溶液反应的离子方程式
III.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(4)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)
 CH2==CH2(g)+4H2O(g) △H="a" kJ·mol-1已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H="-44.0" kJ·mol-1,则a=
CH2==CH2(g)+4H2O(g) △H="a" kJ·mol-1已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H="-44.0" kJ·mol-1,则a=
(5)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如右上图,下列有关说法不正确的是
①温度越高,催化剂的催化效率越高
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随着温度升高,乙烯的产率增大
④增大压强可提高乙烯的体积分数
⑤N点正反应速率一定大于M点正反应速率
IV.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)
 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。(6)若在500℃时,投料
 =1且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=
=1且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=
您最近一年使用:0次



