Burns和Dainton研究了反应Cl2(g)+CO(g) COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
(1)该反应可认为经过以下反应历程:
第一步:Cl2 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl+CO COCl 快速平衡
COCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
下列表述正确的是______(填标号)。
(2)在某温度下进行实验,测得各组分初浓度和反应初速度如下:
CO的反应级数m=______ ,当实验4进行到某时刻,测得c(Cl2)=0.010mol·L-1,则此时的反应速率v=______ mol·L-1·s-1(已知: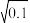 ≈0.32)。
≈0.32)。
 COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。(1)该反应可认为经过以下反应历程:
第一步:Cl2
 2Cl 快速平衡
2Cl 快速平衡第二步:Cl+CO
 COCl 快速平衡
COCl 快速平衡第三步:COCl+Cl2→COCl2+Cl 慢反应
下列表述正确的是______(填标号)。
| A.COCl属于反应的中间产物 |
| B.第一步和第二步的活化能较高 |
| C.决定总反应快慢的是第三步 |
| D.第三步的有效碰撞频率较大 |
| 实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.050 | 0.100 | 4.26×10-3 |
| 3 | 0.100 | 0.200 | 2.4×10-2 |
| 4 | 0.050 | 0.050 | 2.13×10-3 |
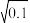 ≈0.32)。
≈0.32)。
2024高三下·全国·专题练习 查看更多[1]
(已下线)题型二 反应速率及速率常数的计算-备战2024年高考化学答题技巧与模板构建
更新时间:2024-03-01 10:42:10
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】碳和氮的化合物在生产生活中广泛存在。低碳烃类(甲烷、乙烯、丙烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举足轻重的作用。
一定条件下,碘甲烷 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:
反应①: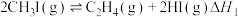
反应②: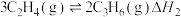
反应①和②在不同温度下的分压平衡常数 如下表,回答下列问题:
如下表,回答下列问题:
(1)根据表中数据推出反应①的活化能 (正)
(正)___________ (填“>”或“<”) (逆);
(逆);
(2)反应②的正、逆反应速率表达式有: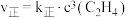 ,
,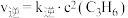 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: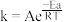 [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越___________ (填“大”或“小”)。当该反应达到平衡后,升高温度,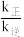 的值
的值___________ (填“增大”“减小”或“不变”);
一定条件下,碘甲烷
 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:反应①:
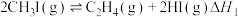
反应②:
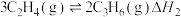
反应①和②在不同温度下的分压平衡常数
 如下表,回答下列问题:
如下表,回答下列问题: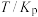 |  |  |  |  |  |  |
| 反应① | 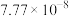 | 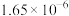 | 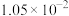 | 2.80 |  | 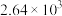 |
| 反应② | 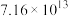 | 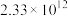 | 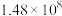 | 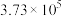 | 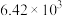 | 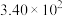 |
(1)根据表中数据推出反应①的活化能
 (正)
(正) (逆);
(逆);(2)反应②的正、逆反应速率表达式有:
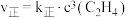 ,
,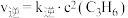 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: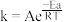 [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越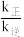 的值
的值
您最近一年使用:0次
填空题
|
适中
(0.65)
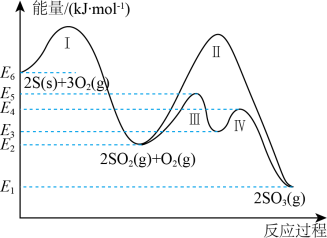
【推荐2】煤和石油燃烧生成的二氧化硫及氮氧化物是大气主要污染物之一,请按要求回答下列问题。硫与硫的氧化物在转化过程中的能量变化如下图所示。
已知: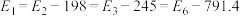 。
。
(1)图中的反应I、Ⅱ、Ⅲ、IV中属于吸热反应的是_______ 。
(2)表示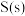 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(3)从图中可看出将 氧化成
氧化成 有两条途径:a.
有两条途径:a. 经过途径Ⅲ、途径Ⅳ转化成
经过途径Ⅲ、途径Ⅳ转化成 ;b.
;b. 经过途径Ⅱ转化成
经过途径Ⅱ转化成 。这两种途径相比,a改变的条件是
。这两种途径相比,a改变的条件是_______ ,该条件能改变反应速率的原因是_______ 。
(4)用 溶液作吸收液处理大气污染物氮氧化物时,氮氧化物被吸收生成
溶液作吸收液处理大气污染物氮氧化物时,氮氧化物被吸收生成 。用石墨电极电解处理后溶液中的
。用石墨电极电解处理后溶液中的 ,使其转化为无毒物质,同时使吸收液再生。
,使其转化为无毒物质,同时使吸收液再生。
①写出电解时阳极的电极反应式_______ 。
②若电解后阴极生成 还原产物,阳极生成气体在标准状况下的体积是
还原产物,阳极生成气体在标准状况下的体积是_______ 。

已知:
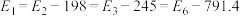 。
。(1)图中的反应I、Ⅱ、Ⅲ、IV中属于吸热反应的是
(2)表示
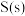 燃烧热的热化学方程式为
燃烧热的热化学方程式为(3)从图中可看出将
 氧化成
氧化成 有两条途径:a.
有两条途径:a. 经过途径Ⅲ、途径Ⅳ转化成
经过途径Ⅲ、途径Ⅳ转化成 ;b.
;b. 经过途径Ⅱ转化成
经过途径Ⅱ转化成 。这两种途径相比,a改变的条件是
。这两种途径相比,a改变的条件是(4)用
 溶液作吸收液处理大气污染物氮氧化物时,氮氧化物被吸收生成
溶液作吸收液处理大气污染物氮氧化物时,氮氧化物被吸收生成 。用石墨电极电解处理后溶液中的
。用石墨电极电解处理后溶液中的 ,使其转化为无毒物质,同时使吸收液再生。
,使其转化为无毒物质,同时使吸收液再生。①写出电解时阳极的电极反应式
②若电解后阴极生成
 还原产物,阳极生成气体在标准状况下的体积是
还原产物,阳极生成气体在标准状况下的体积是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g) CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O FeO++N2;则第二步为
FeO++N2;则第二步为____________________ (写化学方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_________ (填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g) 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
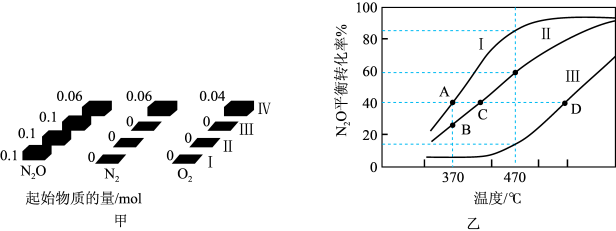
①该反应的△H_____ 0(填“>”或“<”)。
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为_________ 。B点对应的平衡常数k=________ (保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是_______________ 。
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应_________ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(1)对于反应N2O(g)+CO(g)
 CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:第一步为Fe++N2O
 FeO++N2;则第二步为
FeO++N2;则第二步为已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)
 2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡转化率如图乙所示:
①该反应的△H
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为
③图中A、C、D三点容器内气体密度由大到小的顺序是
④若容器Ⅳ体积为1L,反应在370℃下进行,则起始时反应
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
回答下列问题:
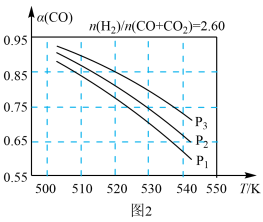
(1)反应①的化学平衡常数K的表达式为___________ ;图1中能正确反映平衡常数K随温度变化关系的曲线为___________ (填曲线标记字母),其判断理由是___________ 。

(2)合成气组成 =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___________ (填“增大”或“减小”),其原因是___________ ;图2中的压强由大到小为___________ ,其判断理由是___________ 。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1③CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41 kJ·mol-1回答下列问题:
(1)反应①的化学平衡常数K的表达式为

(2)合成气组成
 =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________________ 。
(2)该反应为___________ 反应(填“吸热”“放热”)。
 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氮、硫及其化合物
Ⅰ.氮、硫及其化合物在工农业生产生活中有着重要作用,但对环境也有一定的危害。
(1)导致酸雨形成的气体主要是___________
(2)下列关于氮及其化合物的表述完全正确的是___________
(3)将一定量锌与 浓硫酸充分反应后,锌完全溶解同时产生气体
浓硫酸充分反应后,锌完全溶解同时产生气体 ,将反应后的溶液稀释至
,将反应后的溶液稀释至 ,测得溶液
,测得溶液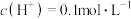 ,则下列叙述中错误的是___________
,则下列叙述中错误的是___________
Ⅱ.工业上常用如下反应消除氮氧化物的污染: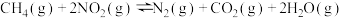

(4)书写该反应的平衡常数表达式
___________
(5)该反应达到平衡后,为再提高反应速率同时提高 的转化率,可采取的措施有___________。
的转化率,可采取的措施有___________。
(6)在体积一定的容器中进行上述反应并达到平衡,保持其它条件不变,通入一定量的 ,下列说法正确的是___________。
,下列说法正确的是___________。
Ⅰ.氮、硫及其化合物在工农业生产生活中有着重要作用,但对环境也有一定的危害。
(1)导致酸雨形成的气体主要是___________
A. | B. | C. | D. |
A.氮原子的核外电子轨道表示式: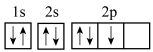 |
B.氨分子的球棍模型: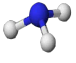 |
C. 的电离方程式: 的电离方程式: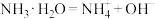 |
D.氮气的结构式: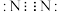 |
 浓硫酸充分反应后,锌完全溶解同时产生气体
浓硫酸充分反应后,锌完全溶解同时产生气体 ,将反应后的溶液稀释至
,将反应后的溶液稀释至 ,测得溶液
,测得溶液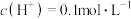 ,则下列叙述中错误的是___________
,则下列叙述中错误的是___________A.反应中生成的气体有 和 和 |
B.反应中共消耗锌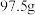 |
C.气体中 和 和 物质的量之比为 物质的量之比为 |
D.反应共转移电子 |
Ⅱ.工业上常用如下反应消除氮氧化物的污染:
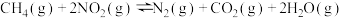

(4)书写该反应的平衡常数表达式

(5)该反应达到平衡后,为再提高反应速率同时提高
 的转化率,可采取的措施有___________。
的转化率,可采取的措施有___________。| A.改用高效催化剂 | B.升高温度 |
| C.缩小容器的体积 | D.增加 的浓度 的浓度 |
 ,下列说法正确的是___________。
,下列说法正确的是___________。| A.正反应速率先增大后减小 | B.混合气体的平均密度增大 |
| C.化学平衡常数增大 | D.达到新平衡时 增大 增大 |
您最近一年使用:0次



