某温度下,在体积一定的密闭容器中进行如下反应:2X(g)+Y(g)⇌Z(g)+W(s)△H>0,下列叙述正确的是
| A.恒温,将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞几率提高 |
| B.加入少量W,逆反应速率增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.在容器中加入氩气,反应速率不变 |
更新时间:2024-03-26 17:31:46
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】下列说法正确的是
| A.升高温度,活化分子百分数增多,反应速率加快 |
| B.使用催化剂,降低△H,提高反应速率 |
| C.对于体积不变的气体反应,充入稀有气体提高压强,平衡会移动 |
| D.活化能越高,反应速率越大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是( )
| A.分子发生碰撞就一定发生反应 |
| B.发生有效碰撞的分子具有最高的能量 |
| C.有效碰撞是活化分子在一定方向上的碰撞 |
| D.活化分子的平均能量称之活化能 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列有关化学反应速率的说法正确的是
| A.用锌片和稀硫酸反应制取氢气时,用粗锌比纯锌反应生成氢气的速率会加快 |
| B.100 mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.C(s)+H2O(g)⇌CO(g)+H2(g)在容积可变的密闭容器进行,增加C(s)的量反应速率增大 |
| D.在合成氨反应中保持容器体积不变,通入He增大压强,反应速率加快 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】将盐酸滴到碳酸钙固体上,能使反应的最初速率加快的是:
| A.盐酸浓度不变,使用量增大1倍 |
| B.盐酸浓度增加1倍,用量减至1/2 |
| C.将碳酸钙粉末改为块状 |
| D.使反应在较低温度下进行 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】反应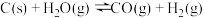 在一密闭容器中进行,下列条件的改变能加快反应速率的是
在一密闭容器中进行,下列条件的改变能加快反应速率的是
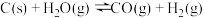 在一密闭容器中进行,下列条件的改变能加快反应速率的是
在一密闭容器中进行,下列条件的改变能加快反应速率的是| A.增加C的量 | B.将容器的容积缩小一半 |
C.保持容器容积不变,充入 | D.保持压强不变,降低容器内的温度 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行, 在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+ H2(g)在一可变容积的密闭容器中进行, 在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
 CO(g)+ H2(g)在一可变容积的密闭容器中进行, 在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+ H2(g)在一可变容积的密闭容器中进行, 在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是| A.增加CO的物质的量 | B.保持压强不变,充入N2使容器体积变大 |
| C.保持体积不变,充入N2使体系压强增大 | D.将容器的体积缩小一半 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】下列措施对增大反应速率明显有效的是( )
| A.在用H2和N2工业合成NH3时,降低温度 | B.将铝片改为铝粉,做铝与氧气反应的实验 |
| C.K2SO4与BaCl2在溶液中反应时,增大压强 | D.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】足量Zn粉与50mL、 0.1 mol∙L−1的稀硫酸充分反应。为了减慢此反应速率而不改变H2的产量,可以使用如下方法中的
①加Na2SO4溶液;②改用50mL、0.1 mol∙L−1的稀盐酸;③改用50mL、0.05 mol∙L−1的硝酸;④加适量Na2CO3溶液;⑤减压;⑥冰水浴;
①加Na2SO4溶液;②改用50mL、0.1 mol∙L−1的稀盐酸;③改用50mL、0.05 mol∙L−1的硝酸;④加适量Na2CO3溶液;⑤减压;⑥冰水浴;
| A.①⑥ | B.①⑤⑥ | C.①②⑤⑥ | D.①②③⑤⑥ |
您最近一年使用:0次




