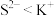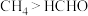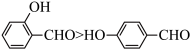元素F、Cl、Br、I位于周期表VIIA族。下列事实不能通过比较元素电负性解释的是
A. 键的键能小于 键的键能小于 键的键能 键的键能 |
| B.ClBr与水发生反应的产物是HCl和HBrO |
C. 属于离子化合物, 属于离子化合物, 属于共价化合物 属于共价化合物 |
D.气态氟化氢中存在 ,而气态氯化氢中是HCl分子 ,而气态氯化氢中是HCl分子 |
更新时间:2024-04-01 17:32:53
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】某固体化合物的化学式NH5,它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是
| A.它与足量的水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |
| B.NH5中只有极性共价键的共价化合物 |
| C.1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数) |
| D.NH5中所有原子最外层均为8个电子 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法中不正确的是
| A.在离子化合物里,只存在离子键,不存在共价键 |
| B.一般根据原子电负性的差值可以判断化学键类型 |
| C.在共价化合物分子内,一定不存在离子键 |
| D.乙醇在水中溶解度很大,原因之一是乙醇分子与水分子之间形成氢键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是
A.电离能大小: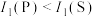 | B.半径大小: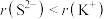 |
C.酸性强弱: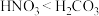 | D.电负性大小: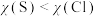 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在碱性溶液中, 与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
 与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
| A.该配离子中非金属元素的电负性大小顺序有O>N>C>H |
| B.该配离子中铜离子的配位数为4 |
C.该配离子中N与C的杂化类型分别为 和 和 |
| D.该配离子存在的化学键类型有离子键、共价键、配位键、氢键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】氧化铈(CeO2)常用作玻璃工业添加剂,在其立方晶胞中掺杂Y2O3,Y3+占据原来Ce4+的位置,可以得到更稳定的结构,这种稳定的结构使得氧化铈具有许多独特的性质和应用。假设CeO2晶胞边长为apm,下列说法错误的是
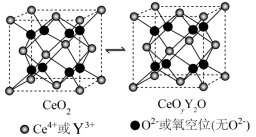

A.CeO2晶胞中 与最近 与最近 的核间距为 的核间距为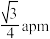 |
| B.CeO2立方晶胞中铈离子的配位数为4 |
| C.CeO2晶胞中氧离子填充在铈离子构成的四面体空隙中 |
| D.若掺杂Y2O3后得到n(CeO2)∶n(Y2O3)=0.8∶0.1的晶体,则此晶体中O2−的空缺率为5% |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法不正确的是
A.不是所有的共价键( 键)都具有方向性 键)都具有方向性 |
B. 键的键能比 键的键能比 键与 键与 键的键能和大,所以 键的键能和大,所以 键不易发生加成反应 键不易发生加成反应 |
C.根据电负性及价层电子对互斥理论可知, 分子的极性大于 分子的极性大于 分子的极性 分子的极性 |
| D.基态Na原子核外电子占有3个能层、4种能级、6个原子轨道、11种电子运动状态 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】 可用于制造火柴,其分子结构如图所示。下列说法不正确的是
可用于制造火柴,其分子结构如图所示。下列说法不正确的是
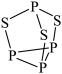
 可用于制造火柴,其分子结构如图所示。下列说法不正确的是
可用于制造火柴,其分子结构如图所示。下列说法不正确的是
| A.S元素的电负性大于P元素 |
B. 的键角小于 的键角小于 |
C.1 mol  分子中孤电子对的数目为 分子中孤电子对的数目为 |
| D.该分子结构中S、P最外层电子数均达到8电子稳定结构 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列“类比”合理的是
| A.常温下,Zn和浓硫酸反应可以得到SO2,则常温下Al和浓硫酸反应也可以得到SO2 |
| B.H2O的沸点比H2S的沸点高,则CH4的沸点比SiH4的沸点高 |
| C.乙烯使溴水褪色发生加成反应,则乙烯使酸性高锰酸钾褪色也发生加成反应 |
| D.加热条件下,Fe和S能直接化合生成FeS,则加热条件下Cu和S也能直接化合生成Cu2S |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列化学用语或图示表达正确的是
A.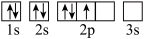 图中电子排布违反了能量最低原理 图中电子排布违反了能量最低原理 |
B.氧原子核外能量最高的电子云的形状: |
C.Na2O2的电子式: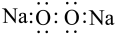 |
| D.由于H2O分子间可以存在氢键,水的热稳定性很强 |
您最近一年使用:0次

 +H+→
+H+→ ,可见成键的一方不提供电子也可能形成化学键
,可见成键的一方不提供电子也可能形成化学键