元素周期表与元素周期律在化学学习研究中有很重要的作用。下表是元素周期表的一部分
(1)④和②组成的一种化合物颜色为淡黄色,请写出该化合物的电子式_______ ,该化合物含有的化学键类型有_______ 。
(2)请写出元素①的简单氢化物的结构式_______ 。
(3)元素①、②、⑦简单氢化物的稳定性最强的是_______ (用化学式表示) 。
(4)元素①、②、⑧简单氢化物的沸点最高的是_______ (用化学式表示) 。
(5)元素③、⑤、⑨的简单离子半径由大到小的顺序(用离子符号表示)_______ 。
(6)写出元素①最高价氧化物对应水化物稀溶液与铜应的化学方程式_______ 。
(7)元素非金属性强弱比较有很多方法,其中比较⑧和⑨的非金属性强弱的研究方案中不可行的是:_______(填序号)。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)请写出元素①的简单氢化物的结构式
(3)元素①、②、⑦简单氢化物的稳定性最强的是
(4)元素①、②、⑧简单氢化物的沸点最高的是
(5)元素③、⑤、⑨的简单离子半径由大到小的顺序(用离子符号表示)
(6)写出元素①最高价氧化物对应水化物稀溶液与铜应的化学方程式
(7)元素非金属性强弱比较有很多方法,其中比较⑧和⑨的非金属性强弱的研究方案中不可行的是:_______(填序号)。
| A.比较两种单质的颜色 | B.比较两种单质与 化合的难易程度 化合的难易程度 |
| C.依据两元素在周期表中的位置 | D.比较氧化物对应水化物的酸性 |
更新时间:2024-04-15 19:45:30
|
相似题推荐
解答题-无机推断题
|
较易
(0.85)
【推荐1】X、Y、Z、R为短周期主族元素,X为原子半径最大的短周期元素,Y的气态氢化物与其最高价氧化物对应的水化物可反应生成离子化合物,Z元素的单质为淡黄色固体,R与Z同周期,R的最低负价和最高正价分别为−1,+7,另有元素W,其原子序数为34。
(1)元素W在周期表中位置为___________ ,原子结构示意图为___________ 。
(2)X、Y、Z、R元素形成的四种简单离子半径由大到小顺序为___________ (用离子符号表示)。
(3)Y的气态氢化物可与R的单质反应产生白烟,该反应的化学方程式为___________ ,Y的某种氢化物电子数目为18,该氢化物的电子式为___________ 。
(4)设计一个简单可行的实验方案验证Z与R的非金属性强弱___________ 。
(1)元素W在周期表中位置为
(2)X、Y、Z、R元素形成的四种简单离子半径由大到小顺序为
(3)Y的气态氢化物可与R的单质反应产生白烟,该反应的化学方程式为
(4)设计一个简单可行的实验方案验证Z与R的非金属性强弱
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】由原子序数依次增大的四种短周期主族元素X、Y、Z、W组成的化合物A(如图所示)是生产某种农药的主要原料,其中W的单质溶于水可生成漂白性物质。Y位于W的相邻主族,且二者对应单质常温下都是气体。请回答下列问题:
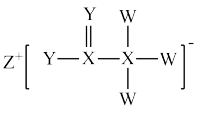
(1)元素X的最高正价为______ ,元素Y在周期表中的位置为_______ 。
(2)简单氢化物的沸点:Y______ (填“>”或“<”)W。
(3)物质A属于______ (填“离子”或“共价”)化合物;用铂丝蘸取物质A,在酒精灯火焰上灼烧,产生火焰的焰色为_______ 。
(4)X、W的最高价氧化物对应的水化物中酸性较强的是______ (填化学式)。
(5)W的单质与Z的最高价氧化物对应的水化物反应的离子方程式为______ 。

(1)元素X的最高正价为
(2)简单氢化物的沸点:Y
(3)物质A属于
(4)X、W的最高价氧化物对应的水化物中酸性较强的是
(5)W的单质与Z的最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐3】如图为元素周期表的一部分,请参照元素①②等在图中的位置,回答下列问题。
(1)第三周期元素中非金属性最强的元素的原子结构示意图是_____ 。
(2)⑥的最高价氧化物对应的水化物分别与⑤、⑨的最高价氧化物对应的水化物反应的离子方程式是_____ 、_____ 。
(3)下列可以判断⑤和⑥金属性强弱的是_____ (填序号)。
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥
(4)②③⑦的最高价氧化物均是_____ (填“离子化合物”“共价化合物”)。
(5)为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:

①仪器A的名称是_____ ,A中发生反应的离子方程式是_____ 。
②验证溴与碘的非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,振荡、静置,可观察到_____ 。
③第ⅦA族元素非金属性随元素核电荷数的增加而逐渐减弱的原因:同主族元素从上到下_____ ,_____ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(2)⑥的最高价氧化物对应的水化物分别与⑤、⑨的最高价氧化物对应的水化物反应的离子方程式是
(3)下列可以判断⑤和⑥金属性强弱的是
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥
(4)②③⑦的最高价氧化物均是
(5)为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:

①仪器A的名称是
②验证溴与碘的非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,振荡、静置,可观察到
③第ⅦA族元素非金属性随元素核电荷数的增加而逐渐减弱的原因:同主族元素从上到下
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4,请回答下列问题:
(1)用电子式表示 的形成过程
的形成过程_____________________ 。
(2)W在周期表中的位置是________________ 。
(3)X、Y、Z形成化合物的电子式为______ , 中含有的化学键类型为
中含有的化学键类型为________________ 。
(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是__________ (用元素的离子符号表示)。
(5)下列说法能证明非金属性Q强于R的是______ (填字母)。
a.简单阴离子的还原性:
b.简单氢化物热稳定性: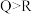
c.氧化物对应的水化物的酸性: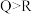
(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是___________ 。
(1)用电子式表示
 的形成过程
的形成过程(2)W在周期表中的位置是
(3)X、Y、Z形成化合物的电子式为
 中含有的化学键类型为
中含有的化学键类型为(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是
(5)下列说法能证明非金属性Q强于R的是
a.简单阴离子的还原性:

b.简单氢化物热稳定性:
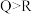
c.氧化物对应的水化物的酸性:
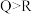
(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】下表为元素周期表的一部分,请回答有关问题:
(1)已知元素⑩的一种核素,其中子数为45,用原子符号表示该核素为_________
(2)由元素②和④形成的三核直线形分子的结构式为_________
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程_______________ 。
(4)由上述元素④和⑤构成的淡黄色固体化合物的电子式为_________ ,该化合物所含的化学键类型为_______________ (填“离子键”、“极性键”或“非极性键”),若将该固体投入到含有下列离子的溶液中: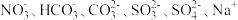 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有_________ (填离子符号)。
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是_________ (用离子符号表示);元素⑨的最高价氧化物的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为_______________________________________
(6)能比较元素⑦和⑧非金属性强弱的实验事实是_________ (填字母序号)。
a.⑦的氢化物的酸性比⑧的氢化物的酸性弱
b.⑧的单质R2与H2化合比⑦的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑦的氢化物H2Q的水溶液中通少量⑧的单质R2气体可置换出单质Q
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)由元素②和④形成的三核直线形分子的结构式为
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程
(4)由上述元素④和⑤构成的淡黄色固体化合物的电子式为
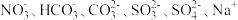 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是
(6)能比较元素⑦和⑧非金属性强弱的实验事实是
a.⑦的氢化物的酸性比⑧的氢化物的酸性弱
b.⑧的单质R2与H2化合比⑦的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑦的氢化物H2Q的水溶液中通少量⑧的单质R2气体可置换出单质Q
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】下图为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。

(1)这8种元素中,原子半径最大的是:___________ (填元素符号),最高价氧化物对应的水化物碱性最强的是:___________ (填化学式,下同),最高价氧化物对应的水化物酸性最强的是:___________ 。
(2)写出元素①与③形成的化合物的电子式为:___________ 。
(3)用电子式表示元素⑤与⑧形成化合物的过程:___________ 。
(4)元素⑥的单质与⑤的最高价氧化物对应水化物反应的化学方程式:___________ 。
(5)⑤元素的单质与④的最简单氢化物反应的离子方程式为:___________ 。

(1)这8种元素中,原子半径最大的是:
(2)写出元素①与③形成的化合物的电子式为:
(3)用电子式表示元素⑤与⑧形成化合物的过程:
(4)元素⑥的单质与⑤的最高价氧化物对应水化物反应的化学方程式:
(5)⑤元素的单质与④的最简单氢化物反应的离子方程式为:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】下表为元素周期表的一部分,用化学用语回答下列问题:
(1)化合物A是由⑤⑧两种元素构成的,用电子式表示其形成过程______________
(2)④、⑦元素形成的化合物中,⑦的原子数与④、⑦间的化学键个数之比___________________
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式_____________________________________
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

a、⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:___________________ ;
b、M中所含化学键的类型___________________________________ ;
c、M中的阳离子的鉴定方法是_______________________________________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)④、⑦元素形成的化合物中,⑦的原子数与④、⑦间的化学键个数之比
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

a、⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:
b、M中所含化学键的类型
c、M中的阳离子的鉴定方法是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】下表列出了①~⑨九种元素在周期表中的位置。

请按要求回答下列问题:
(1)元素⑥的原子结构示意图:_______ ,元素①与⑨组成的化合物的电子式:_______ ,元素⑤和⑨形成的化合物中化学键类型为_______ 。
(2)元素①~⑨中原子半径最大的是_______ (填元素符号)。
(3)元素⑤~⑨中非金属性最强的是_______ (填元素符号)。
(4)元素⑧和⑨的最高价氧化物对应的水化物中,酸性较强的是_______ (填化学式)。
(5)元素②、③、④分别和元素①形成的简单氢化物稳定性由强到弱的顺序是_______ (填化学式)。
(6)元素⑦最高价氧化物对应的水化物与元素⑧最高价氧化物对应的水化物反应的离子方程式_______ 。
(7)元素⑤组成的单质在元素③组成的常见单质中加热燃烧生成产物M,写出该反应的化学方程式_______ ,0.1 mol M与足量的二氧化碳反应,则该反应过程中转移的电子数为_______ 。

请按要求回答下列问题:
(1)元素⑥的原子结构示意图:
(2)元素①~⑨中原子半径最大的是
(3)元素⑤~⑨中非金属性最强的是
(4)元素⑧和⑨的最高价氧化物对应的水化物中,酸性较强的是
(5)元素②、③、④分别和元素①形成的简单氢化物稳定性由强到弱的顺序是
(6)元素⑦最高价氧化物对应的水化物与元素⑧最高价氧化物对应的水化物反应的离子方程式
(7)元素⑤组成的单质在元素③组成的常见单质中加热燃烧生成产物M,写出该反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
(1)元素②的原子结构示意图为_____ 。
(2)元素③、④、⑤、⑥原子半径由大到小为_____ 。
(3)上述8种元素中,非金属性最强的是_____ 。
(4)元素②、③形成的气态氢化物稳定性:_____ >_____ ;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____ 。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____ 。
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:_________________________ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素②的原子结构示意图为
(2)元素③、④、⑤、⑥原子半径由大到小为
(3)上述8种元素中,非金属性最强的是
(4)元素②、③形成的气态氢化物稳定性:
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】判断
(1)范德华力存在于任何物质中_____
(2)范德华力比化学键弱得多_____
(3)CH4、C2H6、C3H8的熔点、沸点依次升高_____
(4)HF、HCl、HBr、HI的稳定性依次减弱,是因为分子间作用力依次减弱_____
(5)卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大_____
(6)加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏_____
(7)CO2溶于水和干冰升华都只有分子间作用力改变_____
(8)石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏_____
(1)范德华力存在于任何物质中
(2)范德华力比化学键弱得多
(3)CH4、C2H6、C3H8的熔点、沸点依次升高
(4)HF、HCl、HBr、HI的稳定性依次减弱,是因为分子间作用力依次减弱
(5)卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大
(6)加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
(7)CO2溶于水和干冰升华都只有分子间作用力改变
(8)石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】有X、Y、Z三种元素,其中X、Y属于同一主族,加热时其单质都能与氢气形成气态氢化物H2X,H2Y。常温下,X单质为气态,X与Y可形成两种化合物YX2和YX3,Y、Z均在X的下一周期,而Z可与X生成化合物Z2X和Z2X2。试写出:
(1)元素名称:X______ Z ______ ;Y在周期表中位于______ 周期_____ 族;
(2)化合物H2Y的电子式为__________ 其中含有的化学键的类型是______ 键;
(3)用电子式表示化合物Z2X的形成过程__________________________ 。
(1)元素名称:X
(2)化合物H2Y的电子式为
(3)用电子式表示化合物Z2X的形成过程
您最近一年使用:0次




