下表为元素周期表的一部分,用化学用语回答下列问题:
(1)化合物A是由⑤⑧两种元素构成的,用电子式表示其形成过程______________
(2)④、⑦元素形成的化合物中,⑦的原子数与④、⑦间的化学键个数之比___________________
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式_____________________________________
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

a、⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:___________________ ;
b、M中所含化学键的类型___________________________________ ;
c、M中的阳离子的鉴定方法是_______________________________________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)④、⑦元素形成的化合物中,⑦的原子数与④、⑦间的化学键个数之比
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

a、⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:
b、M中所含化学键的类型
c、M中的阳离子的鉴定方法是
更新时间:2019-03-05 17:32:28
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】在绿色低碳技术的研发体系中,实现 的减排和利用技术日益受到重视。回答下列问题:
的减排和利用技术日益受到重视。回答下列问题:
(1)RWGS反应 △H可实现
△H可实现 的减排。已知:部分化学键的键能如表所示:
的减排。已知:部分化学键的键能如表所示:
则
_________  ,该反应的正活化能和逆活化能中较大的是
,该反应的正活化能和逆活化能中较大的是_________ (填“正活化能”或“逆活化能”)。
(2)甲烷化反应:
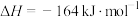 可有效降低空气中的含量。已知
可有效降低空气中的含量。已知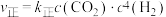 ,
, (
( 、
、 分别为正逆反应的速率常数)。
分别为正逆反应的速率常数)。
①加入催化剂,该反应 的将
的将_________ (填“增大”“减小”或“不变”)。
②实验测得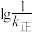 、
、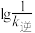 随温度变化的曲线如图所示,则表示
随温度变化的曲线如图所示,则表示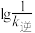 随温度变化的曲线为
随温度变化的曲线为_________ (填“L1或L2”),原因为_________ 。

(3)科学家将甲烷化反应设计成如图的原电池装置来实现 的减排和利用。
的减排和利用。

电极A为原电池的_________ (填“正极”或“负极”),该电极的反应式为_________ 。
 的减排和利用技术日益受到重视。回答下列问题:
的减排和利用技术日益受到重视。回答下列问题:(1)RWGS反应
 △H可实现
△H可实现 的减排。已知:部分化学键的键能如表所示:
的减排。已知:部分化学键的键能如表所示:| 化学键 |  | C=O | C-H | H-H | O-H |
| 键能(kJ/mol) | 997 | 800 | 414 | 436 | 499 |

 ,该反应的正活化能和逆活化能中较大的是
,该反应的正活化能和逆活化能中较大的是(2)甲烷化反应:

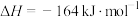 可有效降低空气中的含量。已知
可有效降低空气中的含量。已知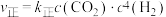 ,
, (
( 、
、 分别为正逆反应的速率常数)。
分别为正逆反应的速率常数)。①加入催化剂,该反应
 的将
的将②实验测得
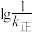 、
、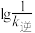 随温度变化的曲线如图所示,则表示
随温度变化的曲线如图所示,则表示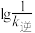 随温度变化的曲线为
随温度变化的曲线为
(3)科学家将甲烷化反应设计成如图的原电池装置来实现
 的减排和利用。
的减排和利用。
电极A为原电池的
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】我国将力争2030年前实现碳达峰、2060年前实现碳中和。回答下列问题:
Ⅰ.以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图1所示。
反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图1所示。______ 转化为______ 。
(2)二氧化碳催化加氢制甲醇[反应为 ],有利于减少温室气体二氧化碳排放。某温度下,向2L的恒容密闭容器充入6mol
],有利于减少温室气体二氧化碳排放。某温度下,向2L的恒容密闭容器充入6mol  和8mol
和8mol  ,测得
,测得 物质的量随时间变化如图2所示。
物质的量随时间变化如图2所示。 的平均反应速率为
的平均反应速率为______ 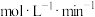 ;4 min时,
;4 min时,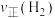
______ (填“>”“<”或“=”)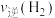 。
。
(3)平衡时, 的转化率为
的转化率为______ (保留一位小数)。
(4)下列能表明该反应已经达到平衡状态的是______(填字母)。
Ⅱ.二氧化碳催化加氢制得的甲醇( )是优质的清洁燃料,可制作碱性燃料电池,工作原理如图3所示。
)是优质的清洁燃料,可制作碱性燃料电池,工作原理如图3所示。______ (填“正”或“负”)极,B电极的电极反应式为______ 。
(6)该燃料电池每消耗标准状况下11.2 L 时,外电路中通过电子的物质的量为
时,外电路中通过电子的物质的量为______ mol。
Ⅰ.以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图1所示。
反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图1所示。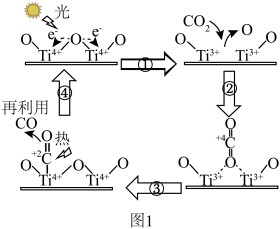
(2)二氧化碳催化加氢制甲醇[反应为
 ],有利于减少温室气体二氧化碳排放。某温度下,向2L的恒容密闭容器充入6mol
],有利于减少温室气体二氧化碳排放。某温度下,向2L的恒容密闭容器充入6mol  和8mol
和8mol  ,测得
,测得 物质的量随时间变化如图2所示。
物质的量随时间变化如图2所示。
 的平均反应速率为
的平均反应速率为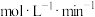 ;4 min时,
;4 min时,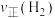
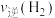 。
。(3)平衡时,
 的转化率为
的转化率为(4)下列能表明该反应已经达到平衡状态的是______(填字母)。
A. | B.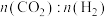 保持不变 保持不变 |
| C.压强保持不变 | D.容器中 浓度与 浓度与 浓度之比为1∶1 浓度之比为1∶1 |
Ⅱ.二氧化碳催化加氢制得的甲醇(
 )是优质的清洁燃料,可制作碱性燃料电池,工作原理如图3所示。
)是优质的清洁燃料,可制作碱性燃料电池,工作原理如图3所示。
(6)该燃料电池每消耗标准状况下11.2 L
 时,外电路中通过电子的物质的量为
时,外电路中通过电子的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐3】钴酸锂电池的正极材料含有钴酸锂(LiCoO2)、铝箔及少量铁等,其通过如图流程可回收铝、钴、锂。请回答下列问题:

(1)钴酸锂电池放电总反应为:Li1-xCoO2+LixCy=LiCoO2+Cy,则其负极的电极反应式为_____ 。
(2)“酸浸”时Co、Li元素的浸出率随温度的变化如图所示:

“酸浸”的适宜温度约为_____ ℃[所填数据限整数]。
(3)“调pH除杂”的目的是使Fe3+沉淀完全[即c(Fe3+)≤1.0×10−5 mol∙L−1],则常温下应控制pH≥_____ [保留到小数点后1位,另外已知常温时Fe(OH)3的Ksp为1.0×10−39]。
(4)沉锂的离子反应方程式为_______ 。
(5)准确称取4.575g的CoC2O4∙2H2O样品,在空气中加热分解获取金属氧化物,固体样品的剩余质量随温度的变化如图所示(已知385℃及以上残留固体均为金属氧化物),请写出B处物质与浓盐酸反应的化学方程式_____ 。


(1)钴酸锂电池放电总反应为:Li1-xCoO2+LixCy=LiCoO2+Cy,则其负极的电极反应式为
(2)“酸浸”时Co、Li元素的浸出率随温度的变化如图所示:

“酸浸”的适宜温度约为
(3)“调pH除杂”的目的是使Fe3+沉淀完全[即c(Fe3+)≤1.0×10−5 mol∙L−1],则常温下应控制pH≥
(4)沉锂的离子反应方程式为
(5)准确称取4.575g的CoC2O4∙2H2O样品,在空气中加热分解获取金属氧化物,固体样品的剩余质量随温度的变化如图所示(已知385℃及以上残留固体均为金属氧化物),请写出B处物质与浓盐酸反应的化学方程式

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。

请回答下列问题:
(1)若常温下,B、C均为气体,D为黑色磁性固体,则C的化学式为_____ , A和E反应生成D的化学方程式为______ 。
(2)若常温下,B为气体,C为黑色固体粉末,则金属A的原子结构示意图为______ ,A和E在一定条件下反应生成D的化学方程式为_____ 。

请回答下列问题:
(1)若常温下,B、C均为气体,D为黑色磁性固体,则C的化学式为
(2)若常温下,B为气体,C为黑色固体粉末,则金属A的原子结构示意图为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】2022年是门捷列夫发现元素周期律153周年,下图为元素周期表的一部分。门捷列夫预言了多种当时未知的元素,T为其中之一。L在地壳中含量排第二位,广泛应用于信息技术等领域。
(1)写出J的原子结构示意图___________ 。
(2)下列说法不正确的是___________。
(3)已知X2Q4结构中含非极性共价键,试画出其结构式(用元素符号表示):___________ 。
(4)非金属性Q_____ M(用<、=、>来表示),判断依据是(试用一个化学方程式来表示)______ 。
| X | Y | Z | ||
| L | J | Q | ||
| T | M |
(2)下列说法不正确的是___________。
| A.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ2 |
| B.Q、J的氧化物的水化物酸性J<Q |
| C.用pH试纸测得Q单质的水溶液pH=3 |
| D.原子半径大小:L>J>Z |
(4)非金属性Q
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
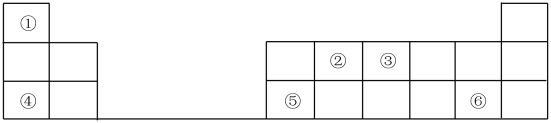
【推荐1】如表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。
请按要求回答下列问题:
(1)将④、⑤和⑥三种元素相比较,金属性最强的是___ (填元素符号);
(2)元素③的最高价氧化物对应的水化物的化学式为___ 。
(3)在这些元素中,原子半径最小的是___ (用元素符号表示)。
(4)元素③的氢化物和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式___ 。

请按要求回答下列问题:
(1)将④、⑤和⑥三种元素相比较,金属性最强的是
(2)元素③的最高价氧化物对应的水化物的化学式为
(3)在这些元素中,原子半径最小的是
(4)元素③的氢化物和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
(1)元素②的原子结构示意图为_____ 。
(2)元素③、④、⑤、⑥原子半径由大到小为_____ 。
(3)上述8种元素中,非金属性最强的是_____ 。
(4)元素②、③形成的气态氢化物稳定性:_____ >_____ ;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____ 。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____ 。
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:_________________________ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素②的原子结构示意图为
(2)元素③、④、⑤、⑥原子半径由大到小为
(3)上述8种元素中,非金属性最强的是
(4)元素②、③形成的气态氢化物稳定性:
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐3】为纪念迪米特里·门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年是“国际化学元素周期表年”.元素周期表是科学界最重要的成就之一,表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.

请按要求回答下列问题:
(1)将①、②和③三种元素相比较,非金属性最强的是(填元素符号)______ ;用原子结构解释原因,理由是:_________
(2)元素②与⑥的氢化物的稳定性顺序为________ (填化学式);
(3)元素②与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与①的最高价氧化物反应的化学方程式为__________
(4)元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是___

请按要求回答下列问题:
(1)将①、②和③三种元素相比较,非金属性最强的是(填元素符号)
(2)元素②与⑥的氢化物的稳定性顺序为
(3)元素②与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与①的最高价氧化物反应的化学方程式为
(4)元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】A、B、C、D、E、F为六种常见的短周期主族元素,原子序数依次增大。A、B能写出两种常温下均呈液态的化合物,D原子核外的M层上有 个电子,A、C同主族,B、E同主族。根据信息回答下列问题:
个电子,A、C同主族,B、E同主族。根据信息回答下列问题:
(1)D在元素周期表中的位置为_______ ;
(2)六种元素中,原子半径最大的是_______ (填元素符号);
(3)B对应的氢化物的沸点高于E对应的氢化物,主要原因是_______ ;
(4)由A分别和B、E、F所形成的三种化合物中,热稳定性最差的是_______ (填化学式);
(5)F对应的单质常用于自来水消毒,该单质与水反应的离子方程式为_______ 。
 个电子,A、C同主族,B、E同主族。根据信息回答下列问题:
个电子,A、C同主族,B、E同主族。根据信息回答下列问题:(1)D在元素周期表中的位置为
(2)六种元素中,原子半径最大的是
(3)B对应的氢化物的沸点高于E对应的氢化物,主要原因是
(4)由A分别和B、E、F所形成的三种化合物中,热稳定性最差的是
(5)F对应的单质常用于自来水消毒,该单质与水反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】A、B、C、D、E、F是原子序数依次增大的6种短周期主族元素。A元素是动植物生长不可缺少的元素,其单质在空气中含量最高;B元素的最外层电子数是其电子层数的3倍;短周期主族元素中C原子半径最大;C、D、E的最高价氧化物对应水化物两两之间都能反应,元素E最高正化合价与最低负化合价的代数和为4。回答下列问题:
(1)A元素组成单质的电子式_____________ 。E和F的最高价氧化物对应水化物酸性更强的是_____________ (填化学式)。
(2)B、C、D、E四种元素简单离子的离子半径由大到小 的顺序是(填具体的离子符号):______________________ ;
(3)C和B能形成C2B和C2B2两种化合物,用电子式请写出C2B2的形成过程:
_________________________________ 。
(4)已知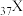 和
和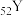 都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
(5)下列物质的变化中未发生化学键破坏的是_____________ (填序号,下同),仅发生离子键破坏的是_____________ ,仅发生共价键破坏的是_____________ ,既发生离子键破坏,又发生共价键破坏的是________________________ .
①氯化钠溶于水、②氯化氢溶于水、③乙醇溶于水、④过氧化钠与水反应、⑤碘升华.
(6)A、B组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐和水。请写出该反应的离子方程式_____________ 。
(1)A元素组成单质的电子式
(2)B、C、D、E四种元素简单离子的离子半径
(3)C和B能形成C2B和C2B2两种化合物,用电子式请写出C2B2的形成过程:
(4)已知
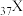 和
和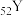 都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);| A.原子半径:X>Y | B.最高价氧化物对应水化物的碱性强弱:X>C |
| C.气态氢化物稳定性强弱:E>Y | D.B与C形成的化合物中不可能含有共价键 |
①氯化钠溶于水、②氯化氢溶于水、③乙醇溶于水、④过氧化钠与水反应、⑤碘升华.
(6)A、B组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐和水。请写出该反应的离子方程式
您最近一年使用:0次




