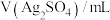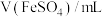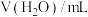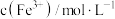铜(Ⅰ)配合物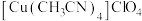 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。
1.制备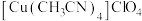
将乙腈的 ,
, ,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
取 产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用
产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用 EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为
EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为 。
。
已知:① 沸点为81℃.酸性条件下遇水生成
沸点为81℃.酸性条件下遇水生成
②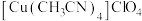 (
(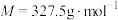 )较易被空气氧化:
)较易被空气氧化:
③EDTA与 形成1:1配合物:
形成1:1配合物:
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器 的作用是
的作用是______ , 中应加入
中应加入______ 作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是______ .
(3)“一系列操作”依次为过滤分离出滤液、______ 冷却结晶、过滤、洗涤、干燥。
(4) 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为______ .
(5)加入醋酸钠溶液的主要目的是______ .
(6)测得产品的纯度为______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(7)下列情况会导致产品纯度测定结果偏高的有______.
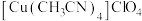 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。1.制备
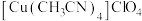
将乙腈的
 ,
, ,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
取
 产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用
产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用 EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为
EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为 。
。已知:①
 沸点为81℃.酸性条件下遇水生成
沸点为81℃.酸性条件下遇水生成
②
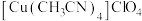 (
(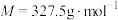 )较易被空气氧化:
)较易被空气氧化:③EDTA与
 形成1:1配合物:
形成1:1配合物:④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器
 的作用是
的作用是 中应加入
中应加入(2)加入过量铜粉能提高产物的纯度,可能的原因是
(3)“一系列操作”依次为过滤分离出滤液、
(4)
 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为(5)加入醋酸钠溶液的主要目的是
(6)测得产品的纯度为
 、
、 、
、 的代数式表示)。
的代数式表示)。(7)下列情况会导致产品纯度测定结果偏高的有______.
A.产品中含有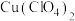 | B.滴定终点时俯视读数 |
| C.盛装EDTA溶液的滴定管未润洗 | D.产品干燥不充分 |
更新时间:2024-04-29 21:37:53
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】高铁酸钾(K2FeO4)是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图所示:
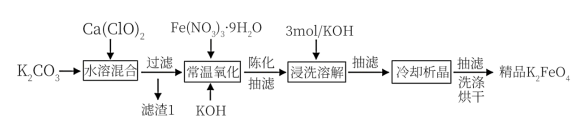
已知高铁酸盐热稳定性差,在碱性环境中比酸性环境中相对稳定。回答以下问题:
(1)高铁酸钾(K2FeO4)中铁元素的化合价为____________ 。
(2)滤渣1的主要成分为(写化学式)________________ 。
(3)写出氧化过程的离子方程式______________________ 。
(4)氧化时控温20~25℃,温度不能高于25℃原因是__________ 。
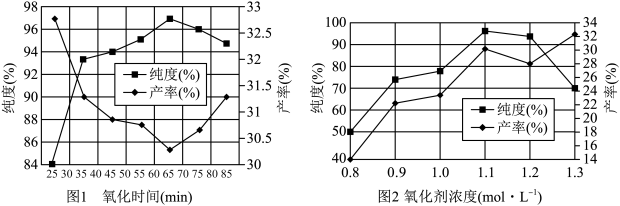
(5)实验测得氧化时间、氧化剂浓度与K2FeO4产率、纯度的实验数据分别如图l、图2 所示。为了获取更纯的高铁酸钾,反应时间应控制在______ min,氧化剂浓度应控制在 ______ mol·L-1。
(6)某工业废水含Mn2+(浓度为0.1 mol·L-l),可用高铁酸钾氧化混凝去除。为避免形成Mn(OH)2降低去除率,控制体系pH<_______ (常温下Ksp[Mn(OH)2]=1×10-13 )。

已知高铁酸盐热稳定性差,在碱性环境中比酸性环境中相对稳定。回答以下问题:
(1)高铁酸钾(K2FeO4)中铁元素的化合价为
(2)滤渣1的主要成分为(写化学式)
(3)写出氧化过程的离子方程式
(4)氧化时控温20~25℃,温度不能高于25℃原因是
(5)实验测得氧化时间、氧化剂浓度与K2FeO4产率、纯度的实验数据分别如图l、图2 所示。为了获取更纯的高铁酸钾,反应时间应控制在

(6)某工业废水含Mn2+(浓度为0.1 mol·L-l),可用高铁酸钾氧化混凝去除。为避免形成Mn(OH)2降低去除率,控制体系pH<
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以 、
、 、
、 、
、 的形式存在。
的形式存在。
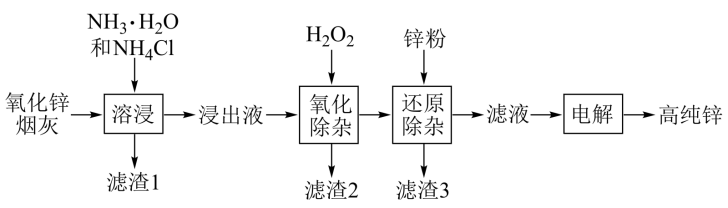
回答下列问题:
 中Zn的化合价为
中Zn的化合价为_______ ,“溶浸”中ZnO发生反应的离子方程式为_______ 。
 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析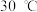 时锌浸出率最高的原因为
时锌浸出率最高的原因为_______ 。
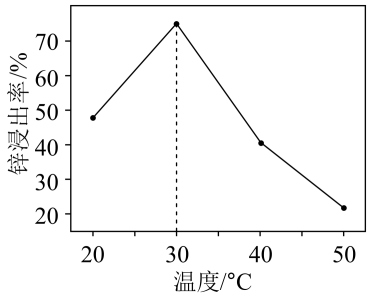
 “氧化除杂”中,
“氧化除杂”中, 转化为
转化为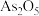 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______ 。
 “滤渣3”的主要成分为
“滤渣3”的主要成分为_______ 。
 “电解”时
“电解”时 在阴极放电的电极反应式为
在阴极放电的电极反应式为______ 。阳极区放出一种无色无味的气体,将其通入滴有KSCN的 溶液中,无明显现象,该气体是
溶液中,无明显现象,该气体是_______  写化学式
写化学式 。电解后的电解液经补充
。电解后的电解液经补充_______  写一种物质的化学式
写一种物质的化学式 后可返回“溶浸”工序继续使用。
后可返回“溶浸”工序继续使用。
 、
、 、
、 、
、 的形式存在。
的形式存在。
回答下列问题:
 中Zn的化合价为
中Zn的化合价为 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析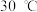 时锌浸出率最高的原因为
时锌浸出率最高的原因为
 “氧化除杂”中,
“氧化除杂”中, 转化为
转化为 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为 “滤渣3”的主要成分为
“滤渣3”的主要成分为 “电解”时
“电解”时 在阴极放电的电极反应式为
在阴极放电的电极反应式为 溶液中,无明显现象,该气体是
溶液中,无明显现象,该气体是 写化学式
写化学式 。电解后的电解液经补充
。电解后的电解液经补充 写一种物质的化学式
写一种物质的化学式 后可返回“溶浸”工序继续使用。
后可返回“溶浸”工序继续使用。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】AOPs(高级氧化技术)通过产生·OH(羟基自由基)能有效去除废水中有机污染物。
I.芬顿反应是AOPs中使用最广泛的方法,主要反应过程如下:
i.Fe2+ + H2O2 + H+ =Fe3+ + ·OH + H2O (快反应)
ii.·OH + OM → CO2 + H2O(快反应,OM为有机物)
iii.2Fe3+ + H2O2 =2Fe2+ + O2 + 2H+(慢反应)
反应过程中存在副反应:·OH + Fe2+ + H+ = Fe3+ + H2O。
(1)决定芬顿反应速率的是过程___________ (填“i”“ii”或“iii”)。
(2)·OH氧化苯酚的化学方程式为___________ 。
II.用铁粉代替Fe2+,并加入硼(B),可加快Fe3+转化为Fe2+,提高有机污染物的去除率。
(3)①B与Fe3+反应生成硼酸(H3BO3)的离子方程式为___________ 。
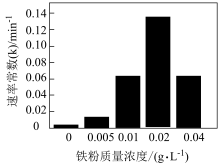
②相同时间内,铁粉投加量与有机污染物去除率的关系如下图所示(k越大,去除效果越好)。铁粉质量浓度大于0.02 g ∙ L−1时,有机污染物去除率下降的原因可能是___________ 。
III.相比于传统的芬顿反应,电芬顿反应具有无需投加H2O2等优点。该方法是利用O2在电极放电生成H2O2,与加入的Fe2+构成芬顿体系,如图1所示。
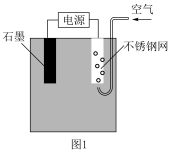
(4)石墨做___________ 极。
(5)溶液pH对H2O2生成量的影响如图2所示。
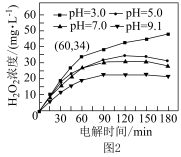
①pH=3,电解时间在0 ~ 60 min内,v(H2O2)=___________ mol·L-1·min-1。
②电解相同时间,随着溶液pH升高,生成的H2O2浓度逐渐减小,结合电极反应式分析原因___________ 。
I.芬顿反应是AOPs中使用最广泛的方法,主要反应过程如下:
i.Fe2+ + H2O2 + H+ =Fe3+ + ·OH + H2O (快反应)
ii.·OH + OM → CO2 + H2O(快反应,OM为有机物)
iii.2Fe3+ + H2O2 =2Fe2+ + O2 + 2H+(慢反应)
反应过程中存在副反应:·OH + Fe2+ + H+ = Fe3+ + H2O。
(1)决定芬顿反应速率的是过程
(2)·OH氧化苯酚的化学方程式为
II.用铁粉代替Fe2+,并加入硼(B),可加快Fe3+转化为Fe2+,提高有机污染物的去除率。
(3)①B与Fe3+反应生成硼酸(H3BO3)的离子方程式为
②相同时间内,铁粉投加量与有机污染物去除率的关系如下图所示(k越大,去除效果越好)。铁粉质量浓度大于0.02 g ∙ L−1时,有机污染物去除率下降的原因可能是

III.相比于传统的芬顿反应,电芬顿反应具有无需投加H2O2等优点。该方法是利用O2在电极放电生成H2O2,与加入的Fe2+构成芬顿体系,如图1所示。

(4)石墨做
(5)溶液pH对H2O2生成量的影响如图2所示。

①pH=3,电解时间在0 ~ 60 min内,v(H2O2)=
②电解相同时间,随着溶液pH升高,生成的H2O2浓度逐渐减小,结合电极反应式分析原因
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:
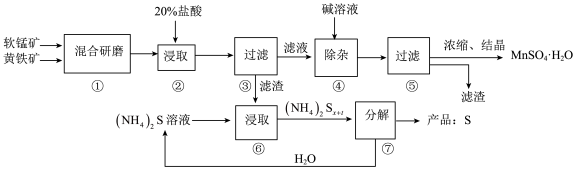
回答下列问题:
(1)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_________ 。
(2)步骤③所得酸性滤液可能含有Fe2+,除去Fe2+可用的物质是________ ;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____ 。步骤⑤所得滤渣为_____ (填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为____________ 。
(4)测定产品MnSO4·H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用 c mol·L-1 KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液VmL,滴定反应的离子方程式为______ ,产品中Mn2+的质量分数为w(Mn2+)=_________ 。

回答下列问题:
(1)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为
(2)步骤③所得酸性滤液可能含有Fe2+,除去Fe2+可用的物质是
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为
(4)测定产品MnSO4·H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用 c mol·L-1 KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液VmL,滴定反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】以废干电池[主要含MnO2、MnOOH、Zn、Zn(OH)2、Fe、KOH]和钛白厂废酸(主要含H2SO4,还有少量Ti3+、Fe2+、Ca2+、Mg2+等)为原料,制备锰锌铁氧体[MnxZn1-xFe2O4]的流程如下:
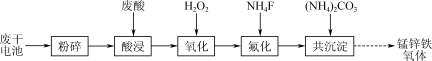
已知:① 25℃时,Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10;酸性较弱时,MgF2、CaF2均易形成[MFn]2-n配离子(M代表金属元素);
②在Ag+催化可发生反应2Mn2++5S2O +8H2O = 2MnO
+8H2O = 2MnO +10SO
+10SO +16H+;
+16H+;
③ (NH4)2S2O8在煮沸时易分解。
(1)酸浸过程中含锰物质被溶液中的FeSO4还原为Mn2+,其中MnO2参与反应的离子方程式为___________ 。
(2)氧化时加入H2O2将Ti3+、Fe2+氧化,再加入Na2CO3调节溶液pH为1~2,生成偏钛酸(H2TiO3)和黄钾铁矾[K2Fe6(SO4)4(OH)12]沉淀,使得钛、钾得以脱除。
① 加入Na2CO3生成黄钾铁矾的离子方程式为___________ 。
② 若加入Na2CO3过多,将导致产品的产率下降,其原因是___________ 。
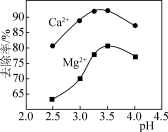
(3)氟化过程中溶液pH与钙镁去除率关系如图所示。当2.5 < pH < 4.0时,溶液pH过高或过低,Ca2+、Mg2+去除率都会下降,其原因是___________ 。
(4)共沉淀前,需测定溶液中锰元素含量。准确量取1.00 mL氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液振荡;将溶液加热至80℃,加入3 g (NH4)2S2O8充分反应后,再将溶液煮沸;冷却后,用0.0700 mol/L的(NH4)2Fe(SO4)2标准液滴定至终点,平行滴定3次,平均消耗(NH4)2Fe(SO4)2溶液32.60 mL。计算氟化后溶液中Mn2+物质的量浓度(写出计算过程)_________ 。

已知:① 25℃时,Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10;酸性较弱时,MgF2、CaF2均易形成[MFn]2-n配离子(M代表金属元素);
②在Ag+催化可发生反应2Mn2++5S2O
 +8H2O = 2MnO
+8H2O = 2MnO +10SO
+10SO +16H+;
+16H+;③ (NH4)2S2O8在煮沸时易分解。
(1)酸浸过程中含锰物质被溶液中的FeSO4还原为Mn2+,其中MnO2参与反应的离子方程式为
(2)氧化时加入H2O2将Ti3+、Fe2+氧化,再加入Na2CO3调节溶液pH为1~2,生成偏钛酸(H2TiO3)和黄钾铁矾[K2Fe6(SO4)4(OH)12]沉淀,使得钛、钾得以脱除。
① 加入Na2CO3生成黄钾铁矾的离子方程式为
② 若加入Na2CO3过多,将导致产品的产率下降,其原因是

(3)氟化过程中溶液pH与钙镁去除率关系如图所示。当2.5 < pH < 4.0时,溶液pH过高或过低,Ca2+、Mg2+去除率都会下降,其原因是
(4)共沉淀前,需测定溶液中锰元素含量。准确量取1.00 mL氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液振荡;将溶液加热至80℃,加入3 g (NH4)2S2O8充分反应后,再将溶液煮沸;冷却后,用0.0700 mol/L的(NH4)2Fe(SO4)2标准液滴定至终点,平行滴定3次,平均消耗(NH4)2Fe(SO4)2溶液32.60 mL。计算氟化后溶液中Mn2+物质的量浓度(写出计算过程)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某小组设计实验测定可逆反应 的平衡常数并探究影响化学平衡移动的因素。
的平衡常数并探究影响化学平衡移动的因素。
已知:常温下,反应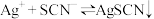 (白色)和
(白色)和 (红色)的平衡常数分别为
(红色)的平衡常数分别为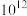 、
、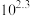 。
。
Ⅰ.配制溶液
(1)用绿矾 配制
配制 ,为防止配制过程中
,为防止配制过程中 变质,常加入少量的
变质,常加入少量的_______ 和_______ (填试剂名称)。
Ⅱ.测定 的平衡常数
的平衡常数
常温下,将 溶液和
溶液和 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
(2)用 溶液滴定测定滤液
溶液滴定测定滤液 中
中 浓度。
浓度。
①量取滤液X。用_______ (填“酸式”或“碱式”)滴定管取一定体积滤液X于锥形瓶中,若滴定管未用滤液 润洗,对
润洗,对 浓度测定结果是
浓度测定结果是_______ (填“偏高”、“偏低”或“无影响”)。
②用 溶液滴定滤液中
溶液滴定滤液中 。滴定终点的现象为:当最后半滴
。滴定终点的现象为:当最后半滴 溶液滴入后,
溶液滴入后,_______ ,此时为滴定终点。重复三次实验,实验数据如下表所示。根据表中数据计算出的滤液 中
中 的平均浓度是
的平均浓度是_______  (用含
(用含 的计算式表示)。
的计算式表示)。
(3)计算 。若测得滤液
。若测得滤液 中
中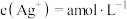 ,则该反应的平衡常数
,则该反应的平衡常数
_______ 。(用含 的计算式表示)
的计算式表示)
Ⅲ.探究稀释对该反应平衡移动方向的影响
常温下,用 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。
(4)①
_______ ,
_______ 。
②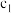 和
和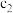 存在的关系是
存在的关系是_______ (用含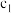 和
和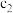 的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
 的平衡常数并探究影响化学平衡移动的因素。
的平衡常数并探究影响化学平衡移动的因素。已知:常温下,反应
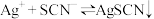 (白色)和
(白色)和 (红色)的平衡常数分别为
(红色)的平衡常数分别为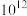 、
、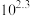 。
。Ⅰ.配制溶液
(1)用绿矾
 配制
配制 ,为防止配制过程中
,为防止配制过程中 变质,常加入少量的
变质,常加入少量的Ⅱ.测定
 的平衡常数
的平衡常数
常温下,将
 溶液和
溶液和 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。(2)用
 溶液滴定测定滤液
溶液滴定测定滤液 中
中 浓度。
浓度。①量取滤液X。用
 润洗,对
润洗,对 浓度测定结果是
浓度测定结果是②用
 溶液滴定滤液中
溶液滴定滤液中 。滴定终点的现象为:当最后半滴
。滴定终点的现象为:当最后半滴 溶液滴入后,
溶液滴入后, 中
中 的平均浓度是
的平均浓度是 (用含
(用含 的计算式表示)。
的计算式表示)。实验编号 | 滤液 | 滴定前 | 滴定后 |
1 | 10.00 | 3.10 | 23.06 |
2 | 10.00 | 0.50 | 20.50 |
3 | 10.00 | 2.36 | 22.40 |
 。若测得滤液
。若测得滤液 中
中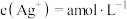 ,则该反应的平衡常数
,则该反应的平衡常数
 的计算式表示)
的计算式表示)Ⅲ.探究稀释对该反应平衡移动方向的影响
常温下,用
 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。实验编号 |
|
|
|
|
ⅰ | 10 | 10 | 0 |
|
ⅱ | 4 |
|
|
|


②
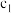 和
和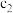 存在的关系是
存在的关系是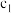 和
和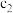 的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】金属镁可用于制造合金、储氢材料、镁电池等。
已知: C(s)+ O2(g)=CO(g) △H=-110.5kJ/mol;
O2(g)=CO(g) △H=-110.5kJ/mol;
Mg(g)+ O2(g)=MgO(s) △H=-732.7kJ/mol。
O2(g)=MgO(s) △H=-732.7kJ/mol。
(1)一种制备镁的反应为MgO(s)+C(s)=Mg(g)+CO(g),该反应的△H=____________ 。
(2)一种用水氯镁石(主要成分为MgC12·6H2O) 制备金属镁工艺的关键流程如下:
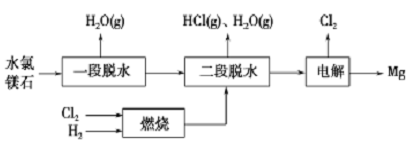
①为探究MgCl2·6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2·H2O在不同温度下分解,测得残留固体物质的X-射线衔射谱图如下图所示(X-射线衔射可用于判断某晶态物质是否存在)。
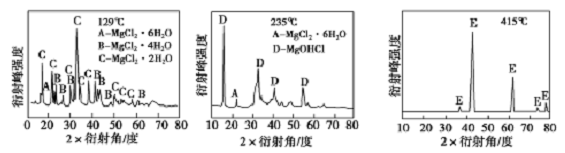
测得E中Mg元素质量分数为60.0%,则E 的化学式为_____ 。“一段脱水”的目的是制备MgC12·2H2O,温度不高于180℃的原因是_______________ 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为_________________ 。
③该工艺中,可以循环使用的物质有_______________ 。
(3)Mg2Ni是一种储氢材料。2.14gMg2Ni在一定条件下能吸收0.896LH2 (标准状况下)生成X,X的化学式为______________ 。
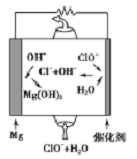
(4)“镁—次氯酸盐”燃料电池的装置如图所示,该电池反应的总反应方程式为__________ 。
已知: C(s)+
 O2(g)=CO(g) △H=-110.5kJ/mol;
O2(g)=CO(g) △H=-110.5kJ/mol;Mg(g)+
 O2(g)=MgO(s) △H=-732.7kJ/mol。
O2(g)=MgO(s) △H=-732.7kJ/mol。(1)一种制备镁的反应为MgO(s)+C(s)=Mg(g)+CO(g),该反应的△H=
(2)一种用水氯镁石(主要成分为MgC12·6H2O) 制备金属镁工艺的关键流程如下:

①为探究MgCl2·6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2·H2O在不同温度下分解,测得残留固体物质的X-射线衔射谱图如下图所示(X-射线衔射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E 的化学式为
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为
③该工艺中,可以循环使用的物质有
(3)Mg2Ni是一种储氢材料。2.14gMg2Ni在一定条件下能吸收0.896LH2 (标准状况下)生成X,X的化学式为
(4)“镁—次氯酸盐”燃料电池的装置如图所示,该电池反应的总反应方程式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】孔雀石的主要成分为Cu2(OH)2CO3,还含少量的FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:
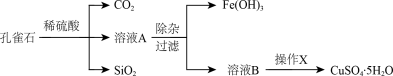
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如右表。请回答:
(1)溶液A中的金属阳离子有________ ;若调pH=9.0将杂质铁元素除去,其后果是:___________ 。
(2)“除杂”时先加入足量H2O2,目的是_______________ ;再加入CuO固体调节溶液pH的范围至________ ,其中加入CuO作用是_________________ 。
(3)操作X包括__________ 、________ 、过滤和洗涤等;在进行该操作时,将溶液B再适当酸化目的是_________________________ 。

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如右表。请回答:
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
(1)溶液A中的金属阳离子有
(2)“除杂”时先加入足量H2O2,目的是
(3)操作X包括
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的过程如图:
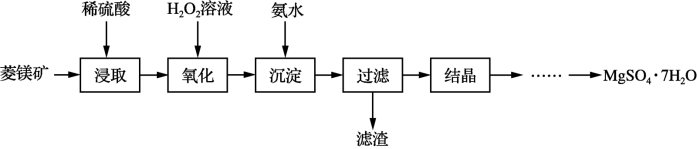
回答下列问题:
(1)为提高硫酸“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有___ (写出两条)。
(2)MgCO3溶于稀硫酸的离子方程式是___ 。
(3)“氧化”步骤中,加入H2O2溶液的目的是____ (用离子方程式表示)。
(4)部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
“沉淀”除杂步骤中,用氨水调节溶液pH的范围是___ 。
(5)“过滤”所得滤液中含有的阳离子是___ 。

回答下列问题:
(1)为提高硫酸“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有
(2)MgCO3溶于稀硫酸的离子方程式是
(3)“氧化”步骤中,加入H2O2溶液的目的是
(4)部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 阳离子 | Mg2+ | Fe2+ | Fe3+ |
| 开始沉淀 | 9.1 | 7.6 | 1.9 |
| 完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”除杂步骤中,用氨水调节溶液pH的范围是
(5)“过滤”所得滤液中含有的阳离子是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】为探究矿石样品A(仅含两种元素)的组成和性质,设计并完成如下实验:
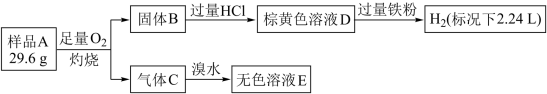
已知溶液D中只含一种金属阳离子,与铁粉充分反应后固体质量减少14 g。
请回答:
(1)样品A的化学式为________________ 。
(2)写出气体c与溴水反应的离子方程式___________________ 。
(3)写出样品A与盐酸发生氧化还原反应的化学方程式____________________ 。

已知溶液D中只含一种金属阳离子,与铁粉充分反应后固体质量减少14 g。
请回答:
(1)样品A的化学式为
(2)写出气体c与溴水反应的离子方程式
(3)写出样品A与盐酸发生氧化还原反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】标准的镁铝合金中镁、铝的含量各约为 。活性铝含量的多少对烟花的安全生产和产品的质量有很大的影响。某实验小组为检测某品牌的镁铝合金(不含其他元素)中铝的质量分数,将一定量镁铝合金与足量试剂X反应,并设计了下列实验方案进行探究。请填写下列空白:
。活性铝含量的多少对烟花的安全生产和产品的质量有很大的影响。某实验小组为检测某品牌的镁铝合金(不含其他元素)中铝的质量分数,将一定量镁铝合金与足量试剂X反应,并设计了下列实验方案进行探究。请填写下列空白:
(1)甲组同学们拟选用下列实验装置完成实验:

你认为最简易的装置连接顺序是___________ ;连接好装置首先应进行的操作是___________ 。滴加过量的试剂X时,发现始终有部分金属未溶解,则该组同学使用的试剂X可能为___________ (填化学式),发生反应的离子方程式为___________ 。
(2)为减少实验误差,乙组同学们设计组装了如图所示的实验装置。
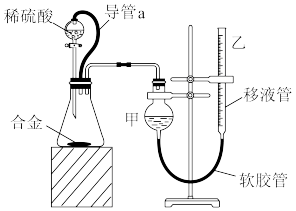
①装置中导管a的作用是___________ 。
②已知金属与酸的反应是放热反应,为了较准确测量常温常压下氢气的体积,在金属完全溶解后,读取氢气体积的正确操作为___________ 。
③若实验所用镁铝合金的质量为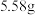 ,测得氢气体积为
,测得氢气体积为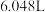 (已转换成标准状况),则合金中铝的质量分数为
(已转换成标准状况),则合金中铝的质量分数为___________ (保留三位有效数字)。
 。活性铝含量的多少对烟花的安全生产和产品的质量有很大的影响。某实验小组为检测某品牌的镁铝合金(不含其他元素)中铝的质量分数,将一定量镁铝合金与足量试剂X反应,并设计了下列实验方案进行探究。请填写下列空白:
。活性铝含量的多少对烟花的安全生产和产品的质量有很大的影响。某实验小组为检测某品牌的镁铝合金(不含其他元素)中铝的质量分数,将一定量镁铝合金与足量试剂X反应,并设计了下列实验方案进行探究。请填写下列空白:(1)甲组同学们拟选用下列实验装置完成实验:

你认为最简易的装置连接顺序是
(2)为减少实验误差,乙组同学们设计组装了如图所示的实验装置。

①装置中导管a的作用是
②已知金属与酸的反应是放热反应,为了较准确测量常温常压下氢气的体积,在金属完全溶解后,读取氢气体积的正确操作为
③若实验所用镁铝合金的质量为
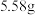 ,测得氢气体积为
,测得氢气体积为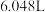 (已转换成标准状况),则合金中铝的质量分数为
(已转换成标准状况),则合金中铝的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;
②Fe(SCN) +3C2O
+3C2O =Fe(C2O4)
=Fe(C2O4) +6SCN-。
+6SCN-。
回答下列问题:
(1)甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为___________ (填“正确”或“不正确”),理由是___________ 。
(2)乙同学为测定草酸亚铁晶体FeC2O4·xH2O中的结晶水含量,利用如下装置:

①做实验前首先要:___________ 。
②称取一定质量的晶体,装好药品,开始实验。接下来的实验步骤依次为___________ ,重复实验直至B中恒重。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入氮气 e.冷却至室温 f.称量
(3)丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取ag草酸亚铁晶体溶于稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用cmol·L-1的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
①写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式:___________ 。
②上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有___________ 。
③x=___________ 。
④若实验中滴入KMnO4溶液过多,则所得x值___________ (填“偏大”“偏小”或“无影响”)。
已知:①草酸亚铁不溶于水,可溶于酸;
②Fe(SCN)
 +3C2O
+3C2O =Fe(C2O4)
=Fe(C2O4) +6SCN-。
+6SCN-。回答下列问题:
(1)甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为
(2)乙同学为测定草酸亚铁晶体FeC2O4·xH2O中的结晶水含量,利用如下装置:

①做实验前首先要:
②称取一定质量的晶体,装好药品,开始实验。接下来的实验步骤依次为
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入氮气 e.冷却至室温 f.称量
(3)丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取ag草酸亚铁晶体溶于稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用cmol·L-1的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
①写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式:
②上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有
③x=
④若实验中滴入KMnO4溶液过多,则所得x值
您最近一年使用:0次