氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)金属氢化物是一类常用的储氢剂。氢化钠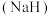 的晶体类型为
的晶体类型为___________ , 与
与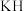 相比,熔点更高的是
相比,熔点更高的是___________ 。
(2)钛系贮氢合金中的钛锰合金,吸氢量更大,室温下易活化,基态锰原子的价层电子排布式为___________ 。与锰同周期且价层电子数相同的元素基态原子的价电子排布图为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度
(氨硼烷)具有很高的储氢容量及相对低的放氢温度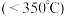 而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成。
进行合成。
①与 同周期元素中,第一电离能大于
同周期元素中,第一电离能大于 的元素有
的元素有___________ 种(填数字)。
②氨硼烷中的共价键可以分为两种,这两种共价键的数量比为___________ 。
③氨硼烷中的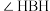
___________ (填“ ”、“
”、“ ”或“
”或“ ”)
”) 中的
中的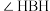 ,理由是
,理由是___________ 。
(4)咔唑(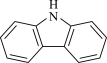 )是一种新型有机液体储氢材料,
)是一种新型有机液体储氢材料, 咔唑中含有的
咔唑中含有的 键的数目为
键的数目为___________ (设阿伏加德罗常数的值为 )。已知咔唑分子中
)。已知咔唑分子中 原子连接的
原子连接的 与两个苯环共平面,则分子中
与两个苯环共平面,则分子中 原子的杂化类型是
原子的杂化类型是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示,该晶体储氢时, 分子在晶胞的体心和棱心位置。
分子在晶胞的体心和棱心位置。 原子最近的
原子最近的 分子个数是
分子个数是___________ 。
②该晶体未储氢时的密度为 ,则铁原子的半径为
,则铁原子的半径为___________  。
。
(用含 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 ,假设晶胞中邻近的铁原子相切)
,假设晶胞中邻近的铁原子相切)
(1)金属氢化物是一类常用的储氢剂。氢化钠
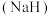 的晶体类型为
的晶体类型为 与
与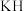 相比,熔点更高的是
相比,熔点更高的是(2)钛系贮氢合金中的钛锰合金,吸氢量更大,室温下易活化,基态锰原子的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度
(氨硼烷)具有很高的储氢容量及相对低的放氢温度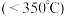 而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成。
进行合成。①与
 同周期元素中,第一电离能大于
同周期元素中,第一电离能大于 的元素有
的元素有②氨硼烷中的共价键可以分为两种,这两种共价键的数量比为
③氨硼烷中的
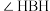
 ”、“
”、“ ”或“
”或“ ”)
”) 中的
中的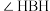 ,理由是
,理由是(4)咔唑(
 )是一种新型有机液体储氢材料,
)是一种新型有机液体储氢材料, 咔唑中含有的
咔唑中含有的 键的数目为
键的数目为 )。已知咔唑分子中
)。已知咔唑分子中 原子连接的
原子连接的 与两个苯环共平面,则分子中
与两个苯环共平面,则分子中 原子的杂化类型是
原子的杂化类型是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示,该晶体储氢时,
 分子在晶胞的体心和棱心位置。
分子在晶胞的体心和棱心位置。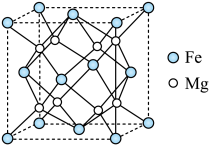
 原子最近的
原子最近的 分子个数是
分子个数是②该晶体未储氢时的密度为
 ,则铁原子的半径为
,则铁原子的半径为 。
。(用含
 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 ,假设晶胞中邻近的铁原子相切)
,假设晶胞中邻近的铁原子相切)
更新时间:2024-05-25 12:43:39
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】(1)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
② 的最高能层电子排布式为
的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A. B.
B.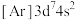 C.
C. D.
D.
(2)二氯甲醛的结构简式为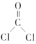 ,已知单键和双键的键角为
,已知单键和双键的键角为 ,单键和单键的键角为
,单键和单键的键角为 ,原因是
,原因是___________ 。
(3)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(4)化学上有一种见解,认为含氧酸的通式可以写成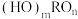 ,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出
,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出 ,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(5)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。
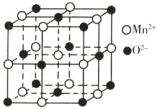
①该晶胞中由 形成的正八面体的空隙数为
形成的正八面体的空隙数为______
②晶胞中距离最近的两个 之间的距离为a pm,MnO晶体的密度为
之间的距离为a pm,MnO晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (用含a和 的代数式表示)。
的代数式表示)。

①配合物中每个中心离子的配位数为
②
 的最高能层电子排布式为
的最高能层电子排布式为③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.
 B.
B.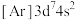 C.
C. D.
D.
(2)二氯甲醛的结构简式为
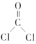 ,已知单键和双键的键角为
,已知单键和双键的键角为 ,单键和单键的键角为
,单键和单键的键角为 ,原因是
,原因是(3)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(4)化学上有一种见解,认为含氧酸的通式可以写成
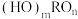 ,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出
,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出 ,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱(5)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

①该晶胞中由
 形成的正八面体的空隙数为
形成的正八面体的空隙数为②晶胞中距离最近的两个
 之间的距离为a pm,MnO晶体的密度为
之间的距离为a pm,MnO晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】铋及其化合物在工业生产中用途广泛,如氯氧化铋(BiOCl)常用作电子设备、塑料助剂等。以下是一种用铋精矿( ,含有
,含有 、
、 、
、 及不溶性杂质)制备BiOCl的一种方法,其流程如图:
及不溶性杂质)制备BiOCl的一种方法,其流程如图:
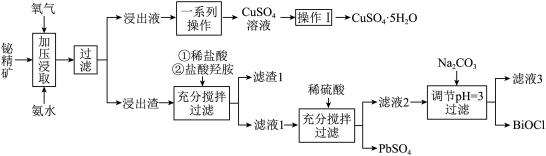
已知:① 开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7
开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7
②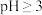 时,
时, 极易水解为BiOCl沉淀。
极易水解为BiOCl沉淀。
I.请回答以下问题:
(1)“加压浸取”过程中, 转化为
转化为 ,
, 转化为
转化为 ,而
,而 溶解进入浸出液,且硫元素转化为
溶解进入浸出液,且硫元素转化为 ,请写出
,请写出 在此过程中发生反应的离子方程式:
在此过程中发生反应的离子方程式:_______ 。
(2)“操作I”为_______ 、过滤、洗涤、干燥。
(3)根据流程分析,盐酸羟胺 在流程中的作用是:
在流程中的作用是:
①将铅元素从+4价还原为+2价,便于后续“沉铅”
②_______ 。
(4)流程中生成BiOCl的离子方程式:_______ 。
II.锗(Ge)、铅(Pb)都是IVA族元素
(5)基态Ge原子有_______ 个未成对电子,Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______ 晶胞的原子坐标参数,表示晶胞内部各原子的相对位置,图为Ge单晶的晶胞,其中原子坐标参数A为 ;B为
;B为 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为_______ 。

(6)复杂氧化物可改写成氧化物或盐的形式,如 可改写为
可改写为 或
或 ,请将
,请将 分别改写成氧化物和盐的形式
分别改写成氧化物和盐的形式_______ 。
 ,含有
,含有 、
、 、
、 及不溶性杂质)制备BiOCl的一种方法,其流程如图:
及不溶性杂质)制备BiOCl的一种方法,其流程如图:
已知:①
 开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7
开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7②
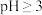 时,
时, 极易水解为BiOCl沉淀。
极易水解为BiOCl沉淀。I.请回答以下问题:
(1)“加压浸取”过程中,
 转化为
转化为 ,
, 转化为
转化为 ,而
,而 溶解进入浸出液,且硫元素转化为
溶解进入浸出液,且硫元素转化为 ,请写出
,请写出 在此过程中发生反应的离子方程式:
在此过程中发生反应的离子方程式:(2)“操作I”为
(3)根据流程分析,盐酸羟胺
 在流程中的作用是:
在流程中的作用是:①将铅元素从+4价还原为+2价,便于后续“沉铅”
②
(4)流程中生成BiOCl的离子方程式:
II.锗(Ge)、铅(Pb)都是IVA族元素
(5)基态Ge原子有
 ;B为
;B为 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为
(6)复杂氧化物可改写成氧化物或盐的形式,如
 可改写为
可改写为 或
或 ,请将
,请将 分别改写成氧化物和盐的形式
分别改写成氧化物和盐的形式
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】I.(1)基态铁原子的价电子排布式为_____ 。
(2) 、
、 未成对电子数之比是
未成对电子数之比是_____ 。
(3)金属铁晶体的常见结构为体心立方密堆积(如图),实验测得铁的密度为 。已知铁的相对原子质量为a,阿伏加德罗常数为
。已知铁的相对原子质量为a,阿伏加德罗常数为 ,假定金属铁原子为等径的刚性球且处于体对角线上的三个球相切。则铁原子的半径
,假定金属铁原子为等径的刚性球且处于体对角线上的三个球相切。则铁原子的半径 为
为___ 。

A.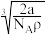 B.
B.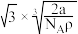 C.
C. D.
D.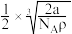
II.图1是 的晶体结构中阴、阳离子可以被看成是不等径的刚性圆球,并彼此相切,
的晶体结构中阴、阳离子可以被看成是不等径的刚性圆球,并彼此相切, 、
、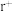 分别为阴阳离子半径,如图1、图2、图3所示:
分别为阴阳离子半径,如图1、图2、图3所示:

(1)每个 周围最近且等距离的
周围最近且等距离的 有
有___ 个。
(2) 半径与
半径与 半径之比
半径之比
___ (已知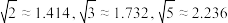 )。
)。
(3)已知氯化钠的摩尔质量为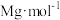 ,晶体的密度为
,晶体的密度为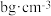 ,写出阿伏加德罗常数的值(NA)表达式
,写出阿伏加德罗常数的值(NA)表达式__ 。
III.金刚石的立体结构和晶胞结构如图所示:

(1)在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接____ 个六元环。
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共实际有8个原子,其中在面心位置贡献___ 个原子。
(3)立方氮化硼晶体的结构与金刚石相似,晶胞的顶点、面心为B原子,晶胞的内部为N原子,其硬度与金刚石相当,晶胞边长为apm。立方氮化硼的密度是___  (列出式子,阿伏加德罗常数为
(列出式子,阿伏加德罗常数为 )。
)。
(2)
 、
、 未成对电子数之比是
未成对电子数之比是(3)金属铁晶体的常见结构为体心立方密堆积(如图),实验测得铁的密度为
 。已知铁的相对原子质量为a,阿伏加德罗常数为
。已知铁的相对原子质量为a,阿伏加德罗常数为 ,假定金属铁原子为等径的刚性球且处于体对角线上的三个球相切。则铁原子的半径
,假定金属铁原子为等径的刚性球且处于体对角线上的三个球相切。则铁原子的半径 为
为
A.
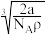 B.
B.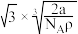 C.
C. D.
D.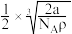
II.图1是
 的晶体结构中阴、阳离子可以被看成是不等径的刚性圆球,并彼此相切,
的晶体结构中阴、阳离子可以被看成是不等径的刚性圆球,并彼此相切, 、
、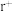 分别为阴阳离子半径,如图1、图2、图3所示:
分别为阴阳离子半径,如图1、图2、图3所示:
(1)每个
 周围最近且等距离的
周围最近且等距离的 有
有(2)
 半径与
半径与 半径之比
半径之比
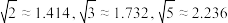 )。
)。(3)已知氯化钠的摩尔质量为
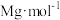 ,晶体的密度为
,晶体的密度为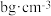 ,写出阿伏加德罗常数的值(NA)表达式
,写出阿伏加德罗常数的值(NA)表达式III.金刚石的立体结构和晶胞结构如图所示:

(1)在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共实际有8个原子,其中在面心位置贡献
(3)立方氮化硼晶体的结构与金刚石相似,晶胞的顶点、面心为B原子,晶胞的内部为N原子,其硬度与金刚石相当,晶胞边长为apm。立方氮化硼的密度是
 (列出式子,阿伏加德罗常数为
(列出式子,阿伏加德罗常数为 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】嫦娥五号从月球采回的沙土中含有丰富的钛铁矿,还含有硅、铝、钾、锌、铜和稀土元素等。
(1)三价铁离子可以形成多种配位化合物。
① 电子排布式为
电子排布式为___________ 。
②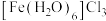 配体为
配体为___________ ;配体分子属于___________ 分子(填“极性”或“非极性”)。
③向 溶液中滴加
溶液中滴加 溶液,溶液变红色,继续滴加
溶液,溶液变红色,继续滴加 溶液,生成
溶液,生成 ,红色消失,由此可知离子稳定性:
,红色消失,由此可知离子稳定性:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)金属Ti的熔点比K高很多的原因为___________ 。
(3)锌与氮、镍形成的化合物,具备优越的催化活性,晶胞结构如图所示。
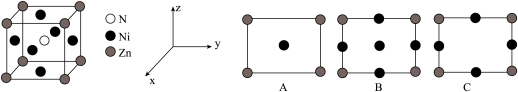
①与Zn原子距离最近且相等的Ni原子有___________ 个。
②该晶体沿z轴的投影图为___________ (填字母);晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)三价铁离子可以形成多种配位化合物。
①
 电子排布式为
电子排布式为②
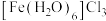 配体为
配体为③向
 溶液中滴加
溶液中滴加 溶液,溶液变红色,继续滴加
溶液,溶液变红色,继续滴加 溶液,生成
溶液,生成 ,红色消失,由此可知离子稳定性:
,红色消失,由此可知离子稳定性:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)金属Ti的熔点比K高很多的原因为
(3)锌与氮、镍形成的化合物,具备优越的催化活性,晶胞结构如图所示。

①与Zn原子距离最近且相等的Ni原子有
②该晶体沿z轴的投影图为
 ,该晶胞的密度为
,该晶胞的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
【推荐2】铋酸钠( )是一种可测定锰的强氧化剂。由辉铋矿(主要成分为
)是一种可测定锰的强氧化剂。由辉铋矿(主要成分为 ,含
,含 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
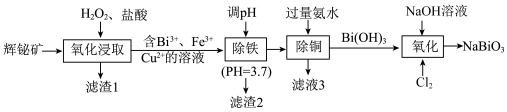
已知:① 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。
②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的 如表:
如表:
回答下列问题:
(1)基态 的
的 电子轨道表示式为
电子轨道表示式为____________ 。“滤渣1”的主要成分为_____________ (填化学式)。
(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是____________ , 发生反应的化学方程式为
发生反应的化学方程式为____________ 。
(3)已知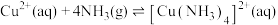 ,
, 中配体的空间结构为
中配体的空间结构为_____________ ,键角:
______  (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是_____________ 。
(4)“氧化”过程发生反应的离子方程式为____________ 。
(5)取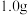 制得的
制得的 产品,加入足量稀硫酸和
产品,加入足量稀硫酸和 稀溶液,发生反应:
稀溶液,发生反应: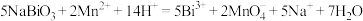 ,完全反应后再用
,完全反应后再用 的
的 标准溶液滴定生成的
标准溶液滴定生成的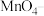 ,当溶液紫红色恰好褪去时,消耗
,当溶液紫红色恰好褪去时,消耗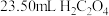 标准溶液,则产品的纯度为
标准溶液,则产品的纯度为___________________ %。
(6)我国科学家对新型二维半导体芯片材料——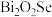 的研究取得了突破性进展。
的研究取得了突破性进展。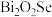 的晶胞结构中
的晶胞结构中 的位置如图所示(略去
的位置如图所示(略去 、
、 ),已知晶胞为竖直的长方体,高为
),已知晶胞为竖直的长方体,高为 ,晶体密度为
,晶体密度为 。设
。设 为阿伏加德罗常数的值,则晶胞底边边长
为阿伏加德罗常数的值,则晶胞底边边长
_______________ (填含 、
、 、
、 的计算式,不必化简)。
的计算式,不必化简)。

 )是一种可测定锰的强氧化剂。由辉铋矿(主要成分为
)是一种可测定锰的强氧化剂。由辉铋矿(主要成分为 ,含
,含 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
已知:①
 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的
 如表:
如表:| 金属离子 |  |  |  |  |
开始沉淀的 | 7.6 | 2.7 | 4.8 | 4.5 |
沉淀完全的 | 9.6 | 3.7 | 6.4 | 5.5 |
(1)基态
 的
的 电子轨道表示式为
电子轨道表示式为(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是
 发生反应的化学方程式为
发生反应的化学方程式为(3)已知
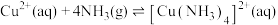 ,
, 中配体的空间结构为
中配体的空间结构为
 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是(4)“氧化”过程发生反应的离子方程式为
(5)取
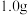 制得的
制得的 产品,加入足量稀硫酸和
产品,加入足量稀硫酸和 稀溶液,发生反应:
稀溶液,发生反应: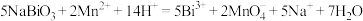 ,完全反应后再用
,完全反应后再用 的
的 标准溶液滴定生成的
标准溶液滴定生成的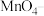 ,当溶液紫红色恰好褪去时,消耗
,当溶液紫红色恰好褪去时,消耗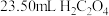 标准溶液,则产品的纯度为
标准溶液,则产品的纯度为(6)我国科学家对新型二维半导体芯片材料——
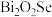 的研究取得了突破性进展。
的研究取得了突破性进展。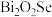 的晶胞结构中
的晶胞结构中 的位置如图所示(略去
的位置如图所示(略去 、
、 ),已知晶胞为竖直的长方体,高为
),已知晶胞为竖直的长方体,高为 ,晶体密度为
,晶体密度为 。设
。设 为阿伏加德罗常数的值,则晶胞底边边长
为阿伏加德罗常数的值,则晶胞底边边长
 、
、 、
、 的计算式,不必化简)。
的计算式,不必化简)。
您最近一年使用:0次
【推荐3】 加氢合成甲醇对缓解能源危机、改变产业结构以及实现“碳达峰、碳中和”目标具有重要的战略意义。该合成工艺主要包括三个反应:
加氢合成甲醇对缓解能源危机、改变产业结构以及实现“碳达峰、碳中和”目标具有重要的战略意义。该合成工艺主要包括三个反应:
①
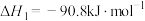
②

③

(1)已知一些物质的键能数据如下:
计算
___________ 。
(2)按照一定比例投料,测定 的平衡转化率和CO的平衡选择性随温度和压强的变化关系如下图所示。
的平衡转化率和CO的平衡选择性随温度和压强的变化关系如下图所示。 、
、 、
、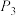 、
、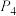 的大小关系为
的大小关系为___________ ;原因为___________ ; ℃以后不同压强下
℃以后不同压强下 平衡转化率变为一条曲线,原因为
平衡转化率变为一条曲线,原因为___________ (CO的选择性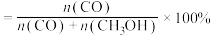 )。
)。 转化率的数据。
转化率的数据。
由上表数据推测,催化剂中Pd含量增大, 转化率增大的原因可能为
转化率增大的原因可能为___________ 。
(4)六方ZnO晶胞结构如下左图所示, 填充在
填充在 形成的
形成的___________ 空隙中,该晶体的密度为___________  (设
(设 表示阿伏加德罗常数的值,列出计算式),在下右图中补充画出ZnO晶胞的俯视投影图
表示阿伏加德罗常数的值,列出计算式),在下右图中补充画出ZnO晶胞的俯视投影图__________ 。
 加氢合成甲醇对缓解能源危机、改变产业结构以及实现“碳达峰、碳中和”目标具有重要的战略意义。该合成工艺主要包括三个反应:
加氢合成甲醇对缓解能源危机、改变产业结构以及实现“碳达峰、碳中和”目标具有重要的战略意义。该合成工艺主要包括三个反应:①

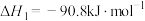
②


③


(1)已知一些物质的键能数据如下:
| 化学键 | H―H | C=O | C≡O | H―O |
E/( ) ) | 436 | 803 | 1076 | 463 |

(2)按照一定比例投料,测定
 的平衡转化率和CO的平衡选择性随温度和压强的变化关系如下图所示。
的平衡转化率和CO的平衡选择性随温度和压强的变化关系如下图所示。 、
、 、
、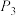 、
、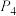 的大小关系为
的大小关系为 ℃以后不同压强下
℃以后不同压强下 平衡转化率变为一条曲线,原因为
平衡转化率变为一条曲线,原因为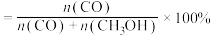 )。
)。
 转化率的数据。
转化率的数据。| 催化剂 | Pd/% | Zn/g | 表面O含量/% | 表面氧缺陷比例/% |  转化率/% 转化率/% |
| 0.02%Pd/ZnO/C-N | 0.04 | 9.47 | 12.43 | 0.29 | 3.7 |
| 0.05%Pd/ZnO/C-N | 0.13 | 6.4 | 9.57 | 0.30 | 6.6 |
| 0.1%Pd/ZnO/C-N | 0.18 | 10.6 | 13.25 | 0.32 | 68 |
| 0.3%Pd/ZnO/C-N | 0.58 | 9.66 | 12.52 | 0.38 | 71 |
 转化率增大的原因可能为
转化率增大的原因可能为(4)六方ZnO晶胞结构如下左图所示,
 填充在
填充在 形成的
形成的 (设
(设 表示阿伏加德罗常数的值,列出计算式),在下右图中补充画出ZnO晶胞的俯视投影图
表示阿伏加德罗常数的值,列出计算式),在下右图中补充画出ZnO晶胞的俯视投影图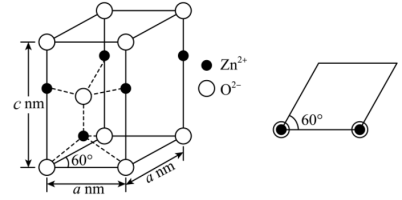
您最近一年使用:0次



