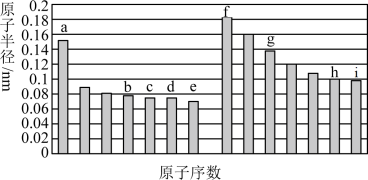
部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。 、
、 、
、 、
、 四种元素的最简单氢化物中,最稳定的是
四种元素的最简单氢化物中,最稳定的是________ (填化学式)。
(2) 与
与 能形成一种淡黄色的物质,其电子式为
能形成一种淡黄色的物质,其电子式为________ 。
(3) 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为________ 。
(4)由 的单质制成的电池需要注意防水,其原因为
的单质制成的电池需要注意防水,其原因为________ (用化学方程式表示)。
(5)门捷列卡在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为 的下一周期存在一种“类
的下一周期存在一种“类 ”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为________ 。预测 与
与 的最高价氧化物对应水化物的碱性较强的是
的最高价氧化物对应水化物的碱性较强的是________ (填最高价氧化物对应水化物的化学式)。
(6)使用下列装置再添加合适的药品,可以证明 和
和 两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液________ 、丁________ 。
 、
、 、
、 、
、 四种元素的最简单氢化物中,最稳定的是
四种元素的最简单氢化物中,最稳定的是(2)
 与
与 能形成一种淡黄色的物质,其电子式为
能形成一种淡黄色的物质,其电子式为(3)
 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为(4)由
 的单质制成的电池需要注意防水,其原因为
的单质制成的电池需要注意防水,其原因为(5)门捷列卡在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为
 的下一周期存在一种“类
的下一周期存在一种“类 ”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为 与
与 的最高价氧化物对应水化物的碱性较强的是
的最高价氧化物对应水化物的碱性较强的是(6)使用下列装置再添加合适的药品,可以证明
 和
和 两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液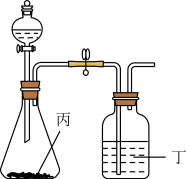
更新时间:2024-05-24 16:51:17
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
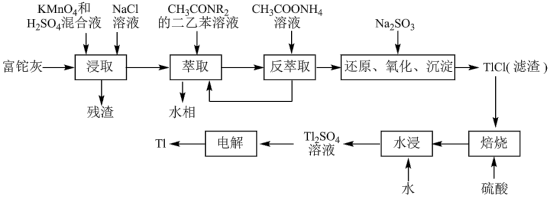
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4;PbSO4是一种难溶性的物质。
[CH3CONR2H]TlCl4;PbSO4是一种难溶性的物质。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示,石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H++CH3CONR2+TlCl

 [CH3CONR2H]TlCl4;PbSO4是一种难溶性的物质。
[CH3CONR2H]TlCl4;PbSO4是一种难溶性的物质。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)用平衡移动解释“反萃取”过程的原理和目的
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示,石墨(C)上电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
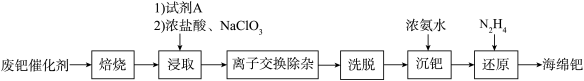
【推荐2】钯(Pd)是一种贵金属,性质类似铂(Pt)。活性炭载钯催化剂广泛应用于石油化工、制药等工业,但使用过程中因生成难溶于酸的PdO而失活。一种从废钯催化剂(杂质主要含有机物、活性炭、及少量Fe、Cu、Al等元素)中回收海绵钯的工艺流程如图:
已知:I.阴、阳离子交换树脂的基本工作原理分别为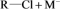

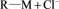 、
、

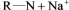 (
( 表示树脂的有机成分)。
表示树脂的有机成分)。
Ⅱ.“沉钯”时得到氯钯酸铵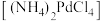 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。
(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为___________ 。
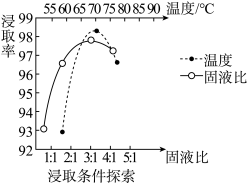
(2)“浸取”时,加入试剂A的目的为___________ 。
(3)“浸取”时,加入 有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(
有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸( )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:___________ 。
(4)“离子交换除杂”应使用阴离子树脂,“洗脱”时应使用的洗脱液为___________ (填标号)。
A.硫酸 B.盐酸 C.无水乙醇
(5)“还原”过程 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为___________ ,且该产物可循环利用至___________ 环节(填环节名称)。
(6)以上流程污染性较强且复杂,通常适用电解法回收钯。将“浸取”后的溶液与钯离子脱附试剂MH混合,形成 配离子,电解可得高纯度钯,装置如图。
配离子,电解可得高纯度钯,装置如图。

电解时,当浓缩室里共得到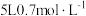 的较浓盐酸时(体积变化忽略不计),理论上能得到Pd159g,但实际生产中得不到相应质量的Pd,原因是
的较浓盐酸时(体积变化忽略不计),理论上能得到Pd159g,但实际生产中得不到相应质量的Pd,原因是___________ 。

已知:I.阴、阳离子交换树脂的基本工作原理分别为
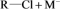

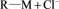 、
、

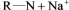 (
( 表示树脂的有机成分)。
表示树脂的有机成分)。Ⅱ.“沉钯”时得到氯钯酸铵
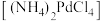 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为

(2)“浸取”时,加入试剂A的目的为
(3)“浸取”时,加入
 有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(
有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸( )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:(4)“离子交换除杂”应使用阴离子树脂,“洗脱”时应使用的洗脱液为
A.硫酸 B.盐酸 C.无水乙醇
(5)“还原”过程
 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为(6)以上流程污染性较强且复杂,通常适用电解法回收钯。将“浸取”后的溶液与钯离子脱附试剂MH混合,形成
 配离子,电解可得高纯度钯,装置如图。
配离子,电解可得高纯度钯,装置如图。
电解时,当浓缩室里共得到
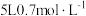 的较浓盐酸时(体积变化忽略不计),理论上能得到Pd159g,但实际生产中得不到相应质量的Pd,原因是
的较浓盐酸时(体积变化忽略不计),理论上能得到Pd159g,但实际生产中得不到相应质量的Pd,原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上以菱锰矿(主要成分为 ,还含少量的
,还含少量的 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备高纯度碳酸锰的工艺流程如下。
等杂质)为原料制备高纯度碳酸锰的工艺流程如下。

②常温下,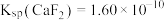 ,
, 。
。
回答下列问题:
(1)对菱锰矿预处理时需要粉碎,从反应速率角度分析其原因_______ 。
(2)在“浸出液”中加入“ ”的作用是
”的作用是_______ 。
(3)加入氨水调节溶液pH的范围_______ 。
(4)“滤渣1”“滤渣2”的主要成分_______ ,_______ 。
(5)加入 的目的是将
的目的是将 、
、 沉淀除去,常温下,当溶液中
沉淀除去,常温下,当溶液中 、
、 完全除去时
完全除去时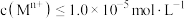 ,则
,则
_______  。
。
(6)“沉锰”:在30~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为_______ ;实验室可利用 溶液来检验
溶液来检验 是否反应完全:
是否反应完全:
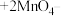 ,如何确定
,如何确定 已完全反应
已完全反应_______ 。
 ,还含少量的
,还含少量的 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备高纯度碳酸锰的工艺流程如下。
等杂质)为原料制备高纯度碳酸锰的工艺流程如下。
金属离子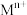 |  |  |  |  |  |
开始沉淀的pH[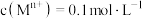 ] ] | 3.4 | 1.9 | 7.0 | 8.1 | 9.1 |
沉淀完全的pH[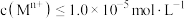 ] ] | 4.7 | 3.2 | 9.0 | 10.1 | 11.1 |
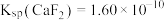 ,
, 。
。回答下列问题:
(1)对菱锰矿预处理时需要粉碎,从反应速率角度分析其原因
(2)在“浸出液”中加入“
 ”的作用是
”的作用是(3)加入氨水调节溶液pH的范围
(4)“滤渣1”“滤渣2”的主要成分
(5)加入
 的目的是将
的目的是将 、
、 沉淀除去,常温下,当溶液中
沉淀除去,常温下,当溶液中 、
、 完全除去时
完全除去时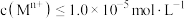 ,则
,则
 。
。(6)“沉锰”:在30~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到
 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为 溶液来检验
溶液来检验 是否反应完全:
是否反应完全:
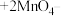 ,如何确定
,如何确定 已完全反应
已完全反应
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】短周期主族元素 、
、 、
、 、
、 、
、 的原子序数依次增大,且位于三个周期,
的原子序数依次增大,且位于三个周期, 是地壳中含量最多的元素,Z、
是地壳中含量最多的元素,Z、 是金属元素且形成的最高价氧化物对应的水化物可以发生反应,
是金属元素且形成的最高价氧化物对应的水化物可以发生反应, 是同周期中原子半径最小的元素。
是同周期中原子半径最小的元素。
回答下列问题:
(1) 在周期表中的位置是
在周期表中的位置是_________ , 的最简单氢化物的结构式为
的最简单氢化物的结构式为_________ 。
(2) 的最高价氧化物对应水化物的电子式为
的最高价氧化物对应水化物的电子式为_________ ; 、
、 、
、 的简单离子半径由大到小的顺序为
的简单离子半径由大到小的顺序为
___________________________ (用相应离子符号表示)。
(3)举例说明金属性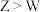 :
:____________________________________ ,写出 的最高价氧化物对应水化物与强碱反应的离子方程式:
的最高价氧化物对应水化物与强碱反应的离子方程式:____________________________________ 。
 、
、 、
、 、
、 、
、 的原子序数依次增大,且位于三个周期,
的原子序数依次增大,且位于三个周期, 是地壳中含量最多的元素,Z、
是地壳中含量最多的元素,Z、 是金属元素且形成的最高价氧化物对应的水化物可以发生反应,
是金属元素且形成的最高价氧化物对应的水化物可以发生反应, 是同周期中原子半径最小的元素。
是同周期中原子半径最小的元素。回答下列问题:
(1)
 在周期表中的位置是
在周期表中的位置是 的最简单氢化物的结构式为
的最简单氢化物的结构式为(2)
 的最高价氧化物对应水化物的电子式为
的最高价氧化物对应水化物的电子式为 、
、 、
、 的简单离子半径由大到小的顺序为
的简单离子半径由大到小的顺序为(3)举例说明金属性
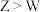 :
: 的最高价氧化物对应水化物与强碱反应的离子方程式:
的最高价氧化物对应水化物与强碱反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】如图是元素周期表的一部分,针对表中①~⑧元素,填写下列空白:
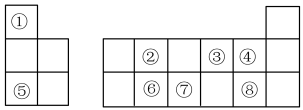
(1)②原子的结构示意图为_______ ,元素⑦在周期表中的位置为_______ 。
(2)图中8种元素最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式,下同),碱性最强的是_______ 。
(3)写出由①③元素构成的化合物对应的电子式:_______ (写一种即可)。用电子式表示⑤和⑧形成化合物的过程:_______ 。
(4)④、⑤和⑧三种元素的离子半径由大到小的顺序是_______ (用离子符号和“>”表示)。
(5)据元素周期律,推测⑥的最高价氧化物属于_______ (填“酸性”或“碱性”)氧化物,写出得出该结论的离子方程式:_______ 。

(1)②原子的结构示意图为
(2)图中8种元素最高价氧化物对应的水化物中,酸性最强的是
(3)写出由①③元素构成的化合物对应的电子式:
(4)④、⑤和⑧三种元素的离子半径由大到小的顺序是
(5)据元素周期律,推测⑥的最高价氧化物属于
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】如图是元素周期表中合并的短周期部分,表中字母分别表示一种元素。请回答下列问题:
(1)g元素在周期表中的位置是第 ___________ 。
(2)所给元素中c和d两种元素氢化物的稳定性更强的是___________ (填物质的化学式)。
(3)图中所给元素中d、e、f、g所对应的简单离子半径大小顺序为___________ (填离子符号)。
(4)图中所给元素中b、g、h最高氧化物对应水化物酸性大小顺序为___________ (填化学式)。
(5)用电子式表示a原子与g原子形成常见化合物的过程:___________ 。
| a | |||||||
| b | c | d | |||||
| e | f | g | h | k | |||
(2)所给元素中c和d两种元素氢化物的稳定性更强的是
(3)图中所给元素中d、e、f、g所对应的简单离子半径大小顺序为
(4)图中所给元素中b、g、h最高氧化物对应水化物酸性大小顺序为
(5)用电子式表示a原子与g原子形成常见化合物的过程:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)Q在元素周期表中的位置为__________________ 。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_______________ 。
(3)Y的气态氢化物能使湿润的红色石蕊试纸变蓝的原因:________________ (用离子方程式表示)。
(4)QM2的电子式为______________ 。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为______________ 。
(1)Q在元素周期表中的位置为
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)
(3)Y的气态氢化物能使湿润的红色石蕊试纸变蓝的原因:
(4)QM2的电子式为
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】1869年门捷列夫发表了第一张元素周期表,150多年里科学家根据元素间的规律创造了各式各样的元素周期表。以下为螺旋式元素周期表的部分结构,请根据表中信息回答下列相关问题。
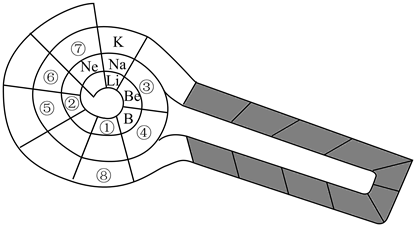
(1)元素①~⑧中,化学性质最不活泼的元素是__ (写元素符号),元素①的氢化物中具有正四面体结构的是__ (写化学式)。
(2)②与⑤组成的化合物属于__ (填“离子化合物”或“共价化合物”)。
(3)②、③、④的简单离子半径由大到小的顺序为__ (用离子符号表示)。
(4)③的单质能与①的最高价氧化物反应,生成①的单质,反应的化学方程式为__ 。
(5)门捷列夫在绘制元素周期表时,预言了一种当时未被发现的元素“类硅”,后来被德国化学家文克勒发现,并命名为“锗(Ge)”。图中①~⑧中,表示锗元素的是__ ,非金属性Si___ Ge(用“>”或“<”表示)。
(6)关于螺旋式元素周期表,下列说法不正确的是___ 。
a.元素⑧的原子结构示意图为
b.①~⑧所形成的最高价氧化物的水化物中,⑥的酸性最强
c.图中灰色部分为第四周期过渡金属区域
d.螺旋式元素周期表解决了矩形周期表中部分原子序数相邻元素间距离远的问题

(1)元素①~⑧中,化学性质最不活泼的元素是
(2)②与⑤组成的化合物属于
(3)②、③、④的简单离子半径由大到小的顺序为
(4)③的单质能与①的最高价氧化物反应,生成①的单质,反应的化学方程式为
(5)门捷列夫在绘制元素周期表时,预言了一种当时未被发现的元素“类硅”,后来被德国化学家文克勒发现,并命名为“锗(Ge)”。图中①~⑧中,表示锗元素的是
(6)关于螺旋式元素周期表,下列说法不正确的是
a.元素⑧的原子结构示意图为

b.①~⑧所形成的最高价氧化物的水化物中,⑥的酸性最强
c.图中灰色部分为第四周期过渡金属区域
d.螺旋式元素周期表解决了矩形周期表中部分原子序数相邻元素间距离远的问题
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于D的下一个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)A元素在周期表中的位置为________ 、E是________ (填元素名称)。
(2)D的单质分子的结构式_______ ,C元素最高价氧化物的水化物的电子式____ 。
(3)写出工业上冶炼B单质的化学方程式_______________ 。
(4)写出CD的溶液中通入氯气的离子方程式________________ 。
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性_________ 。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于D的下一个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)A元素在周期表中的位置为
(2)D的单质分子的结构式
(3)写出工业上冶炼B单质的化学方程式
(4)写出CD的溶液中通入氯气的离子方程式
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子层排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第ⅠA族元素。回答下列问题:
(1)写出第三周期基态原子未成对电子数与G相同且电负性最大的元素是___________ (填元素名称)。GQ受热分解生成G2Q和Q2,请从G的原子结构来说明GQ受热易分解的原因:_______ 。
(2)M元素的第一电离能在同周期主族元素中从大到小排第三位的原因是_____________ 。
(3)X与Q形成的化合物中沸点较高的物质的化学式为___________ 。
(4)Z、M、E所形成的简单离子的半径由大到小顺序为___________ (用离子符号表示)。
(5)X、Y、Z、Q的电负性由大到小的顺序为___________ (用元素符号表示)。
(1)写出第三周期基态原子未成对电子数与G相同且电负性最大的元素是
(2)M元素的第一电离能在同周期主族元素中从大到小排第三位的原因是
(3)X与Q形成的化合物中沸点较高的物质的化学式为
(4)Z、M、E所形成的简单离子的半径由大到小顺序为
(5)X、Y、Z、Q的电负性由大到小的顺序为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
回答下列问题:
(1)③的元素符号是_______________ ,⑧的元素名称是_______________ 。①在元素周期表中的位置是(周期、族)_____________ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是________________ ;名称是____________ ;碱性最强的化合物的电子式是:______________________________ ; 属___________ 化合物(填“离子”或“共价”)。
(3)比较④和⑦的氢化物的稳定性(用化学式表示)__________________________ 。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_______________________ 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:__________________ 。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
回答下列问题:
(1)③的元素符号是
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)比较④和⑦的氢化物的稳定性(用化学式表示)
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】X、T、Y、Z为1﹣36号元素,且原子序数依次增大,四种元素的性质或结构信息如表。请根据信息回答下列问题。
(1)写出元素T的离子结构示意图______________ ;写出元素X的气态氢化物的电子式__________ ;写出Z元素原子的外围电子排布式__________ ;元素Y的原子核外共有_______ 种形状不同的电子云。
(2)Y元素原子的第一电离能______ 镁(填“>”“<”“=”),从结构上分析,其理由是:__________________ 。
(3)元素T与氟元素相比,非金属性较强的是______ (用元素符号表示),下列表述中能证明这一事实的是_______ (填序号字母)。
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质结构信息 | 人体内含量最多的元素,且其单质是最常见的助燃剂。 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼。 | 第3周期元素的简单离子中半径最小。 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子。 |
(1)写出元素T的离子结构示意图
(2)Y元素原子的第一电离能
(3)元素T与氟元素相比,非金属性较强的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
您最近一年使用:0次



