连二亚硫酸钠( )在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定,低于52℃时
)在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定,低于52℃时 在水溶液中以
在水溶液中以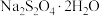 形态结晶,高于52℃时
形态结晶,高于52℃时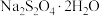 在碱性溶液中脱水成无水盐。实验室制备
在碱性溶液中脱水成无水盐。实验室制备 的原理为
的原理为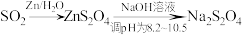 (
( 易溶于水),实验装置如图1所示(夹持仪器已省略),实验步骤如下:
易溶于水),实验装置如图1所示(夹持仪器已省略),实验步骤如下:
ⅱ.向三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成悬浊液;
ⅲ.打开仪器a的活塞,向装置C中通入一段时间 ;
;
ⅳ.打开仪器c的活塞,滴加稍过量NaOH溶液,控制pH在8.2~10.5之间[ 呈现两性,pH>10.5时其开始溶解];
呈现两性,pH>10.5时其开始溶解];
ⅴ.过滤,滤液经一系列操作可获得 。
。
回答下列问题:
(1)仪器b的名称是_______ ,该仪器中发生反应的化学方程式为_______ 。
(2)装置B单向阀的作用是_______ ;步骤ⅲ中装置C的水浴温度应控制为35~45℃之间,其原因是_______ 。
(3)下列关于步骤ⅳ的说法错误的是_______(填字母)。
(4)“一系列操作”包括:a.趁热过滤;b.用乙醇洗涤;c.搅拌下用水蒸气加热至60℃左右;d.分批加入细食盐粉,搅拌使其结晶,用倾析法除去上层溶液,余少量母液。上述操作的合理顺序为_______ →干燥(填字母)。
(5)电解法制备 的原理如图2所示,M、N均为惰性电极,充分电解后左池的溶质主要为
的原理如图2所示,M、N均为惰性电极,充分电解后左池的溶质主要为 、NaOH。M极电极反应式为
、NaOH。M极电极反应式为_______ 。 样品纯度的测定(假设杂质不参与反应,实验过程需在氮气氛围中进行):称取0.2500g样品加入三颈烧瓶中,加入适量NaOH溶液,打开电磁搅拌器,通过滴定仪控制滴定管向三颈烧瓶中快速滴加0.1000
样品纯度的测定(假设杂质不参与反应,实验过程需在氮气氛围中进行):称取0.2500g样品加入三颈烧瓶中,加入适量NaOH溶液,打开电磁搅拌器,通过滴定仪控制滴定管向三颈烧瓶中快速滴加0.1000 的
的 标准溶液,达到滴定终点时消耗25.00mL标准溶液{
标准溶液,达到滴定终点时消耗25.00mL标准溶液{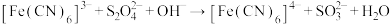 (未配平)}。
(未配平)}。
①该样品的纯度为_______ %。
②若实验过程中未通入 ,则所测
,则所测 的纯度
的纯度_______ (填“偏低”“偏高”或“无影响”)。
 )在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定,低于52℃时
)在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定,低于52℃时 在水溶液中以
在水溶液中以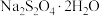 形态结晶,高于52℃时
形态结晶,高于52℃时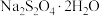 在碱性溶液中脱水成无水盐。实验室制备
在碱性溶液中脱水成无水盐。实验室制备 的原理为
的原理为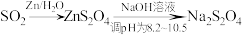 (
( 易溶于水),实验装置如图1所示(夹持仪器已省略),实验步骤如下:
易溶于水),实验装置如图1所示(夹持仪器已省略),实验步骤如下: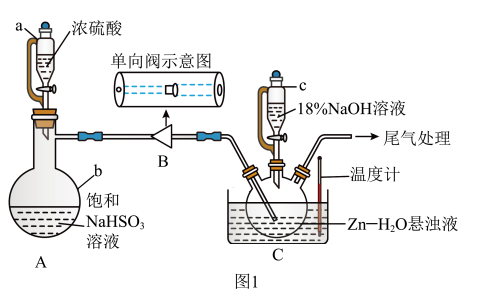
ⅱ.向三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成悬浊液;
ⅲ.打开仪器a的活塞,向装置C中通入一段时间
 ;
;ⅳ.打开仪器c的活塞,滴加稍过量NaOH溶液,控制pH在8.2~10.5之间[
 呈现两性,pH>10.5时其开始溶解];
呈现两性,pH>10.5时其开始溶解];ⅴ.过滤,滤液经一系列操作可获得
 。
。回答下列问题:
(1)仪器b的名称是
(2)装置B单向阀的作用是
(3)下列关于步骤ⅳ的说法错误的是_______(填字母)。
A.pH过大 沉淀完全,且 沉淀完全,且 能稳定存在 能稳定存在 |
B.pH过小 会沉淀不完全,产品中会产生含锌杂质 会沉淀不完全,产品中会产生含锌杂质 |
| C.装置C中18%NaOH溶液应用无氧水配制 |
| D.不可以用碳酸钠溶液代替氢氧化钠溶液 |
(4)“一系列操作”包括:a.趁热过滤;b.用乙醇洗涤;c.搅拌下用水蒸气加热至60℃左右;d.分批加入细食盐粉,搅拌使其结晶,用倾析法除去上层溶液,余少量母液。上述操作的合理顺序为
(5)电解法制备
 的原理如图2所示,M、N均为惰性电极,充分电解后左池的溶质主要为
的原理如图2所示,M、N均为惰性电极,充分电解后左池的溶质主要为 、NaOH。M极电极反应式为
、NaOH。M极电极反应式为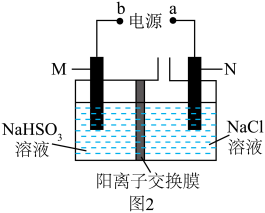
 样品纯度的测定(假设杂质不参与反应,实验过程需在氮气氛围中进行):称取0.2500g样品加入三颈烧瓶中,加入适量NaOH溶液,打开电磁搅拌器,通过滴定仪控制滴定管向三颈烧瓶中快速滴加0.1000
样品纯度的测定(假设杂质不参与反应,实验过程需在氮气氛围中进行):称取0.2500g样品加入三颈烧瓶中,加入适量NaOH溶液,打开电磁搅拌器,通过滴定仪控制滴定管向三颈烧瓶中快速滴加0.1000 的
的 标准溶液,达到滴定终点时消耗25.00mL标准溶液{
标准溶液,达到滴定终点时消耗25.00mL标准溶液{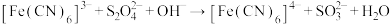 (未配平)}。
(未配平)}。①该样品的纯度为
②若实验过程中未通入
 ,则所测
,则所测 的纯度
的纯度
更新时间:2024-05-27 12:48:24
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】新冠肺炎疫情期间,环境消毒是极其关键的,常常喷洒“84”消毒液,其有效成分为NaClO。实验室利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
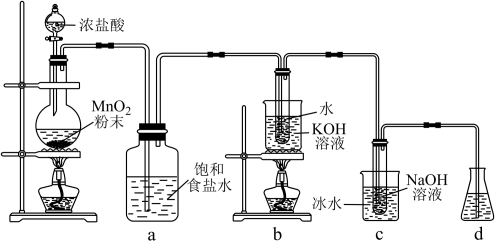
回答下列问题:
(1)盛放浓盐酸的仪器名称是_______ 。
(2)a的作用是_______ 。
(3)b中采用的加热方式是_______ ,c中发生反应的离子方程式是_______ 。
(4)d中可选用试剂_______ (填标号)。
A.Na2SO3溶液 B.NaCl溶液 C.NaOH溶液 D.稀H2SO4
(5)反应结束后,取出b中试管,经冷却、结晶、_______ 、_______ 及干燥,得到KClO3晶体。
(6)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变,2号试管溶液变为棕色,可知该条件下NaClO的氧化能力_______ KClO3(填“大于”或“小于”)。
(7)已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常用水稀释100倍(体积之比)后使用。用水稀释后的溶液中c(Na+)=_______ mol/L。(保留到小数点后两位)

回答下列问题:
(1)盛放浓盐酸的仪器名称是
(2)a的作用是
(3)b中采用的加热方式是
(4)d中可选用试剂
A.Na2SO3溶液 B.NaCl溶液 C.NaOH溶液 D.稀H2SO4
(5)反应结束后,取出b中试管,经冷却、结晶、
(6)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变,2号试管溶液变为棕色,可知该条件下NaClO的氧化能力
(7)已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常用水稀释100倍(体积之比)后使用。用水稀释后的溶液中c(Na+)=
84消毒液 有效成分:NaClO 规格:100mL 质量分数:25% 密度:1.19g/cm3 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】Cl2O极易溶于水并与水反应生成HClO;C12O的沸点为3.8℃,42℃以上分解为Cl2和O2,可作为高效安全灭菌消毒剂。如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备C12O,并用水吸收C12O制备次氯酸溶液。
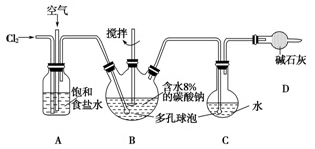
(1)实验中控制氯气与空气体积比的方法是___________ 。
(2)装置B中多孔球泡和搅拌棒的作用是________________ 。
(3)装置B中产生C12O的化学方程式为________________ 。
(4)若B无冷却装置,则进入C中的C12O会大量减少,其原因是_________ 。
(5)为避免C12影响C中溶液的溶质可以在B、C之间加一个盛有___________ (填试剂名称)的洗气瓶。
(6)已知次氯酸可被H2O2、FeCl2等物质还原成C1-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用______ (填仪器名称)取20.00mL次氯酸溶液放入烧杯中,向其中____________ (填操作),过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。(可选用的试剂:H2O2溶液、FeC12溶液、AgNO3溶液)

(1)实验中控制氯气与空气体积比的方法是
(2)装置B中多孔球泡和搅拌棒的作用是
(3)装置B中产生C12O的化学方程式为
(4)若B无冷却装置,则进入C中的C12O会大量减少,其原因是
(5)为避免C12影响C中溶液的溶质可以在B、C之间加一个盛有
(6)已知次氯酸可被H2O2、FeCl2等物质还原成C1-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】 是一种良好的热敏材料,工业上通常以摩尔质量记为M g/mol的氧钒(Ⅳ)碱式碳酸铵晶体
是一种良好的热敏材料,工业上通常以摩尔质量记为M g/mol的氧钒(Ⅳ)碱式碳酸铵晶体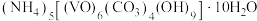 来生产
来生产 ,实验室模拟以
,实验室模拟以 为原料制备该晶体的过程如下:
为原料制备该晶体的过程如下:
(1)“微沸还原”时只加浓盐酸也能完成实验,加 的目的是
的目的是___________ 。
(2)“转化”可在下图装置中进行。___________ (填字母)。
②在反应发生前先通 气体的目的是
气体的目的是___________ 。
③装置2中生成氧钒(IV)碱式碳酸铵晶体的离子方程式为:___________ 。
(3)为测定粗产品的纯度,进行如下实验:
称取wg粗产品用去氧蒸馏水和稀硫酸完全溶解,加入稍过量的0.0200 mol·L
 溶液,往反应后的溶液中继续添加稍过量的1%
溶液,往反应后的溶液中继续添加稍过量的1% 溶液除去过量的酸性
溶液除去过量的酸性 溶液,然后往溶液中加适量尿素除去过量
溶液,然后往溶液中加适量尿素除去过量 溶液,最后用0.1000 mol·L
溶液,最后用0.1000 mol·L
 标准溶液滴定至终点,消耗标准溶液的体积y mL,该定时发生的反应为
标准溶液滴定至终点,消耗标准溶液的体积y mL,该定时发生的反应为 。
。
①滴定中可选用___________ 作指示剂。
②产品的纯度为___________ (列出计算式)。
 是一种良好的热敏材料,工业上通常以摩尔质量记为M g/mol的氧钒(Ⅳ)碱式碳酸铵晶体
是一种良好的热敏材料,工业上通常以摩尔质量记为M g/mol的氧钒(Ⅳ)碱式碳酸铵晶体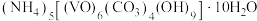 来生产
来生产 ,实验室模拟以
,实验室模拟以 为原料制备该晶体的过程如下:
为原料制备该晶体的过程如下: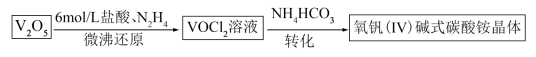
(1)“微沸还原”时只加浓盐酸也能完成实验,加
 的目的是
的目的是(2)“转化”可在下图装置中进行。
②在反应发生前先通
 气体的目的是
气体的目的是③装置2中生成氧钒(IV)碱式碳酸铵晶体的离子方程式为:
(3)为测定粗产品的纯度,进行如下实验:
称取wg粗产品用去氧蒸馏水和稀硫酸完全溶解,加入稍过量的0.0200 mol·L

 溶液,往反应后的溶液中继续添加稍过量的1%
溶液,往反应后的溶液中继续添加稍过量的1% 溶液除去过量的酸性
溶液除去过量的酸性 溶液,然后往溶液中加适量尿素除去过量
溶液,然后往溶液中加适量尿素除去过量 溶液,最后用0.1000 mol·L
溶液,最后用0.1000 mol·L
 标准溶液滴定至终点,消耗标准溶液的体积y mL,该定时发生的反应为
标准溶液滴定至终点,消耗标准溶液的体积y mL,该定时发生的反应为 。
。①滴定中可选用
②产品的纯度为
您最近一年使用:0次



