CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的碳源危机,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为
CO(g)+3H2(g) △H = +206kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为_______________ 。平衡后可以采取下列______________ 的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式________________________________ 。
②该反应的△S______ 0(填>或<或=),在 _________ 情况下有利于该反应自发进行。
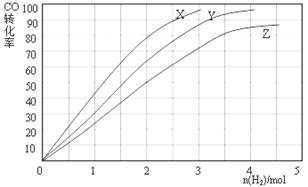
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是_______ (填字母);理由是_________________ 。列式计算270℃时该反应的平衡常数K:__________ 。
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g) △H = +206kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为
CO(g)+3H2(g) △H = +206kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g)
 CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1CO2(g)+H2(g)
 CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1①试写出由CO和H2制取甲醇的热化学方程式
②该反应的△S
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是

更新时间:2016-12-08 23:04:20
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】下表中的数据是破坏1 mol物质的化学键所消耗的能量:
根据上述数据回答:
(1) 下列氢化物中,最不稳定的是_____
A.HCl B.HBr C.HI
(2)H2和Cl2反应生成HCl过程中的热效应可用下图表示,请回答下列问题:

①ΔH1=_____ kJ·mol-1,ΔH2=_____ kJ·mol-1,ΔH3=_____ kJ·mol-1。
②据实验测定,H2和Cl2的混合气体在光照下反应生成HCl,引发该反应的步骤是上图①~③中分子转化为原子的一步,你认为是第__________ (填序号)步,请说明原因:_________________ 。
③该反应的热化学方程式为____________________ 。
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
根据上述数据回答:
(1) 下列氢化物中,最不稳定的是
A.HCl B.HBr C.HI
(2)H2和Cl2反应生成HCl过程中的热效应可用下图表示,请回答下列问题:

①ΔH1=
②据实验测定,H2和Cl2的混合气体在光照下反应生成HCl,引发该反应的步骤是上图①~③中分子转化为原子的一步,你认为是第
③该反应的热化学方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】苯乙烯是重要的化工原料。以乙苯(C6H5—CH2CH3) 为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2),反应方程式为:C6H5—CH2CH3(g) C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mol-1
C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mol-1
回答下列问题:
(1)已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
C6H5—CH2CH3(g)+21/2O2(g)=8CO2(g)+5H2O(l) ΔH=-4607.1 kJ·mol-1
则C6H5—CH=CH2(g)+10O2(g)= 8CO2(g)+4H2O(l) ΔH=_____________ 。
(2)工业上,在恒压设备中进行上述反应制取苯乙烯,常在乙苯蒸气中通入大量水蒸气。请用化学平衡理论解释通入大量水蒸气的原因_________________________________________ 。
(3)已知T℃下,将amol乙苯蒸气通入到体积为VL的密闭容器中进行上述反应,反应时间与容器内的总压强数据如下表:
①由表中数据计算0~10 min内v(C6H5—CH2CH3)=________________ 。(用含a、V的式子表示)
②该反应平衡时乙苯的转化率为_________________________ 。
(4)苯乙烯与溴化氢发生的加成反应产物有两种,其反应方程式如下:
i.C6H5—CH=CH2(g)+HBr(g) C6H5—CH2CH2Br (g)
C6H5—CH2CH2Br (g)
ii.C6H5—CH=CH2(g)+HBr(g) C6H5—CHBrCH3(g)
C6H5—CHBrCH3(g)
600℃时,向3L恒容密闭容器中充入1.2 mol C6H5—CH=CH2(g)和1.2 mol HBr(g)发生反应,达到平衡时C6H5—CH2CH2Br (g)和C6H5—CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。

①600℃时,反应ii的化学平衡常数Kii=__________________ 。
②反应平衡后,若保持其它条件不变,向该容器中再充入1mol C6H5—CH2CH2Br (g),则反应ii将_________ (“正向”、“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,判断反应已达到平衡状态的是______ 。
A.容器内的密度不再改变
B.C6H5—CH2CH2Br (g)的生成速率与C6H5—CHBrCH3(g)分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
 C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mol-1
C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mol-1回答下列问题:
(1)已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
C6H5—CH2CH3(g)+21/2O2(g)=8CO2(g)+5H2O(l) ΔH=-4607.1 kJ·mol-1
则C6H5—CH=CH2(g)+10O2(g)= 8CO2(g)+4H2O(l) ΔH=
(2)工业上,在恒压设备中进行上述反应制取苯乙烯,常在乙苯蒸气中通入大量水蒸气。请用化学平衡理论解释通入大量水蒸气的原因
(3)已知T℃下,将amol乙苯蒸气通入到体积为VL的密闭容器中进行上述反应,反应时间与容器内的总压强数据如下表:
| 时间t/min | 0 | 10 | 20 | 30 | 40 |
| 总压强p/1000kPa | 1.0 | 1.3 | 1.45 | 1.5 | 1.5 |
①由表中数据计算0~10 min内v(C6H5—CH2CH3)=
②该反应平衡时乙苯的转化率为
(4)苯乙烯与溴化氢发生的加成反应产物有两种,其反应方程式如下:
i.C6H5—CH=CH2(g)+HBr(g)
 C6H5—CH2CH2Br (g)
C6H5—CH2CH2Br (g)ii.C6H5—CH=CH2(g)+HBr(g)
 C6H5—CHBrCH3(g)
C6H5—CHBrCH3(g)600℃时,向3L恒容密闭容器中充入1.2 mol C6H5—CH=CH2(g)和1.2 mol HBr(g)发生反应,达到平衡时C6H5—CH2CH2Br (g)和C6H5—CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。

①600℃时,反应ii的化学平衡常数Kii=
②反应平衡后,若保持其它条件不变,向该容器中再充入1mol C6H5—CH2CH2Br (g),则反应ii将
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,判断反应已达到平衡状态的是
A.容器内的密度不再改变
B.C6H5—CH2CH2Br (g)的生成速率与C6H5—CHBrCH3(g)分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】Ⅰ、(1)已知下列两个热化学方程式:
H2(g)+ O2(g)===H2O(l) ΔH=-285.0 kJ/mol
O2(g)===H2O(l) ΔH=-285.0 kJ/mol
C3H8(g)+5O2(g)===4H2O(l)+3CO2(g) ΔH=-2220.0 kJ/mol
①已知:H2O(l)===H2O(g) ΔH=+44.0 kJ· mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式:
_________________________________________ 。
②实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5 kJ,则混合气体中H2和C3H8的体积比是______________ 。
(2)已知:P4(白磷,s)+5O2(g)===P4O10(s) ΔH=-2983.2 kJ/mol
P(红磷,s)+ O2(g)===
O2(g)=== P4O10(s) ΔH=-738.5 kJ/mol
P4O10(s) ΔH=-738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式____________________________________
相同状况下,能量较低的是________ ;白磷的稳定性比红磷_____ (填“高”或“低”)。
Ⅱ、盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式_____________________________ 。
H2(g)+
 O2(g)===H2O(l) ΔH=-285.0 kJ/mol
O2(g)===H2O(l) ΔH=-285.0 kJ/molC3H8(g)+5O2(g)===4H2O(l)+3CO2(g) ΔH=-2220.0 kJ/mol
①已知:H2O(l)===H2O(g) ΔH=+44.0 kJ· mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式:
②实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5 kJ,则混合气体中H2和C3H8的体积比是
(2)已知:P4(白磷,s)+5O2(g)===P4O10(s) ΔH=-2983.2 kJ/mol
P(红磷,s)+
 O2(g)===
O2(g)=== P4O10(s) ΔH=-738.5 kJ/mol
P4O10(s) ΔH=-738.5 kJ/mol试写出白磷转化为红磷的热化学方程式
相同状况下,能量较低的是
Ⅱ、盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式
您最近一年使用:0次
【推荐1】工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:____________ 。
当温度降低时,化学平衡常数K值________ (填“增大”、“减小”或“无影响”)。
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________ (填字母)。
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.0 mol,n(H2)=0.8 mol,n(NH3)=0.8 mol,则反应速率v(H2)=________ ,平衡常数=________ 。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度____ (填“大于”、“小于”或“等于”)原来的2倍。

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:
当温度降低时,化学平衡常数K值
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2
 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。①下列各项标志着该反应达到化学平衡状态的是
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:

① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为______________ 。
(2)从原料、能源利用的角度,分析作为合成甲醇更适宜的是反应_____________ 。(填序号)
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
①0<V≤33.6L时,负极电极反应为___________ 。
②33.6L<V≤67.2L时,电池总反应方程式为______________ 。
③V=44.8L时,溶液中离子浓度大小关系为________________ 。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
下列叙述正确的是___________ (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(5)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①上图中M、N、Q点平衡常数K的大小关系是_____________ 。
②M点对应的H2转化率是____________ 。

① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+
 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为
(2)从原料、能源利用的角度,分析作为合成甲醇更适宜的是反应
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
①0<V≤33.6L时,负极电极反应为
②33.6L<V≤67.2L时,电池总反应方程式为
③V=44.8L时,溶液中离子浓度大小关系为
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| ② | 2 | 8 | 0 | t2 min | 放出热量:Q |
下列叙述正确的是
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(5)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①上图中M、N、Q点平衡常数K的大小关系是
②M点对应的H2转化率是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】CO2和CH4是两种重要的温室气体。
(1)在一定条件下,二氧化碳转化为甲烷的反应为CO2(g)+4H2(g) CH4(g)+2H2O(g)。向一容积为 2 L的恒容密闭容器中充入一定量的CO2和H2,在300 ℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L−1,H2 0.8 mol·L−1,CH4 0.8 mol·L−1,H2O 1.6 mol·L−1。则CO2的平衡转化率为
CH4(g)+2H2O(g)。向一容积为 2 L的恒容密闭容器中充入一定量的CO2和H2,在300 ℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L−1,H2 0.8 mol·L−1,CH4 0.8 mol·L−1,H2O 1.6 mol·L−1。则CO2的平衡转化率为_____________________ 。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸:CO2+CH4 CH3COOH。为了提高该反应中CH4的转化率,可以采取的措施是
CH3COOH。为了提高该反应中CH4的转化率,可以采取的措施是_____________________ (写出一条即可)。
(3)在煤炭中加氢,发生的主要反应为:C(s)+2H2(g) CH4(g)。在密闭容器中投入碳和H2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。
CH4(g)。在密闭容器中投入碳和H2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。

①上述正反应的ΔH__________ 0(填“>”“<”或“=”)。
②在4 MPa、1 200 K时,图中X点v正(H2)_________ v逆(H2)(填“>”“<”或“=”)。
③某化学兴趣小组提供下列四个条件进行上述反应,比较分析后,你选择的反应条件是_____________ (填字母序号)。
A.3 Mpa 800 K B.6 Mpa 1 000 K
C.10 Mpa 1 000 K D.10 Mpa 1 100 K
(1)在一定条件下,二氧化碳转化为甲烷的反应为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。向一容积为 2 L的恒容密闭容器中充入一定量的CO2和H2,在300 ℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L−1,H2 0.8 mol·L−1,CH4 0.8 mol·L−1,H2O 1.6 mol·L−1。则CO2的平衡转化率为
CH4(g)+2H2O(g)。向一容积为 2 L的恒容密闭容器中充入一定量的CO2和H2,在300 ℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L−1,H2 0.8 mol·L−1,CH4 0.8 mol·L−1,H2O 1.6 mol·L−1。则CO2的平衡转化率为(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸:CO2+CH4
 CH3COOH。为了提高该反应中CH4的转化率,可以采取的措施是
CH3COOH。为了提高该反应中CH4的转化率,可以采取的措施是(3)在煤炭中加氢,发生的主要反应为:C(s)+2H2(g)
 CH4(g)。在密闭容器中投入碳和H2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。
CH4(g)。在密闭容器中投入碳和H2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。
①上述正反应的ΔH
②在4 MPa、1 200 K时,图中X点v正(H2)
③某化学兴趣小组提供下列四个条件进行上述反应,比较分析后,你选择的反应条件是
A.3 Mpa 800 K B.6 Mpa 1 000 K
C.10 Mpa 1 000 K D.10 Mpa 1 100 K
您最近一年使用:0次



