铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
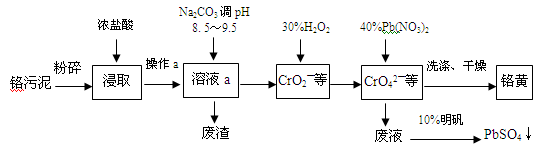
(1)操作a的名称为____ 。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式_________ 。
(3)写出加入30%H2O2过程中发生的离子反应方程式:________________________ 。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是__________________ 。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为_______________________ 。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①请分析电解过程中溶液pH不断上升的原因_____________________________ 。
②当电路中通过3mol电子时,理论上可还原的Cr2O72-的物质的量为____ mol。

(1)操作a的名称为
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式
(3)写出加入30%H2O2过程中发生的离子反应方程式:
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是
(5)在废液中加入10%明矾溶液发生反应的离子方程式为
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①请分析电解过程中溶液pH不断上升的原因
②当电路中通过3mol电子时,理论上可还原的Cr2O72-的物质的量为
更新时间:2016/12/09 07:09:10
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】人类向大气中排放的NOx对环境会产生危害,脱除NOx是科学家研究的重要课题。
(1)尿素还原法可将NOx还原为N2进行脱除。
已知:CO(NH2)2(s)+H2O(g) 2NH3(g)+CO2(g) ∆H1=+133.6kJ/mol
2NH3(g)+CO2(g) ∆H1=+133.6kJ/mol
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ∆H2=-2070 kJ/mol
写出尿素还原NO反应的热化学方程式:___________ 。
(2)HClO能有效脱除NO,研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
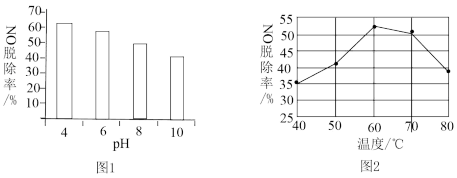
①图1中,pH减小NO脱除率增大的原因是___________ 。
②图2中,60~80℃ NO脱除率下降的原因是___________ 。
(3)NO2和H2是能效比非常 高的火箭推进剂,工业上用CH4与水蒸气在一定条件下制取 ,原理为
,原理为
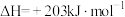 。
。
①该反应逆反应速率表达式为 ,k为速率常数,在某温度下测得实验数据如表:
,k为速率常数,在某温度下测得实验数据如表:
由上述数据可得该温度下,该反应的逆反应速率常数k为___________ 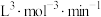 。
。
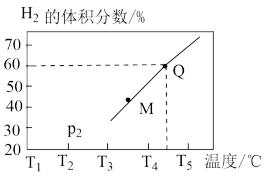
②在体积为3L的恒容密闭容器中通入物质的量均为3mol 和水蒸气,在一定条件下发生上述反应,测得平衡时
和水蒸气,在一定条件下发生上述反应,测得平衡时 的体积分数与温度的关系如图所示。M点
的体积分数与温度的关系如图所示。M点
___________ (填“大于”或“小于”)Q点 ;Q点对应温度下该反应的平衡常数K=
;Q点对应温度下该反应的平衡常数K=___________ 。
(4)通过电化学循环法可将 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: 、
、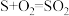 。
。
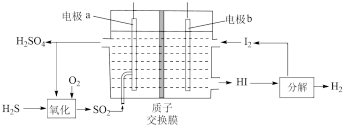
①电极a上发生反应的电极反应式为___________ 。
②理论上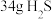 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为___________ 。
(1)尿素还原法可将NOx还原为N2进行脱除。
已知:CO(NH2)2(s)+H2O(g)
 2NH3(g)+CO2(g) ∆H1=+133.6kJ/mol
2NH3(g)+CO2(g) ∆H1=+133.6kJ/mol 4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ∆H2=-2070 kJ/mol
写出尿素还原NO反应的热化学方程式:
(2)HClO能有效脱除NO,研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。

①图1中,pH减小NO脱除率增大的原因是
②图2中,60~80℃ NO脱除率下降的原因是
(3)NO2和H2是能效比非常 高的火箭推进剂,工业上用CH4与水蒸气在一定条件下制取
 ,原理为
,原理为
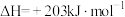 。
。①该反应逆反应速率表达式为
 ,k为速率常数,在某温度下测得实验数据如表:
,k为速率常数,在某温度下测得实验数据如表:CO浓度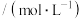 |  浓度 浓度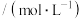 | 逆反应速率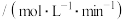 |
| 0.05 |  | 4.8 |
 |  | 19.2 |
 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为
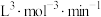 。
。②在体积为3L的恒容密闭容器中通入物质的量均为3mol
 和水蒸气,在一定条件下发生上述反应,测得平衡时
和水蒸气,在一定条件下发生上述反应,测得平衡时 的体积分数与温度的关系如图所示。M点
的体积分数与温度的关系如图所示。M点
 ;Q点对应温度下该反应的平衡常数K=
;Q点对应温度下该反应的平衡常数K=
(4)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: 、
、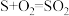 。
。
①电极a上发生反应的电极反应式为
②理论上
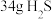 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某同学在实验室利用Fe-Mg合金废料制备金属镁,其工艺流程如图。回答下列问题:
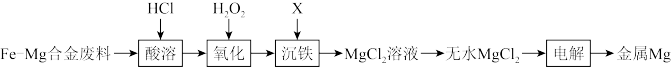
(1)工业上常将Fe-Mg合金废料粉碎后再“酸溶”,其目的是_______ 。
(2)写出“氧化”时反应的离子方程式_______ 。
(3)制备无水MgCl2过程中,需要将SOCl2与MgCl2·6H2O混合并加热,试解释原因_______ 。
(4)写出电解得到金属Mg时阴极的电极反应式_______ 。
(5)“沉铁”时,应用X调节溶液的pH,X是_______ (任填一种合适试剂的化学式),当溶液的pH调节为4时,此时溶液中的c(Fe3+)=_______ { Ksp[Fe(OH)3]=2.7×10-39}。
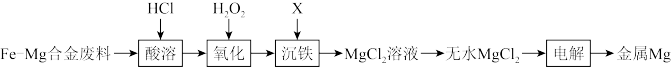
(1)工业上常将Fe-Mg合金废料粉碎后再“酸溶”,其目的是
(2)写出“氧化”时反应的离子方程式
(3)制备无水MgCl2过程中,需要将SOCl2与MgCl2·6H2O混合并加热,试解释原因
(4)写出电解得到金属Mg时阴极的电极反应式
(5)“沉铁”时,应用X调节溶液的pH,X是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】软锰矿的主要成分为MnO2,含少量Al2O3和SiO2.闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下:
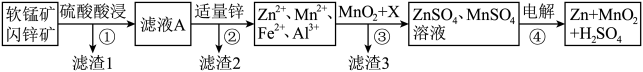
已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.常温下各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)为了加快矿石的酸浸速率,通常采用的方法有___________ (写出两种)。
(2)滤渣2的成分有___________ (填化学式)。
(3)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写MnO2、FeS与硫酸共热发生反应的离子方程式:___________ 。
(4)步骤③中物质X用来调节溶液的pH,可以是下列的___________(填序号)。
(5)当金属离子物质的量浓度为1×10-5mol/L时认为离子完全沉淀,则Ksp[Al(OH)3]=___________ 。
(6)步骤④以锂离子电池作电源,用惰性电极进行电解,其阳极的电极反应式为___________ ;用MnO2可以制取锂离子电池的正极材料LiMnO2,该电池充电时的反应为:LiMnO2+6C=Li1-xMnO2+LixC6,写出充电时阳极的电极反应式___________ 。

已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.常温下各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)为了加快矿石的酸浸速率,通常采用的方法有
(2)滤渣2的成分有
(3)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写MnO2、FeS与硫酸共热发生反应的离子方程式:
(4)步骤③中物质X用来调节溶液的pH,可以是下列的___________(填序号)。
| A.Mg(OH)2 | B.ZnO | C.Cu(OH)2 | D.MnCO3 |
(5)当金属离子物质的量浓度为1×10-5mol/L时认为离子完全沉淀,则Ksp[Al(OH)3]=
(6)步骤④以锂离子电池作电源,用惰性电极进行电解,其阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】25℃时,现有浓度均为0.10mol/L的三种溶液:①NaCl溶液、②CH3COONa溶液、③CH3COOH溶液。请回答:
(1)三种溶液中,pH>7的是__________ (填序号),其原因是________________________________________ (用离子方程式表示)。pH<7的是__________ (填序号),其原因是________________________________________ (用化学用语表示)。
(2)下列说法正确的是__________ (填序号)。
a.CH3COONa是弱电解质
b.CH3COONa和CH3COOH都能促进水的电离
c.①②两种溶液等体积混合后,溶液中c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)
(3)②③两种溶液等体积混合后,溶液pH<7,该混合溶液中离子浓度大小关系是_____________________
(4) 25℃时,电解1.00L饱和NaCl溶液一段时间后,收集到1.12LH2(标准状况)。该反应的离子方程式是____________ ,此时溶液的pH是____________ (不考虑溶液体积的变化)。
(1)三种溶液中,pH>7的是
(2)下列说法正确的是
a.CH3COONa是弱电解质
b.CH3COONa和CH3COOH都能促进水的电离
c.①②两种溶液等体积混合后,溶液中c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)
(3)②③两种溶液等体积混合后,溶液pH<7,该混合溶液中离子浓度大小关系是
(4) 25℃时,电解1.00L饱和NaCl溶液一段时间后,收集到1.12LH2(标准状况)。该反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答
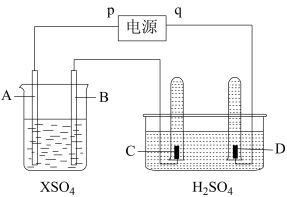
(1)p为_______ 极,A极发生了_______ (填反应类型)反应。
(2)C为_______ 极,C极的电极反应式是_______ 。
(3)当反应进行一段时间后,左侧烧杯内溶液的pH_______ (填“增大”“减小”或“不变”)。
(4)若A为铂电极,当电路中通过0.004mol电子时,关闭电源,B电极上沉积金属X的质量为0.128g,则此金属的摩尔质量为_______ ,此时,加入_______ (填物质的化学式)可以让左侧烧杯内的溶液复原。

(1)p为
(2)C为
(3)当反应进行一段时间后,左侧烧杯内溶液的pH
(4)若A为铂电极,当电路中通过0.004mol电子时,关闭电源,B电极上沉积金属X的质量为0.128g,则此金属的摩尔质量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 存在于天然气、沼气、煤矿坑井气中,它既是优质气体燃料,也是制造合成气和许多化工产品的重要原料。回答下列问题:
存在于天然气、沼气、煤矿坑井气中,它既是优质气体燃料,也是制造合成气和许多化工产品的重要原料。回答下列问题:
(1) 催化重整不仅可以得到合成气(
催化重整不仅可以得到合成气( 和
和 ),还对温室气体的减排具有重要意义。
),还对温室气体的减排具有重要意义。
已知:

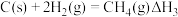
 催化重整反应:
催化重整反应: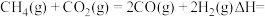
_______ (用 、
、 、
、 表示),若
表示),若 ,则
,则 催化重整反应为
催化重整反应为__________ (填“吸”或“放”)热反应。
(2)图中为甲烷燃烧过程的能量变化,该反应的活化能为_______  ,
,
_______  。
。

(3)图中是目前研究较多的一类 燃料电池的工作原理示意图。
燃料电池的工作原理示意图。
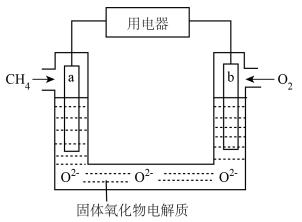
①a极为电池___________ (填“正”或“负”)极;b极的电极反应式为_________ 。
②电池中内电路的 移向
移向___________ (填“a”或“b”)极。
(4)用该燃料电池电解 溶液(电极材料为石墨),当电子转移
溶液(电极材料为石墨),当电子转移 时,阴极产物是
时,阴极产物是____________ (写化学式),阳极析出气体体积为________ L(标准状况)。
 存在于天然气、沼气、煤矿坑井气中,它既是优质气体燃料,也是制造合成气和许多化工产品的重要原料。回答下列问题:
存在于天然气、沼气、煤矿坑井气中,它既是优质气体燃料,也是制造合成气和许多化工产品的重要原料。回答下列问题:(1)
 催化重整不仅可以得到合成气(
催化重整不仅可以得到合成气( 和
和 ),还对温室气体的减排具有重要意义。
),还对温室气体的减排具有重要意义。已知:


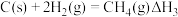
 催化重整反应:
催化重整反应: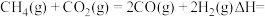
 、
、 、
、 表示),若
表示),若 ,则
,则 催化重整反应为
催化重整反应为(2)图中为甲烷燃烧过程的能量变化,该反应的活化能为
 ,
,
 。
。
(3)图中是目前研究较多的一类
 燃料电池的工作原理示意图。
燃料电池的工作原理示意图。
①a极为电池
②电池中内电路的
 移向
移向(4)用该燃料电池电解
 溶液(电极材料为石墨),当电子转移
溶液(电极材料为石墨),当电子转移 时,阴极产物是
时,阴极产物是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】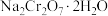 是一种重要的化工原料,可用于制革,印染等工业。
是一种重要的化工原料,可用于制革,印染等工业。
(1)以铬铁矿(主要成分为 ,还含有MgO、
,还含有MgO、 、
、 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
①焙烧时将矿料磨碎且气体与矿料逆流而行,其目的是______ 。
②焙烧的目的是将 转化为
转化为 并将Al、Si氧化物转化为可溶性钠盐,写出焙烧时
并将Al、Si氧化物转化为可溶性钠盐,写出焙烧时 发生的化学方程式
发生的化学方程式______ 。
③滤渣1主要含有______ 。
④矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如下图所示。______ ,pH的理论范围为______ 。
ⅱ.过程Ⅳ发生反应 ,计算该反应的K≈
,计算该反应的K≈______ 。
(2)测定产品中 的质量分数。
的质量分数。
称取a g产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用b mol∙L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液v mL。产品中 (摩尔质量为
(摩尔质量为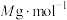 )的质量分数为
)的质量分数为______ 。(列计算式)
(3)利用膜电解技术,以 溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备
溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备 ,装置如图。
,装置如图。______ (填序号)。
a.阴离子交换膜 b.质子交换膜 c.阳离子交换膜
②结合方程式解释Na2Cr2O7产生的原理______ 。
已知:酸性条件下 被还原为Cr3+。
被还原为Cr3+。
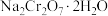 是一种重要的化工原料,可用于制革,印染等工业。
是一种重要的化工原料,可用于制革,印染等工业。(1)以铬铁矿(主要成分为
 ,还含有MgO、
,还含有MgO、 、
、 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。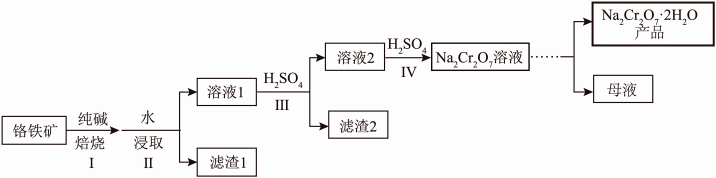
①焙烧时将矿料磨碎且气体与矿料逆流而行,其目的是
②焙烧的目的是将
 转化为
转化为 并将Al、Si氧化物转化为可溶性钠盐,写出焙烧时
并将Al、Si氧化物转化为可溶性钠盐,写出焙烧时 发生的化学方程式
发生的化学方程式③滤渣1主要含有
④矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如下图所示。
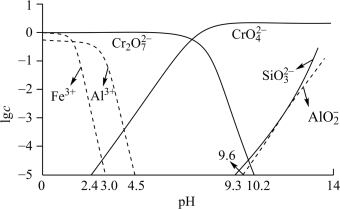
ⅱ.过程Ⅳ发生反应
 ,计算该反应的K≈
,计算该反应的K≈(2)测定产品中
 的质量分数。
的质量分数。称取a g产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用b mol∙L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液v mL。产品中
 (摩尔质量为
(摩尔质量为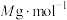 )的质量分数为
)的质量分数为(3)利用膜电解技术,以
 溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备
溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备 ,装置如图。
,装置如图。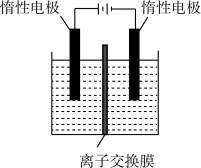
a.阴离子交换膜 b.质子交换膜 c.阳离子交换膜
②结合方程式解释Na2Cr2O7产生的原理
已知:酸性条件下
 被还原为Cr3+。
被还原为Cr3+。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】用含铬不锈钢废渣(含 、
、 、
、 、
、 等)制取
等)制取 (铬绿)的工艺流程如图所示:
(铬绿)的工艺流程如图所示:

回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是___________ 。
(2) 、KOH、
、KOH、 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
(3)“水浸”时,碱熔渣中的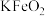 强烈水解生成的难溶物为
强烈水解生成的难溶物为___________ (填化学式);
(4)常温下“酸化”时,pH不宜过低的原因是___________ ;
(5)“还原”时,发生反应的离子方程式为___________ 。
(6)由 制取铬绿的方法是
制取铬绿的方法是___________ 。
 、
、 、
、 、
、 等)制取
等)制取 (铬绿)的工艺流程如图所示:
(铬绿)的工艺流程如图所示:
回答下列问题:
(1)“碱熔”时,为使废渣充分氧化可采取的措施是
(2)
 、KOH、
、KOH、 反应生成
反应生成 的化学方程式为
的化学方程式为(3)“水浸”时,碱熔渣中的
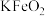 强烈水解生成的难溶物为
强烈水解生成的难溶物为(4)常温下“酸化”时,pH不宜过低的原因是
(5)“还原”时,发生反应的离子方程式为
(6)由
 制取铬绿的方法是
制取铬绿的方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】醋酸亚铬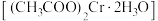 为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示,回答下列问题:
为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示,回答下列问题:

(1)仪器a的名称为____________________________ 。
(2)d中析出砖红色沉淀.为使沉淀充分析出并分离,需采用的操作是___________ 、___________ 、洗涤、干燥。
(3)Cr2+也可用锌粒还原K2Cr2O7制备,写出反应的离子方程式___________ 。
(4)该实验中盐酸必须适量,不能过量的原因___________ 。
(5)该制备实验能否成功的关键是排除O2的干扰,下列关于O2的存在及如何消除O2对制备的影响均正确的是___________(填编号)。
(6)某实验小组设计如下改进装置制备醋酸亚铬晶体,改进后的优点是(答一点即可)___________________________ 。
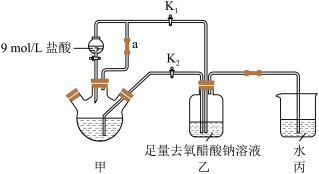
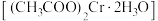 为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示,回答下列问题:
为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬.实验装置如图所示,回答下列问题:
(1)仪器a的名称为
(2)d中析出砖红色沉淀.为使沉淀充分析出并分离,需采用的操作是
(3)Cr2+也可用锌粒还原K2Cr2O7制备,写出反应的离子方程式
(4)该实验中盐酸必须适量,不能过量的原因
(5)该制备实验能否成功的关键是排除O2的干扰,下列关于O2的存在及如何消除O2对制备的影响均正确的是___________(填编号)。
编号 | 使溶液中含O2的因素 | 消除O2的方法 |
A | 溶液中溶解的O2 | 配制溶液所使用的蒸馏水煮沸后在空气中自然冷却 |
B | 装置中的空气含有O2 | 利用生成的氢气将装置中的空气排尽 |
C | 外界空气进入制备装置 | 在装置d中加入一些四氯化碳 |
D | 外界空气进入制备装置 | 将装置d用下列装置替换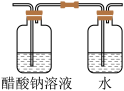 |
| A.A | B.B | C.C | D.D |
(6)某实验小组设计如下改进装置制备醋酸亚铬晶体,改进后的优点是(答一点即可)

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业废水任意排放,会造成环境污染。“协同去污,变废为宝”,为处理工业废水提供了新思路。电镀厂产生大量含 、
、 的电镀废液,皮革厂产生大量含
的电镀废液,皮革厂产生大量含 的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂
的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂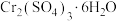 ,工艺流程如图:
,工艺流程如图:
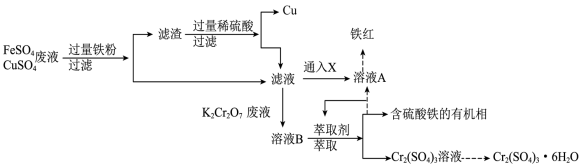
(1) 中Cr元素的化合价为
中Cr元素的化合价为__________ 。
(2)该工艺中多次用到过滤,过滤时需要的玻璃仪器除烧杯外还有__________ ,__________ 。
(3)滤液可以通入或加入X经一步转化为溶液A,X可以是下列选项中的哪些物质__________
A. B.
B. C.
C. D.
D. E.
E.
证明滤液中只含有 而不含
而不含 的实验方法是
的实验方法是__________ 。
(4)滤液与含 的废液反应的离子方程式为
的废液反应的离子方程式为__________ 。
(5)从 溶液制取
溶液制取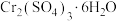 晶体的实验操作方法为
晶体的实验操作方法为__________ 、__________ 、过滤、洗涤、干燥。
(6)已知 化学性质与
化学性质与 类似,选择合适的化学试剂,先将流程中的
类似,选择合适的化学试剂,先将流程中的 溶液转化为氢氧化铬,再转化成可用于陶瓷和搪瓷的着色剂
溶液转化为氢氧化铬,再转化成可用于陶瓷和搪瓷的着色剂 。转化过程中发生的主要的方程式为:
。转化过程中发生的主要的方程式为:
离子方程式①__________ 化学方程式②__________ 。
 、
、 的电镀废液,皮革厂产生大量含
的电镀废液,皮革厂产生大量含 的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂
的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂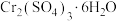 ,工艺流程如图:
,工艺流程如图:
(1)
 中Cr元素的化合价为
中Cr元素的化合价为(2)该工艺中多次用到过滤,过滤时需要的玻璃仪器除烧杯外还有
(3)滤液可以通入或加入X经一步转化为溶液A,X可以是下列选项中的哪些物质
A.
 B.
B. C.
C. D.
D. E.
E.
证明滤液中只含有
 而不含
而不含 的实验方法是
的实验方法是(4)滤液与含
 的废液反应的离子方程式为
的废液反应的离子方程式为(5)从
 溶液制取
溶液制取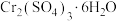 晶体的实验操作方法为
晶体的实验操作方法为(6)已知
 化学性质与
化学性质与 类似,选择合适的化学试剂,先将流程中的
类似,选择合适的化学试剂,先将流程中的 溶液转化为氢氧化铬,再转化成可用于陶瓷和搪瓷的着色剂
溶液转化为氢氧化铬,再转化成可用于陶瓷和搪瓷的着色剂 。转化过程中发生的主要的方程式为:
。转化过程中发生的主要的方程式为:离子方程式①
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】铬酰氯是一种无机化合物,化学式为CrO2Cl2,熔点—96.5℃,沸点117℃,常温下为深红棕色液体,放置在空气中会迅速挥发并水解。在实验室中可用重铬酸钾、浓硫酸与氯化钠反应得到铬酰氯。反应机理为:浓硫酸先分别与重铬酸钾和氯化钠反应生成CrO3和氯化氢气体两种中间产物,然后CrO3迅速与氯化氢气体反应生成铬酰氯。实验装置如图(夹持装置略):
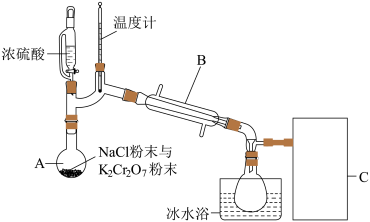
回答下列问题:
(1)装置图中,仪器A、B的名称分别是_____ 、_____ 。
(2)温度计的作用是_____ 。
(3)收集装置选用冰水浴的目的是_____ 。
(4)CrO3与氯化氢气体反应生成铬酰氯的化学反应方程式是_____ 。
(5)投料时,加入过量氯化钠粉末可以显著增大铬酰氯的产率,原因是_____ 。
(6)图中C装置未画出,应为下列装置中的_____ (填标号),该装置的作用是_____ 。
a. b.
b. 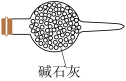 c.
c. 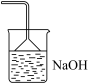 d.
d.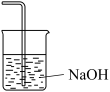

回答下列问题:
(1)装置图中,仪器A、B的名称分别是
(2)温度计的作用是
(3)收集装置选用冰水浴的目的是
(4)CrO3与氯化氢气体反应生成铬酰氯的化学反应方程式是
(5)投料时,加入过量氯化钠粉末可以显著增大铬酰氯的产率,原因是
(6)图中C装置未画出,应为下列装置中的
a.
 b.
b.  c.
c.  d.
d.
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某兴趣小组用铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备K2Cr2O7晶体,流程如下:

(1)焙烧时向矿料中加入碳酸钠和氧气,发生如下反应FeCr2O4转化为Na2CrO4,Na2CO3+SiO2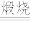 Na2SiO3+CO2↑,Na2CO3+Al2O3
Na2SiO3+CO2↑,Na2CO3+Al2O3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
写出FeCr2O4转化为Na2CrO4的化学方程式_____________________________ 。
(2)滤渣1的主要成分是_____ 。
(3)滤渣2的成分是_____ 和__ 。
(4)流程中调pH:已知2CrO +2H+⇌Cr2O
+2H+⇌Cr2O +H2O,蒸发结晶所产生的副产品是
+H2O,蒸发结晶所产生的副产品是_____ 。
(5)结晶步骤Na2Cr2O7+2KCl= K2Cr2O7+2NaCl该反应是_________ 类型(四种基本反应类型)。
(6)该小组用m1 kg铬铁矿(FeCr2O4 50%)制备K2Cr2O7,最终得到m2 kg,产率为____ 。

(1)焙烧时向矿料中加入碳酸钠和氧气,发生如下反应FeCr2O4转化为Na2CrO4,Na2CO3+SiO2
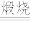 Na2SiO3+CO2↑,Na2CO3+Al2O3
Na2SiO3+CO2↑,Na2CO3+Al2O3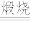 2NaAlO2+CO2↑
2NaAlO2+CO2↑写出FeCr2O4转化为Na2CrO4的化学方程式
(2)滤渣1的主要成分是
(3)滤渣2的成分是
(4)流程中调pH:已知2CrO
 +2H+⇌Cr2O
+2H+⇌Cr2O +H2O,蒸发结晶所产生的副产品是
+H2O,蒸发结晶所产生的副产品是(5)结晶步骤Na2Cr2O7+2KCl= K2Cr2O7+2NaCl该反应是
(6)该小组用m1 kg铬铁矿(FeCr2O4 50%)制备K2Cr2O7,最终得到m2 kg,产率为
您最近一年使用:0次



