分甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为____________ 。
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=____________ 。
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:______________ 。
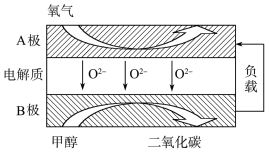
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池____________ 极,电极反应式为________________ 。
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为______________ (标准状况下),实际上消耗的甲烷体积(折算到标准状况)比理论上大,可能原因为________________ 。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:

(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为
更新时间:2019-01-30 18:14:09
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)反应 ,生成物能量总和
,生成物能量总和________ (填“大于”、“小于”或“等于”)反应物能量总和。已知:常温常压下,8g甲烷气体在足量氧气中充分燃烧生成液态水和二氧化碳气体时放出445kJ热量,写出甲烷气体的燃烧热的热化学方程式:________________ 。
(2)某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
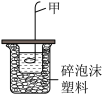
I.实验步骤:
a.量取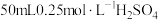 溶液,倒入小烧杯中,测量温度;
溶液,倒入小烧杯中,测量温度;
b.量取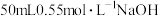 溶液,测量温度;
溶液,测量温度;
c.将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
II.实验数据如下:
①仪器甲的名称为________ ,进行该实验还缺少的仪器为________ (填仪器名称);仪器甲不能用铁制材料的原因是________ 。
②已知在稀溶液中,强酸和强碱发生中和反应生成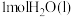 时,放出57.3kJ热量,该反应的热化学方程式为
时,放出57.3kJ热量,该反应的热化学方程式为________ 。
③碎泡沫塑料的作用为________ ,使用的NaOH溶液稍微过量的原因是________ 。
④设实验所用的酸、碱溶液的密度均为 ,且酸、碱溶液和中和后的溶液的比热容
,且酸、碱溶液和中和后的溶液的比热容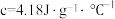 ,计算实验测出的中和反应的反应热
,计算实验测出的中和反应的反应热
________  。[提示:
。[提示: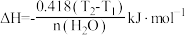 ]
]
(1)反应
 ,生成物能量总和
,生成物能量总和(2)某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。

I.实验步骤:
a.量取
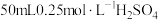 溶液,倒入小烧杯中,测量温度;
溶液,倒入小烧杯中,测量温度;b.量取
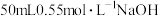 溶液,测量温度;
溶液,测量温度;c.将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
II.实验数据如下:
| 实验序号 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | ||
 溶液 溶液 | NaOH溶液 | 平均值 | ||
| 1 | 25.0 | 25.2 | 28.5 | |
| 2 | 24.9 | 25.1 | 28.4 | |
| 3 | 25.5 | 26.5 | 31.8 | |
②已知在稀溶液中,强酸和强碱发生中和反应生成
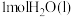 时,放出57.3kJ热量,该反应的热化学方程式为
时,放出57.3kJ热量,该反应的热化学方程式为③碎泡沫塑料的作用为
④设实验所用的酸、碱溶液的密度均为
 ,且酸、碱溶液和中和后的溶液的比热容
,且酸、碱溶液和中和后的溶液的比热容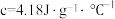 ,计算实验测出的中和反应的反应热
,计算实验测出的中和反应的反应热
 。[提示:
。[提示: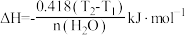 ]
]
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃。室温时AX3与气体X2反应生成lmolAX5,放出热量123.8kJ。该反应的热化学方程式为______________ 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①实验b从反应开始至达到平衡时的反应速率v(AX5)=_____________ 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为_______ (填实验序号);与实验a相比,其他两组改变的实验条件是:b_________ 、c___________ 。
(1)已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃。室温时AX3与气体X2反应生成lmolAX5,放出热量123.8kJ。该反应的热化学方程式为
(2)反应AX3(g)+X2(g)
 AX5(g)在容积为10L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①实验b从反应开始至达到平衡时的反应速率v(AX5)=
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是________ 。
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:________ 。
②CH4不完全燃烧也可制得合成气:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为______ (填序号);原因是____________ 。
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g) CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
I.H2的转化率为________ ;
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=_____ mol。
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向_______ 反应方向移动(填“正”或“逆”);
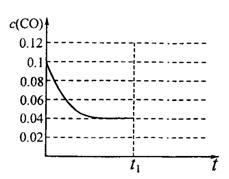
在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线_____ 。
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。
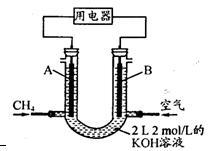
持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为____ ;
②44.8 L<V≤89.6 L时,负极电极反应为______ ;
③V=67.2 L时,溶液中离子浓度大小关系为______ ;
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:
②CH4不完全燃烧也可制得合成气:CH4(g)+
 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g)
 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。I.H2的转化率为
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向

在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。

持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为
②44.8 L<V≤89.6 L时,负极电极反应为
③V=67.2 L时,溶液中离子浓度大小关系为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】羰基硫(COS)作为一种粮食熏蒸剂广泛应用于农药工业。利用工厂废气中的H2S和CO反应可以合成COS,回答下列问题:
(1)已知:①CO的燃烧热为283kJ•mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ•mol-1
③COS(g)+H2O(g) H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
④CO(g)+H2S(g) COS(g)+H2(g) ΔH3
COS(g)+H2(g) ΔH3
则ΔH3=_______ kJ•mol-1。
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是_______ (填“甲”或“乙”)。
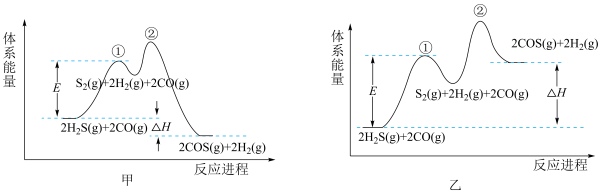
关于该反应的下列叙述正确的是_______ (填标号)。
A.步骤①是慢反应,活化能较大 B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物 D.更换催化剂可改变E和ΔH
(3)在240℃,将等物质的量H2S和CO充入恒压(100kPa)的密闭容器中发生反应:CO(g)+H2S(g) COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆=
COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆= kPa-1•s-1测得,则H2S的转化率为
kPa-1•s-1测得,则H2S的转化率为______ ,COS的体积分数为______ 。在240℃下,要同时提高CO和H2S的转化率,可采取的措施是______ 。
(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)=φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t)的变化关系如图所示。

320℃时,φ(COS)随时间变化关系的曲线是______ ,判断的理由是_______ 。
(1)已知:①CO的燃烧热为283kJ•mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ•mol-1
③COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
H2S(g)+CO2(g) ΔH2=-18kJ•mol-1④CO(g)+H2S(g)
 COS(g)+H2(g) ΔH3
COS(g)+H2(g) ΔH3则ΔH3=
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是

关于该反应的下列叙述正确的是
A.步骤①是慢反应,活化能较大 B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物 D.更换催化剂可改变E和ΔH
(3)在240℃,将等物质的量H2S和CO充入恒压(100kPa)的密闭容器中发生反应:CO(g)+H2S(g)
 COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆=
COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆= kPa-1•s-1测得,则H2S的转化率为
kPa-1•s-1测得,则H2S的转化率为(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)=φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t)的变化关系如图所示。

320℃时,φ(COS)随时间变化关系的曲线是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】(1)将NO2球置于热水中,气体颜色_____ (填“加深”、“变浅”),说明2NO2(g) N2O4(g)
N2O4(g)  H
H______ 0(填“>”、“<”)。
(2)硫代硫酸钠溶液与稀硫酸混合,反应的离子方程式为____________ 。
(3)向淀粉碘化钾试纸上加入几滴稀硫酸,一段时间后,试纸变蓝,发生反应的离子方程式为_____ 。
(4)已知 液态肼(N2H4)和足量
液态肼(N2H4)和足量 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出 的热量。写出该反应的热化学方程式
的热量。写出该反应的热化学方程式__ 。
(5)已知下列热化学方程式:
①

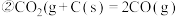
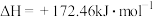
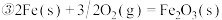
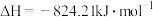
写出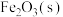 被CO还原成Fe和
被CO还原成Fe和 的热化学方程式
的热化学方程式____________ 。
 N2O4(g)
N2O4(g)  H
H(2)硫代硫酸钠溶液与稀硫酸混合,反应的离子方程式为
(3)向淀粉碘化钾试纸上加入几滴稀硫酸,一段时间后,试纸变蓝,发生反应的离子方程式为
(4)已知
 液态肼(N2H4)和足量
液态肼(N2H4)和足量 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出 的热量。写出该反应的热化学方程式
的热量。写出该反应的热化学方程式(5)已知下列热化学方程式:
①


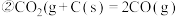
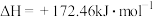
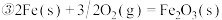
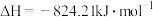
写出
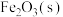 被CO还原成Fe和
被CO还原成Fe和 的热化学方程式
的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。请回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)⇌CH3OH(g) △H=-90.1kJ/mol
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
已知:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.0kJ/mol
则2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)的△H=________
(2)T1K时,将1mol二甲醚引入一个抽真空的150L恒容密闭容器中,发生分解反应CH3OCH3(g)⇌CH4(g)+H2(g)+CO(g)。
在不同时间测定容器内的总压,所得数据见下表,
①由表中数据计算,0~6.5min内的平均反应速率)(CH3OCH3)=___
mol⋅L-1⋅min-1(结果保留两位有效数字)反应达平衡时,二甲醚的分解率为___ ,该温度下平衡常数K=___ 。
②反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为___ 反应(填“放热”或“吸热”)。
在T2K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)=CH3CHO(g)
反应速率v=v正-v逆=k正p(CO)⋅p(CH4)-k逆p(CH3HO),k正、k逆分别为k正、k逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5kPa-1,则CO的转化率为20%时, =
=___ 。
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)⇌CH3OH(g) △H=-90.1kJ/mol
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
已知:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.0kJ/mol
则2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)的△H=
(2)T1K时,将1mol二甲醚引入一个抽真空的150L恒容密闭容器中,发生分解反应CH3OCH3(g)⇌CH4(g)+H2(g)+CO(g)。
在不同时间测定容器内的总压,所得数据见下表,
| 反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
| 气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算,0~6.5min内的平均反应速率)(CH3OCH3)=
mol⋅L-1⋅min-1(结果保留两位有效数字)反应达平衡时,二甲醚的分解率为
②反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为
在T2K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)=CH3CHO(g)
反应速率v=v正-v逆=k正p(CO)⋅p(CH4)-k逆p(CH3HO),k正、k逆分别为k正、k逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5kPa-1,则CO的转化率为20%时,
 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)化学反应的过程都是旧键断裂、新键形成的过程。对于反应:H2+I2 2HI,已知断开1mol H—H键、1mol I—I键分别需要吸收的能量是436kJ和151kJ,形成1mol H—I键需要放出的能量是299kJ。
2HI,已知断开1mol H—H键、1mol I—I键分别需要吸收的能量是436kJ和151kJ,形成1mol H—I键需要放出的能量是299kJ。
①1mol H2和1mol I2完全反应,反应物断键吸收的总能量是___ kJ,生成物成键放出的总能量为___ kJ,反应共_____ (填“放出”或“吸收”)能量____ kJ。
②如图,能够反映该反应能量变化的图象是____ (填“A”或“B”)。

(2)如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为_____ 极,电极上发生的是_____ (填“氧化”或“还原”)反应,电极反应式为_________ ,锌片上观察到的现象为_______ 。银为_____ 极,电极上发生的是_____ (填“氧化”或“还原”)反应,电极反应式是___________ ,银片上观察到的现象是_______ 。

 2HI,已知断开1mol H—H键、1mol I—I键分别需要吸收的能量是436kJ和151kJ,形成1mol H—I键需要放出的能量是299kJ。
2HI,已知断开1mol H—H键、1mol I—I键分别需要吸收的能量是436kJ和151kJ,形成1mol H—I键需要放出的能量是299kJ。①1mol H2和1mol I2完全反应,反应物断键吸收的总能量是
②如图,能够反映该反应能量变化的图象是

(2)如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 Ⅰ.化学反应与能量变化对人类生产、生活有重要的意义。回答下列问题:
(1)下列化学反应中的能量变化关系与图示相符合的是___________。
Ⅱ.汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图所示:___________ (填“吸收”或“放出”)___________ kJ热量,该反应的反应物的总能量___________ (填“大于”“等于”或“小于”)生成物的总能量。
Ⅲ.2023年6月9~11日,世界动力电池大会在宜宾举行,宜宾在电池研发、制造领域走在世界前列。利用原电池原理,人们研制出很多结构和性能各异的化学电池。回答下列问题:
(3)某化学小组设计出如下图所示的甲、乙、丙三套装置。___________ 装置(填“甲”、“乙”或“丙”),该装置中Cu电极的电极反应式为___________ 。
(4)铅酸蓄电池放电时发生反应: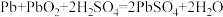 。该电池的负极材料为
。该电池的负极材料为___________ (填化学式)
(5)氢氧燃料电池的简易装置如下图所示。___________ (填“正极”或“负极”)。
②若线路中转移2mol电子,则该燃料电池理论上消耗的气体b在标准状况下的体积为___________ L。
(1)下列化学反应中的能量变化关系与图示相符合的是___________。
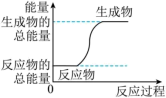
A.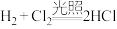 | B.天然气的燃烧 |
C. | D. |
Ⅱ.汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图所示:
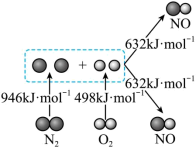
Ⅲ.2023年6月9~11日,世界动力电池大会在宜宾举行,宜宾在电池研发、制造领域走在世界前列。利用原电池原理,人们研制出很多结构和性能各异的化学电池。回答下列问题:
(3)某化学小组设计出如下图所示的甲、乙、丙三套装置。
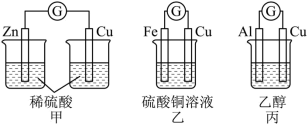
(4)铅酸蓄电池放电时发生反应:
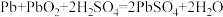 。该电池的负极材料为
。该电池的负极材料为(5)氢氧燃料电池的简易装置如下图所示。
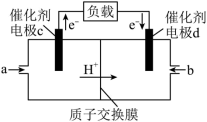
②若线路中转移2mol电子,则该燃料电池理论上消耗的气体b在标准状况下的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】原电池电极方程式的书写
I.氢氧燃料电池 氢氧燃烧电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为活化电极,具有很强的催化活性,如铂电极、活性炭电极等。
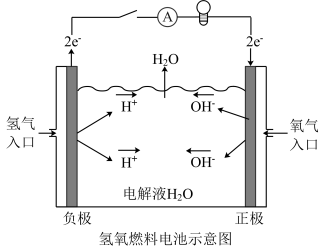
(1)电解质溶液为40%的KOH溶液。电极反应为:
负极:_______
正极:_______
电池的总反应式为:_______
(2)电解质溶液为H2SO4溶液。电极反应为:
负极:_______
正极:_______
电池的总反应式为:_______
(3)电解质溶液为Na2SO4溶液。电极反应为:
负极:_______
正极:_______
电池的总反应式为:_______
II.甲烷燃料电池 该电池用金属铂片插入KOH溶液中作电极,又在两极上分别通甲烷和氧气。
(4)电极反应式为:
负极:_______
正极:_______
电池总反应为:_______ 。
电池工作时,KOH被_______ ,溶液pH值_______ 。
I.氢氧燃料电池 氢氧燃烧电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为活化电极,具有很强的催化活性,如铂电极、活性炭电极等。

(1)电解质溶液为40%的KOH溶液。电极反应为:
负极:
正极:
电池的总反应式为:
(2)电解质溶液为H2SO4溶液。电极反应为:
负极:
正极:
电池的总反应式为:
(3)电解质溶液为Na2SO4溶液。电极反应为:
负极:
正极:
电池的总反应式为:
II.甲烷燃料电池 该电池用金属铂片插入KOH溶液中作电极,又在两极上分别通甲烷和氧气。
(4)电极反应式为:
负极:
正极:
电池总反应为:
电池工作时,KOH被
您最近一年使用:0次



