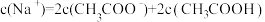20℃时H2S饱和溶液1L,其浓度为0.1mol/L,若要使溶液的pH和c(S2-)减小,可采取的措施是
| A.通入适量的H2S气体 | B.加入少量的氢氧化钠固体 |
| C.加入适量的CuSO4固体 | D.加入适量水 |
更新时间:2016-12-09 09:45:36
|
【知识点】 弱电解质电离平衡的影响因素
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列关于水的说法正确的是( )
| A.对于常温下pH=2的盐酸,由H2O电离出的c(H+)=1.0×10-12mol·L-1 |
| B.水中加入NaHSO4溶液对水的电离平衡不产生影响 |
| C.在蒸馏水中滴加浓H2SO4,KW不变 |
| D.现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,水的电离程度始终增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列叙述正确的是
| A.pH=7的溶液一定呈中性 |
| B.pH=3的醋酸溶液稀释10倍后pH=4 |
| C.0.2mol•L-1盐酸与等体积水混合后pH=1 |
| D.pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合后pH=7 |
您最近一年使用:0次

 变化较大的是③
变化较大的是③