A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是____ ,E元素在周期表中的位置是_____________________ ;
(2)B、D、F的气态氢化物稳定性由强到弱的顺序是______________ (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是_______________ ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于_____________ 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为__________________ ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为:___________________ 。
(1)A元素的名称是
(2)B、D、F的气态氢化物稳定性由强到弱的顺序是
(3)E单质在足量D单质中燃烧生成的化合物的电子式是
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于
②X与Y的水溶液相混合发生反应的离子方程式为
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为:
9-10高三·四川成都·阶段练习 查看更多[1]
(已下线)2010年四川省成都市2011届高中毕业班摸底测试化学试题
更新时间:2016-12-09 00:48:57
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】科学家最近首次发现像大脑一样学习的材料—— 。某小组以接触法制硫酸的废催化剂(主要成分是
。某小组以接触法制硫酸的废催化剂(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如下:
的流程如下: 难溶于水,
难溶于水, 易溶于水;
易溶于水;
②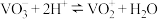
③几种金属离子氢氧化物沉淀的 。
。
请回答下列问题:
(1)“碱浸”中提高反应速率的可行措施有___________ (答出两条)。
(2)有人建议:在“酸浸”和“调 ”之间加入适量双氧水,理由是
”之间加入适量双氧水,理由是___________ 。
(3)理论上,为实现 完全沉淀,应调节
完全沉淀,应调节 ,在工业生产中,常调节
,在工业生产中,常调节 ,其目的是
,其目的是___________ (用化学用语和必要的文字说明)。
(4)“高温还原”中试剂X可能是 ,如果制备等量的
,如果制备等量的 (氧化产物都是
(氧化产物都是 ),则还原剂
),则还原剂 的物质的量之比为
的物质的量之比为___________ 。
(5)“煅烧2”需要在流动空气中煅烧的目的是___________ 。
(6)将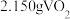 产品溶于强碱溶液,加热煮沸,淍节
产品溶于强碱溶液,加热煮沸,淍节 为8.5,把溶液稀释成
为8.5,把溶液稀释成 溶液,取
溶液,取 稀释后的溶液于锥形瓶中,加入酼酸酸化的KI溶液(过量),溶液中的还原产物为V3+,滴加指示剂,用0.10mol∙L−1Na2S2O3溶液滴定,重复三次,溶液中测得数据如下表所示:
稀释后的溶液于锥形瓶中,加入酼酸酸化的KI溶液(过量),溶液中的还原产物为V3+,滴加指示剂,用0.10mol∙L−1Na2S2O3溶液滴定,重复三次,溶液中测得数据如下表所示:
该产品的纯度为___________ %(保留3位有效数字)。如果加入稀酼酸过多,会使测定结果偏高,其原因是___________ (用离子方程式表示)。
 。某小组以接触法制硫酸的废催化剂(主要成分是
。某小组以接触法制硫酸的废催化剂(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如下:
的流程如下:
 难溶于水,
难溶于水, 易溶于水;
易溶于水;②
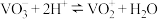
③几种金属离子氢氧化物沉淀的
 。
。| 金属氢氧化物 |  |  |  |
开始沉淀的 | 2.7 | 4.0 | 4.6 |
完全沉淀的 | 3.7 | 5.2 | 6.0 |
(1)“碱浸”中提高反应速率的可行措施有
(2)有人建议:在“酸浸”和“调
 ”之间加入适量双氧水,理由是
”之间加入适量双氧水,理由是(3)理论上,为实现
 完全沉淀,应调节
完全沉淀,应调节 ,在工业生产中,常调节
,在工业生产中,常调节 ,其目的是
,其目的是(4)“高温还原”中试剂X可能是
 ,如果制备等量的
,如果制备等量的 (氧化产物都是
(氧化产物都是 ),则还原剂
),则还原剂 的物质的量之比为
的物质的量之比为(5)“煅烧2”需要在流动空气中煅烧的目的是
(6)将
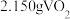 产品溶于强碱溶液,加热煮沸,淍节
产品溶于强碱溶液,加热煮沸,淍节 为8.5,把溶液稀释成
为8.5,把溶液稀释成 溶液,取
溶液,取 稀释后的溶液于锥形瓶中,加入酼酸酸化的KI溶液(过量),溶液中的还原产物为V3+,滴加指示剂,用0.10mol∙L−1Na2S2O3溶液滴定,重复三次,溶液中测得数据如下表所示:
稀释后的溶液于锥形瓶中,加入酼酸酸化的KI溶液(过量),溶液中的还原产物为V3+,滴加指示剂,用0.10mol∙L−1Na2S2O3溶液滴定,重复三次,溶液中测得数据如下表所示:| 序号 | 起始读数 | 终点读数 |
| ① | 0.20 | 21.55 |
| ② | 0.02 | 20.12 |
| ③ | 0.03 | 19.93 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】工业上制取硝酸铵的流程图如图,请回答下列问题:
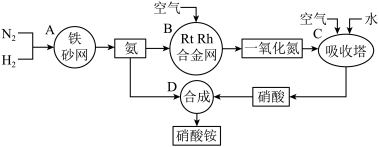
(1)在工业制硝酸的生产中,B中发生反应的化学方程式为_______ 。
(2)在合成硝酸的吸收塔中通入空气的目的是_______ 。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:_______NH3+_______NO2=_______N2+_______H2O
①配平上述反应的化学方程式_______ 。
②以上两种方法中,符合绿色化学的是_______ 。
③NH3还原法中氧化产物和还原产物的物质的量之比_______ 。
(4)过量的铁与稀硝酸反应的离子方程式_______ 。
(5)1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况)。向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。
①该合金中铜与镁的物质的量之比是_______ 。
②得到2.54 g沉淀时,加入NaOH溶液的体积是______ 。
③NO2和N2O4的混合气体中,NO2的体积分数是_______ 。

(1)在工业制硝酸的生产中,B中发生反应的化学方程式为
(2)在合成硝酸的吸收塔中通入空气的目的是
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:_______NH3+_______NO2=_______N2+_______H2O
①配平上述反应的化学方程式
②以上两种方法中,符合绿色化学的是
③NH3还原法中氧化产物和还原产物的物质的量之比
(4)过量的铁与稀硝酸反应的离子方程式
(5)1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况)。向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。
①该合金中铜与镁的物质的量之比是
②得到2.54 g沉淀时,加入NaOH溶液的体积是
③NO2和N2O4的混合气体中,NO2的体积分数是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂 可由
可由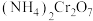 加热分解制备,反应同时生成无污染气体。
加热分解制备,反应同时生成无污染气体。
①完成化学方程式: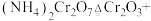 ______
______ 。
。_______ 。
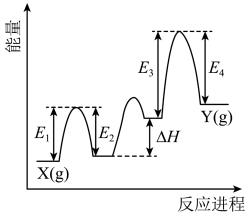
② 催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为
催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为_______ (列式表示)。
(2)用重铬酸钾法(一种氧化还原滴定法)可测定产物 中的
中的 含量,请写出酸性条件下K2Cr2O7与
含量,请写出酸性条件下K2Cr2O7与 反应的离子方程式
反应的离子方程式_______ (K2Cr2O7被还原为 )。
)。
(3)若需配制浓度为 的
的 标准溶液250mL,应准确称取K2Cr2O7
标准溶液250mL,应准确称取K2Cr2O7_______ g(保留四位有效数字,已知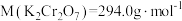 )。配制该标准溶液时,下列仪器一定不会用到的有
)。配制该标准溶液时,下列仪器一定不会用到的有_______ 。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(4)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果_______ (填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将_______ 。
(5)K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i)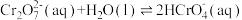

(ii)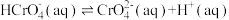
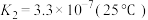
下列有关K2Cr2O7溶液的说法正确的有_______。
(1)催化剂
 可由
可由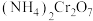 加热分解制备,反应同时生成无污染气体。
加热分解制备,反应同时生成无污染气体。①完成化学方程式:
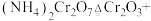 ______
______ 。
。②
 催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为
催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为
(2)用重铬酸钾法(一种氧化还原滴定法)可测定产物
 中的
中的 含量,请写出酸性条件下K2Cr2O7与
含量,请写出酸性条件下K2Cr2O7与 反应的离子方程式
反应的离子方程式 )。
)。(3)若需配制浓度为
 的
的 标准溶液250mL,应准确称取K2Cr2O7
标准溶液250mL,应准确称取K2Cr2O7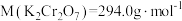 )。配制该标准溶液时,下列仪器一定不会用到的有
)。配制该标准溶液时,下列仪器一定不会用到的有①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(4)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果
(5)K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(i)
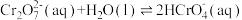

(ii)
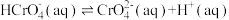
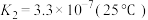
下列有关K2Cr2O7溶液的说法正确的有_______。
| A.加入少量硫酸,溶液的pH不变 |
| B.加入少量水稀释,溶液中离子总数增加 |
| C.加入少NaOH量溶液,反应(ⅰ)的平衡逆向移动 |
D.加入少量K2Cr2O7,固体,平衡时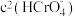 与 与 的比值保持不变 的比值保持不变 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】I.某实验小组同学欲探究二氧化硫的性质,并比较碳和硅的非金属性,设计了如图所示的A、B、C实验装置(各装置气密性良好)。已知:酸性:H2SO3>H2CO3,硅酸是一种不溶于水的白色胶状物。

(1)实验一:制备SO2烧瓶中发生反应的化学方程式是_______ 。
(2)实验二:研究SO2的性质:将A与B相连,待产生SO2后,可见B1中溴水逐渐褪色。B1中溴水褪色的原因是(用离子方程式表示)_______ 。
(3)实验三:比较碳、硅的非金属性:将A与C相连
①C2中试剂是_______ 。
②能说明碳的非金属性比硅强的实验现象是_______ 。
II.学习小组又设计了如下装置,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。(所配制的溶液均使用无氧蒸馏水)
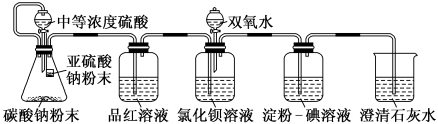
(4)加入碳酸钠粉末的目的是_______ 。
(5)当淀粉-碘溶液蓝色褪去时,氯化钡溶液中没有沉淀出现,说明_______ ,此时滴加双氧水,出现了白色沉淀。
(6)结合实验目的分析装置中选用澄清石灰水而不用氢氧化钠溶液的是_______ 。
(7)由图可知,制备硫酸铜可以用途径甲(反应I)或途径乙(反应II+III),从环保角度考虑,应选择途径_______ (选填“甲”或“乙”),理由是_______ 。
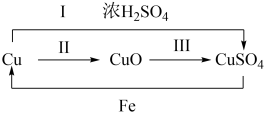

(1)实验一:制备SO2烧瓶中发生反应的化学方程式是
(2)实验二:研究SO2的性质:将A与B相连,待产生SO2后,可见B1中溴水逐渐褪色。B1中溴水褪色的原因是(用离子方程式表示)
(3)实验三:比较碳、硅的非金属性:将A与C相连
①C2中试剂是
②能说明碳的非金属性比硅强的实验现象是
II.学习小组又设计了如下装置,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。(所配制的溶液均使用无氧蒸馏水)

(4)加入碳酸钠粉末的目的是
(5)当淀粉-碘溶液蓝色褪去时,氯化钡溶液中没有沉淀出现,说明
(6)结合实验目的分析装置中选用澄清石灰水而不用氢氧化钠溶液的是
(7)由图可知,制备硫酸铜可以用途径甲(反应I)或途径乙(反应II+III),从环保角度考虑,应选择途径

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】下表是元素周期表的一部分,针对表中的①~⑦元素回答以下问题:
(1)在这些元素原子中,失电子能力最强的是________ (填元素符号)。
(2)单质化学性质最不活泼的元素是________ (填元素符号),其原子结构示意图为______ 。
(3)元素的最高价氧化物对应的水化物中呈两性的是______ (填化学式)。
(4)④、⑤所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是___________ (填化学式)。
(5)表中元素①的最高价氧化物对应的水化物所含化学键的类型是___________ 。
(6)写出元素③的单质与稀盐酸反应的化学方程式_________________________ 。
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ④ | ⑤ | ||||||
| 三 | ① | ② | ③ | ⑥ | ⑦ |
(1)在这些元素原子中,失电子能力最强的是
(2)单质化学性质最不活泼的元素是
(3)元素的最高价氧化物对应的水化物中呈两性的是
(4)④、⑤所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是
(5)表中元素①的最高价氧化物对应的水化物所含化学键的类型是
(6)写出元素③的单质与稀盐酸反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
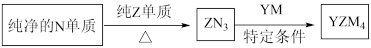
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(1)B元素的最简单氢化物的沸点是同族元素最简单氢化物中最高的,原因是________ 。
(2)A、B、C三种元素的最简单氢化物的稳定性由强到弱的顺序为____________ (用化学式表示)。
(3)A的最简单氢化物分子的立体构型为____________ ,其中A原子的杂化类型是____________ 杂化。
(4)A的单质中σ键的个数为____________ ,π键的个数为____________ 。
(5)写出基态E原子的价电子排布式:_____________________ 。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则晶胞边长a=____________ cm(用含ρ、NA的计算式表示)。
(1)B元素的最简单氢化物的沸点是同族元素最简单氢化物中最高的,原因是
(2)A、B、C三种元素的最简单氢化物的稳定性由强到弱的顺序为
(3)A的最简单氢化物分子的立体构型为
(4)A的单质中σ键的个数为
(5)写出基态E原子的价电子排布式:
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则晶胞边长a=
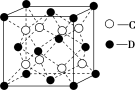
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】I.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_______________________________________________ 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为_______________ 。
II.A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:
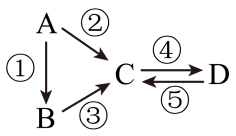
(3)若A是淡黄色单质固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式______________________________________ 。
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是________________ 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式________________________ 。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为
(2)W与Y可形成化合物W2Y,该化合物的电子式为
II.A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:

(3)若A是淡黄色单质固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】X、Y、Z、W为元素周期表前四周期的元素。其中X是形成化合物种类最多的元素,Y的内层电子数是最外层电子数的9倍,Z是元素周期表中电负性最大的元素,W元素的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题。
(1)W元素在元素周期表中的位置为______________________________ 。
(2)W2+能与氨气分子形成配离子[W(NH3)4]2+。写出该配离子的结构简式(标明配位键)_______ 。
(3)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为__________ ,1mol该分子中σ键的数目为______________ ,该物质易溶于水的主要原因是________________ 。
(4)X的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为______________________ 。
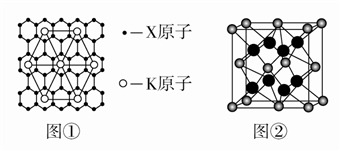
(5)元素Y与元素Z形成的晶胞结构如图②所示,该晶胞中Y离子周围最近的Z的离子为___ 个。
(1)W元素在元素周期表中的位置为
(2)W2+能与氨气分子形成配离子[W(NH3)4]2+。写出该配离子的结构简式(标明配位键)
(3)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为
(4)X的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为

(5)元素Y与元素Z形成的晶胞结构如图②所示,该晶胞中Y离子周围最近的Z的离子为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】几种短周期元素的原子半径及化合价见下表:
分析上表中有关数据,结合已学过的知识,回答以下问题。
涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中的位置是___________ 。
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)____________ 。
(3)用电子式表示A与I所形成化合物的形成过程__________________ 。
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为__________________ ;
(5)用B与D所形成的化合物的化学式为__________________ ,属于___________ 晶体。
元素代号 | A | B | D | E | G | H | I | J |
化合价 | -1 | -2 | +4、-4 | +6、-2 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.130 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中的位置是
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)
(3)用电子式表示A与I所形成化合物的形成过程
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为
(5)用B与D所形成的化合物的化学式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】A、B、C、D是短周期中四种非金属元素,它们的原子序数依次增大.A元素原子核外只有一个电子.C、D元素在周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍,而D原子的最外层电子数是内层电子数的3倍.请回答下列问题:
(1)写出元素符号:A____________ D___________ .
(2)B元素在元素周期表中的位置是第_________ 周期、第__________ 族.
(3)A的单质和C的单质在一定条件下反应生成化合物X,X的化学式__________ ;向X 的水溶液中滴入酚酞溶液,会观察到__________ .
(1)写出元素符号:A
(2)B元素在元素周期表中的位置是第
(3)A的单质和C的单质在一定条件下反应生成化合物X,X的化学式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne 具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL 2 mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件完成下列问题:
(1)元素C位于第____________ 周期第_____________ 族,它的最高价氧化物的化学式为______________ 。
(2)A元素是____________ , B 元素是_____________ , D元素是_____________ 。
(3)A与D形成稳定化合物的化学式是______________ ,该化合物中存在化学键类型为_______________ ,判断该化合物在空气中是否变质的简单方法是____________________ 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为____________________ 。
(1)元素C位于第
(2)A元素是
(3)A与D形成稳定化合物的化学式是
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
您最近一年使用:0次



