海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。

根据示意图回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时所用试剂为盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是_______ 、_____ 、______ 、_______ 。
(2)电解饱和食盐水的总反应的化学方程式为___________________________ 。
(3)工业上MgCl2·6H2O晶体在____________ 气氛中加热脱水,通入此种气体的作用是______________________________________________________________________ 。

根据示意图回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时所用试剂为盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是
(2)电解饱和食盐水的总反应的化学方程式为
(3)工业上MgCl2·6H2O晶体在
10-11高三上·福建漳州·阶段练习 查看更多[1]
(已下线)2010年福建省漳州三中高三上学期第二次月考试卷化学试题
更新时间:2016-12-09 00:58:11
|
相似题推荐
【推荐1】肺炎重症患者肺部功能严重受损时,需通过气管切开术指了。手术力的材料主要是钛合金。金属钛熔点高、强度高且质地轻。工业上以钛铁矿(主要成分为FeTiO3)为原料冶炼金属钛的流程如下:

已知:室温下钛不与X2(X表示Cl、Br、I)、O2、H2O反应,也不与强酸、强碱甚至王水反应。但高温下易与氧气、氮气、碳和氢气反应。
回答下列问题。
(1)“溶煮”过程中加硫酸时生成Ti(SO4)2,该过程的离子方程式为__________ 。
(2)“溶煮”过程中同时加入物质A,其目的是防止Fe2+被氧化,物质A是_______ 。
(3)已知在不同温度时硫酸亚铁在钛液中的溶解度如下表(数据以含铁量来折算)。则“操作a”为______ 。
(4)“过滤1”后加热滤液,使其中的Ti4+生成偏钛酸(H2TiO3)沉淀。常温下H2TiO3的沉淀溶解平衡为H2TiO3(s) TiO2++2OH-,其溶度积常数Ksp=1.0×10-29,则“过滤2”所得溶液的pH约为
TiO2++2OH-,其溶度积常数Ksp=1.0×10-29,则“过滤2”所得溶液的pH约为__________ (已知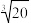 ≈2.7,
≈2.7,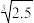 ≈1.35,lg2.7≈0.43)
≈1.35,lg2.7≈0.43)
(5)煅烧偏钛酸得到TiO2,TiO2与氯气和过量焦炭共热生成TiCl4,写出“共热”过程中的化学方程式:____________ 。
(6)“高温”过程需要在Ar气氛中进行的理由是____________ ;利用上述方法制得的钛中可能会含有少量金属杂质___________ ,可用___________ 除去。

已知:室温下钛不与X2(X表示Cl、Br、I)、O2、H2O反应,也不与强酸、强碱甚至王水反应。但高温下易与氧气、氮气、碳和氢气反应。
回答下列问题。
(1)“溶煮”过程中加硫酸时生成Ti(SO4)2,该过程的离子方程式为
(2)“溶煮”过程中同时加入物质A,其目的是防止Fe2+被氧化,物质A是
(3)已知在不同温度时硫酸亚铁在钛液中的溶解度如下表(数据以含铁量来折算)。则“操作a”为
| 温度/℃ | 30 | 20 | 14 | 10 | 5 | 1 | -6 |
| 溶解度/(g∙L-1) | 88 | 70 | 48 | 43 | 35 | 25 | 14 |
(4)“过滤1”后加热滤液,使其中的Ti4+生成偏钛酸(H2TiO3)沉淀。常温下H2TiO3的沉淀溶解平衡为H2TiO3(s)
 TiO2++2OH-,其溶度积常数Ksp=1.0×10-29,则“过滤2”所得溶液的pH约为
TiO2++2OH-,其溶度积常数Ksp=1.0×10-29,则“过滤2”所得溶液的pH约为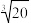 ≈2.7,
≈2.7,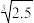 ≈1.35,lg2.7≈0.43)
≈1.35,lg2.7≈0.43)(5)煅烧偏钛酸得到TiO2,TiO2与氯气和过量焦炭共热生成TiCl4,写出“共热”过程中的化学方程式:
(6)“高温”过程需要在Ar气氛中进行的理由是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
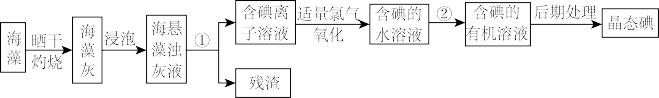
(1)指出制取碘的过程中①、②的实验操作名称:①_______ ;②_______ 。
(2)提取碘的过程中,不能使用的有机溶剂是___ ,
A.酒精 B.苯 C.汽油 D.四氯化碳
该提取操作通常在___ (仪器名称)中进行。
(3)写出氧化过程的离子方程式___ 。
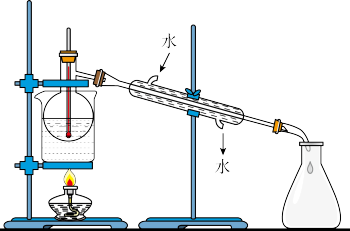
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察上述实验装置指出其错误之处,并加以改正。______ 、_______ 、_______ 。
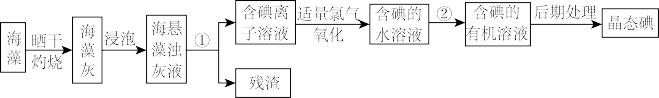
(1)指出制取碘的过程中①、②的实验操作名称:①
(2)提取碘的过程中,不能使用的有机溶剂是
A.酒精 B.苯 C.汽油 D.四氯化碳
该提取操作通常在
(3)写出氧化过程的离子方程式
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察上述实验装置指出其错误之处,并加以改正。

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含Cu2+、Fe2+、Fe3+、Ca2+、Mg2+、Zn2+等)为原料,经过如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。
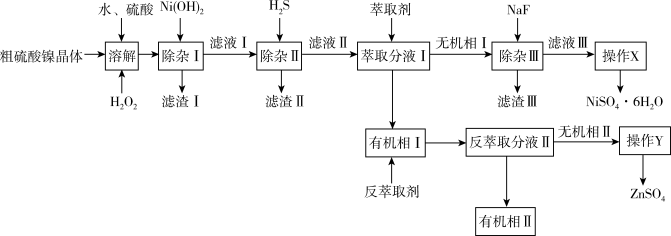
(1)滤渣Ⅰ的主要成分是_____ 。
(2)写出除杂Ⅱ的离子方程式:_____ 。
(3)①萃取分液Ⅰ选用的萃取剂一般为P204[二(2—乙基己基)磷酸酯],其萃取原理为:2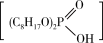 +Zn2+
+Zn2+
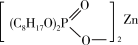 +2H+。Zn2+被P204萃取的能力随pH的升高而
+2H+。Zn2+被P204萃取的能力随pH的升高而_____ (填“降低”、“不变”或“升高”)。
②反萃取是用反萃取剂使被萃取物从负载有机相返回水相的过程,为萃取的逆过程。反萃取剂可以选择下列哪种物质_____ (填选项)。
A.H2SO4溶液 B.NaOH溶液 C.ZnSO4溶液
(4)已知25℃时,Ksp(CaF2)=3.95×10-11;Ksp(MgF2)=6.40×10-9。则滤液Ⅲ中 =
=_____ 。(保留3位有效数字)
(5)从“滤液Ⅲ”中获得精制硫酸镍(NiSO4·6H2O)所需采取的“操作X”是_____ 、_____ 、过滤、洗涤、干燥。
(6)称取1.00g上述方法制得的硫酸镍晶体(NiSO4·6H2O)样品溶于蒸馏水,定容至250mL。取25.00mL试液,加入过量的0.02mol/L的EDTA(Na2H2Y)标准溶液25.00mL,摇匀,再加入相应的指示剂,用0.01mol/L标准硫酸锌溶液返滴定,待滴定至终点,记录数据。重复实验,3次平均消耗硫酸锌标准溶液为23.50mL。反应为M2++H2Y2-=MY2-+2H+(M代表Ni或者Zn)。计算样品纯度为_____ 。(保留3位有效数字)

(1)滤渣Ⅰ的主要成分是
(2)写出除杂Ⅱ的离子方程式:
(3)①萃取分液Ⅰ选用的萃取剂一般为P204[二(2—乙基己基)磷酸酯],其萃取原理为:2
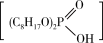 +Zn2+
+Zn2+
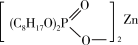 +2H+。Zn2+被P204萃取的能力随pH的升高而
+2H+。Zn2+被P204萃取的能力随pH的升高而②反萃取是用反萃取剂使被萃取物从负载有机相返回水相的过程,为萃取的逆过程。反萃取剂可以选择下列哪种物质
A.H2SO4溶液 B.NaOH溶液 C.ZnSO4溶液
(4)已知25℃时,Ksp(CaF2)=3.95×10-11;Ksp(MgF2)=6.40×10-9。则滤液Ⅲ中
 =
=(5)从“滤液Ⅲ”中获得精制硫酸镍(NiSO4·6H2O)所需采取的“操作X”是
(6)称取1.00g上述方法制得的硫酸镍晶体(NiSO4·6H2O)样品溶于蒸馏水,定容至250mL。取25.00mL试液,加入过量的0.02mol/L的EDTA(Na2H2Y)标准溶液25.00mL,摇匀,再加入相应的指示剂,用0.01mol/L标准硫酸锌溶液返滴定,待滴定至终点,记录数据。重复实验,3次平均消耗硫酸锌标准溶液为23.50mL。反应为M2++H2Y2-=MY2-+2H+(M代表Ni或者Zn)。计算样品纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】海洋是一座巨大的化学资源宝库,从海水中或海产品中提取多种化学物质。
I.试剂级 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:
(1)
焙炒海盐的目的是___________ 。
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
其中步骤2和步骤3是否可以颠倒,请给出解释:___________ 。
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

Ⅱ.实验室模拟工业从海藻中提碘的流程如图:
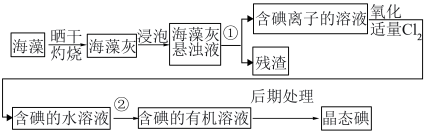
(4)选择合适实验操作名称填入流程图中:①___________ ,②___________ 。(可多选)
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误___________ 。
(6)
装置 中,温度计所处的正确位置是
中,温度计所处的正确位置是___________ 。(选填编号)

Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为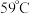 ,微溶于水,有毒。
,微溶于水,有毒。
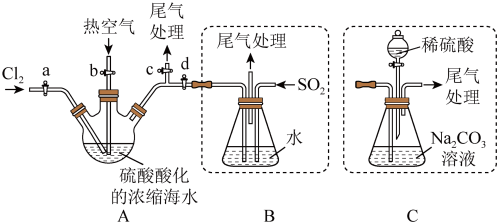
①连接 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量 ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量 ;
;
⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为___________ 。
(8)进行步骤③时,B中尾气可用___________吸收处理。
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(10)与B装置相比,采用C装置的优点为___________ 。
I.试剂级
 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:(1)

焙炒海盐的目的是
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | 略过量 |  、 、 |
| 步骤2 | 略过量 |  |
| 步骤3 | 略过量 |  |
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

| A.铂片上发生还原反应 |
| B.铂片端作阴极 |
| C.铅笔端有少量的氯气产生 |
| D.a连接的是电源负极 |
Ⅱ.实验室模拟工业从海藻中提碘的流程如图:

(4)选择合适实验操作名称填入流程图中:①
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误
(6)

装置
 中,温度计所处的正确位置是
中,温度计所处的正确位置是
Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含
 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为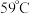 ,微溶于水,有毒。
,微溶于水,有毒。
①连接
 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量
 ;
;④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量
 ;
;⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为
(8)进行步骤③时,B中尾气可用___________吸收处理。
| A.水 | B.浓硫酸 | C. 溶液 溶液 | D.饱和 溶液 溶液 |
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、
 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为(10)与B装置相比,采用C装置的优点为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:
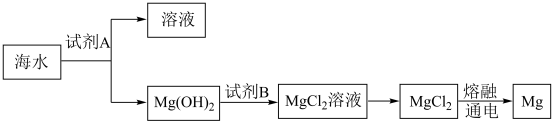
①Mg(OH)2转化为MgCl2的离子方程式是______________ 。
②由无水MgCl2制取Mg的化学方程式是_______________ 。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
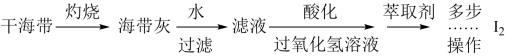
①灼烧所用仪器是下列中的哪一种_____________ (填字母序号)。
a. 蒸发皿 b. 坩埚 c. 烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2,请写出该反应的离子方程式:____ 。
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是______ (填字母序号).
a. 乙酸 b. 四氯化碳 c. 硝酸 d. 苯
(1)下图是从海水中提取镁的简单流程:

①Mg(OH)2转化为MgCl2的离子方程式是
②由无水MgCl2制取Mg的化学方程式是
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
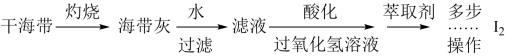
①灼烧所用仪器是下列中的哪一种
a. 蒸发皿 b. 坩埚 c. 烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2,请写出该反应的离子方程式:
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是
a. 乙酸 b. 四氯化碳 c. 硝酸 d. 苯
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】海盐(含泥沙、 、
、 、
、 、
、 、
、 等杂质)可用于制备试剂级
等杂质)可用于制备试剂级 。流程如图所示:
。流程如图所示:

回答下列问题:
(1)从物质分类的角度看,海盐属于_______ 。
(2)除杂时能除去一些可溶性杂质离子,在表中填写除杂时依次添加的试剂及其预期沉淀的离子:
(3)制得的试剂级 晶体中一定还有的杂质阳离子为
晶体中一定还有的杂质阳离子为_______ 。请设计实验检验该杂质离子_______ (简述实验操作与现象)。
(4)称取制得的试剂级 晶体
晶体 ,加蒸馏水溶解,通过阳离子交换树脂(用
,加蒸馏水溶解,通过阳离子交换树脂(用 表示),将溶液中的少量杂质阳离子全部转化为钠离子(如图),反应的离子方程式为
表示),将溶液中的少量杂质阳离子全部转化为钠离子(如图),反应的离子方程式为_______ 。收集纯氯化钠溶液蒸发结晶,得到固体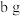 ,则制得试剂级
,则制得试剂级 晶体中杂质阳离子的物质的量为
晶体中杂质阳离子的物质的量为_______  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。

 、
、 、
、 、
、 、
、 等杂质)可用于制备试剂级
等杂质)可用于制备试剂级 。流程如图所示:
。流程如图所示:
回答下列问题:
(1)从物质分类的角度看,海盐属于
(2)除杂时能除去一些可溶性杂质离子,在表中填写除杂时依次添加的试剂及其预期沉淀的离子:
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 |  溶液 溶液 |  和 和 |
| 步骤2 | ||
| 步骤3 |
 晶体中一定还有的杂质阳离子为
晶体中一定还有的杂质阳离子为(4)称取制得的试剂级
 晶体
晶体 ,加蒸馏水溶解,通过阳离子交换树脂(用
,加蒸馏水溶解,通过阳离子交换树脂(用 表示),将溶液中的少量杂质阳离子全部转化为钠离子(如图),反应的离子方程式为
表示),将溶液中的少量杂质阳离子全部转化为钠离子(如图),反应的离子方程式为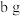 ,则制得试剂级
,则制得试剂级 晶体中杂质阳离子的物质的量为
晶体中杂质阳离子的物质的量为 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
您最近一年使用:0次



