研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=________ kJ/mol。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________ 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
(1)已知:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol2NO(g)+O2(g)
 2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
更新时间:2016-12-09 15:42:45
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】从能量变化和反应快慢等角度研究化学反应具有重要意义。
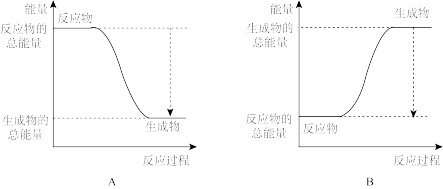
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应,下图能正确表示该反应中能量变化的是
2NH3为放热反应,下图能正确表示该反应中能量变化的是___________ ;(填“A”或“B”)
(2)研究高效催化剂是解决汽车尾气中的NO和CO对大气污染的重要途径。
已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ/mol
C(s)+ O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
则汽车尾气的催化转化反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H =___________ kJ/mol。
(3)某兴趣小组为研究原电池原理,设计下图装置。

①Cu为原电池___________ 极(填“正”或“负”),其电极反应式是___________ ;
②溶液中SO 移向
移向___________ (填“Cu”或“Zn”极)。当负极金属溶解13.0 g时,通过导线的电子数___________ 。
③甲烷(CH4)燃料电池在碱性介质(电解质为KOH溶液)中的电极反应方程式:
负极:___________ ,正极:___________ 。
(1)已知一定条件下,反应N2+3H2
 2NH3为放热反应,下图能正确表示该反应中能量变化的是
2NH3为放热反应,下图能正确表示该反应中能量变化的是
(2)研究高效催化剂是解决汽车尾气中的NO和CO对大气污染的重要途径。
已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ/mol
C(s)+
 O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/molN2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
则汽车尾气的催化转化反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H =
(3)某兴趣小组为研究原电池原理,设计下图装置。

①Cu为原电池
②溶液中SO
 移向
移向③甲烷(CH4)燃料电池在碱性介质(电解质为KOH溶液)中的电极反应方程式:
负极:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知:CH4(g)+4NO3(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48 LCH4还原NO2至N2,整个过程中转移的电子总数________ (阿伏伽德罗常数用NA表示),放出的热量为_________ kJ。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48 LCH4还原NO2至N2,整个过程中转移的电子总数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:___ .
(2)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1①
CO(g)+O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
C(石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1③
则4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为___
(2)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1①
CO(g)+O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
C(石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1③
则4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)某温度下在容积为2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
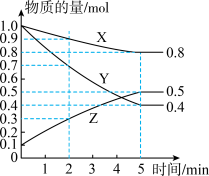
①该反应的化学方程式是___________ 。
②4min时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③下列措施能增大该反应速率的是___________ (选填字母)
A.升高温度 B.恒容条件下充入Ar气
C.减小Z的浓度 D.将反应容器体积缩小
(2)反应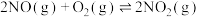 ,在一定温度下2L密闭容器内,能说明该反应已经达到化学平衡状态的是
,在一定温度下2L密闭容器内,能说明该反应已经达到化学平衡状态的是___________ 。
a.
b.容器内压强保持不变
c.
d.容器内的密度保持不变
e.容器内混合气体平均相对分子质量不变
f.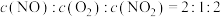
g.容器内气体颜色不变
(3)常见的烟道气中除去 的方法之一:
的方法之一: ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为___________ 。若在2L的密闭容器中进行上述反应,经测定在5min内气体的质量减少了1.6g,则0~5min的平均反应速率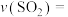
___________ 。
(1)某温度下在容积为2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是
②4min时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③下列措施能增大该反应速率的是
A.升高温度 B.恒容条件下充入Ar气
C.减小Z的浓度 D.将反应容器体积缩小
(2)反应
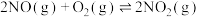 ,在一定温度下2L密闭容器内,能说明该反应已经达到化学平衡状态的是
,在一定温度下2L密闭容器内,能说明该反应已经达到化学平衡状态的是a.

b.容器内压强保持不变
c.

d.容器内的密度保持不变
e.容器内混合气体平均相对分子质量不变
f.
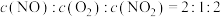
g.容器内气体颜色不变
(3)常见的烟道气中除去
 的方法之一:
的方法之一: ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为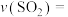
您最近一年使用:0次
【推荐2】在密闭容器中发生反应
 ,该反应达到平衡后,测得如下数据:
,该反应达到平衡后,测得如下数据:
(1)实验1中,10h后达到平衡,H2的平均反应速率为___________  。在此实验的平衡体系中,再加入1mol CO2和1mol H2,平衡将
。在此实验的平衡体系中,再加入1mol CO2和1mol H2,平衡将___________ (“向左”“向右”或“不”)移动。
(2)实验2中,x的值___________(填字母)。
(3)实验3中,y的值为___________ 。
(4)在100℃条件下,下列能说明该反应达到平衡状态的是 (填字母)
(5)对于上述反应,欲提高CO的平衡转化率,下列措施可行的是 。

 ,该反应达到平衡后,测得如下数据:
,该反应达到平衡后,测得如下数据:| 实验序号 | 温度 | 初始CO浓度( ) ) | 初始 浓度( 浓度( ) ) | CO的平衡转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后达到平衡,H2的平均反应速率为
 。在此实验的平衡体系中,再加入1mol CO2和1mol H2,平衡将
。在此实验的平衡体系中,再加入1mol CO2和1mol H2,平衡将(2)实验2中,x的值___________(填字母)。
| A.等于50% | B.小于50% | C.大于50% | D.无法确定 |
(4)在100℃条件下,下列能说明该反应达到平衡状态的是 (填字母)
| A.生成H2O的速率和消耗H2的速率相等 | B. H2的质量不再变化 |
| C.压强不再变化 | D.混合气体的密度不变 |
| A.增大初始时的H2O蒸汽的浓度 | B.增大反应容器的压强 |
| C.适当降低反应的温度 | D.使用更高效的催化剂 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】随着我国碳中和、碳达峰目标的确定, 的综合利用备受关注。
的综合利用备受关注。
已知 为放热反应,在固定容积为2.0L的密闭容器中充入0.8mol的
为放热反应,在固定容积为2.0L的密闭容器中充入0.8mol的 和2.4mol的
和2.4mol的 ,测得
,测得 和
和 的物质的量随时间变化如图。请回答:
的物质的量随时间变化如图。请回答:

(1)下列措施能加快反应速率的是___________。
(2)0-2min 的反应速率为
的反应速率为___________ 。
(3)第9分钟时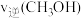
___________ (填“ ”“
”“ ”或“
”或“ ”)第3分钟时
”)第3分钟时 。
。
(4)恒容密闭条件下,能说明反应已达平衡状态的是___________。
(5)欲增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是___________ 、___________ 。(任填2项)
(6)已知T℃下 的平衡常数
的平衡常数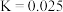 。保持容器温度不变,向1L的某密闭容器中充入
。保持容器温度不变,向1L的某密闭容器中充入 、
、 、
、 、
、 各1mol,反应一段时间后测得
各1mol,反应一段时间后测得 ,判断此时该可逆反应是否达到平衡,并说明理由(若末达到平衡需说明平衡移动方向)。
,判断此时该可逆反应是否达到平衡,并说明理由(若末达到平衡需说明平衡移动方向)。___________ 。
 的综合利用备受关注。
的综合利用备受关注。已知
 为放热反应,在固定容积为2.0L的密闭容器中充入0.8mol的
为放热反应,在固定容积为2.0L的密闭容器中充入0.8mol的 和2.4mol的
和2.4mol的 ,测得
,测得 和
和 的物质的量随时间变化如图。请回答:
的物质的量随时间变化如图。请回答:
(1)下列措施能加快反应速率的是___________。
A.往容器中充入 增大压强 增大压强 | B.及时分离出 |
| C.升高温度 | D.选择高效的催化剂 |
(2)0-2min
 的反应速率为
的反应速率为(3)第9分钟时
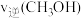
 ”“
”“ ”或“
”或“ ”)第3分钟时
”)第3分钟时 。
。(4)恒容密闭条件下,能说明反应已达平衡状态的是___________。
A.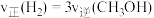 | B.混合气体的平均相对分子量不变 |
C.容器中 浓度与 浓度与 浓度之比为 浓度之比为 | D.混合气体的密度保持不变 |
(5)欲增大平衡时
 的转化率,可采取的措施是
的转化率,可采取的措施是(6)已知T℃下
 的平衡常数
的平衡常数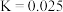 。保持容器温度不变,向1L的某密闭容器中充入
。保持容器温度不变,向1L的某密闭容器中充入 、
、 、
、 、
、 各1mol,反应一段时间后测得
各1mol,反应一段时间后测得 ,判断此时该可逆反应是否达到平衡,并说明理由(若末达到平衡需说明平衡移动方向)。
,判断此时该可逆反应是否达到平衡,并说明理由(若末达到平衡需说明平衡移动方向)。
您最近一年使用:0次



