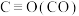蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。根据你所学的知识回答下列问题:
(1)碳元素在周期表中的位置是 ,甲烷是其简单气态氢化物,与水比较不稳定的是 ;
已知1g甲烷完全燃烧生成液态水时放热55.6kJ·mol-1,写出该反应的热化学方程式 。
(2)碳有多种同素异形体,C60所属的晶体类型为 ;金刚石熔化时破坏的作用力是 ;
金刚石、石墨的能量关系如图所示,则等质量的金刚石和石墨完全燃烧 (填“金刚石”或“石墨”)
放出热量更多,写出石墨转化为金刚石的热化学方程式 。
(3)工业上常利用甲烷制氢气,反应方程式为:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+160 kJ·mol-1;,现向容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol.L-1.s-1,则4s时剩余的甲烷的浓度为 ,反应 (填“放出”或“吸收”)热量;上述反应可以通过电解池来实现,电解液为硫酸钠溶液,电解过程能量的转化形式为 。
CO(g)+3H2(g) ΔH=+160 kJ·mol-1;,现向容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol.L-1.s-1,则4s时剩余的甲烷的浓度为 ,反应 (填“放出”或“吸收”)热量;上述反应可以通过电解池来实现,电解液为硫酸钠溶液,电解过程能量的转化形式为 。
(1)碳元素在周期表中的位置是 ,甲烷是其简单气态氢化物,与水比较不稳定的是 ;
已知1g甲烷完全燃烧生成液态水时放热55.6kJ·mol-1,写出该反应的热化学方程式 。
(2)碳有多种同素异形体,C60所属的晶体类型为 ;金刚石熔化时破坏的作用力是 ;
金刚石、石墨的能量关系如图所示,则等质量的金刚石和石墨完全燃烧 (填“金刚石”或“石墨”)
放出热量更多,写出石墨转化为金刚石的热化学方程式 。
(3)工业上常利用甲烷制氢气,反应方程式为:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+160 kJ·mol-1;,现向容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol.L-1.s-1,则4s时剩余的甲烷的浓度为 ,反应 (填“放出”或“吸收”)热量;上述反应可以通过电解池来实现,电解液为硫酸钠溶液,电解过程能量的转化形式为 。
CO(g)+3H2(g) ΔH=+160 kJ·mol-1;,现向容积为2L的密闭容器中分别通入2mol的甲烷和水蒸气,4s时测得氢气的反应速率为0.3mol.L-1.s-1,则4s时剩余的甲烷的浓度为 ,反应 (填“放出”或“吸收”)热量;上述反应可以通过电解池来实现,电解液为硫酸钠溶液,电解过程能量的转化形式为 。
更新时间:2019-01-30 18:14:09
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】氨气是重要的无机化工产品之一,氨的合成及应用均是工业上的研究热点。回答下列相关问题:
(1)比较① 、②
、② 、③NH3、④NF3键角由大到小的顺序为
、③NH3、④NF3键角由大到小的顺序为___________ 。(用序号表示)
(2)合成氨反应过程中各物质的物质的量(mol)与能量(kJ)变化如下图所示:(其中吸附在催化剂表面上的物种用*标注)

已知:H−H键能为435.8 kJ∙mol−1,N≡N键能为944.8 kJ∙mol−1,则N−H键能为___________ kJ∙mol−1
(3)氨的氧化是工业生产硝酸的重要步骤,反应方程式如下:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=−907.28 kJ∙mol−1①
除反应①外,还会发生下列两个副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) △H=−1104.9 kJ∙mol−1②
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=−1269.02 kJ∙mol−1③
三个反应的lgKp(Kp为压强平衡常数)与温度的关系图为___________ (填“a”或“b”)

由图可见反应③趋势最大,氨和氧气的反应的主要产物为氮气,但实际生产中NO产率可以达到95−97%,则采取的有效措施可能为___________ 。
(4)常温下氨水平衡体系中,各组分的分布系数δ与pH的关系如下图所示,X为NH3·H2O或 ,则NH3·H2O的电离常数Kb值为
,则NH3·H2O的电离常数Kb值为___________ 。(其中δ(X)= )
)

(5)一般采用氨水沉淀法去除Cr3+,我国(GB/T14848−93)规定生活用水中铬离子含量不超过10−4 mol∙L−1若处理后的废水溶液中c(NH4+)/c(NH3·H2O)=10,通过计算说明该溶液的铬离子含量是否符合标准___________ 。(已知Ksp[Cr(OH)3]≈1×10−31)
(1)比较①
 、②
、② 、③NH3、④NF3键角由大到小的顺序为
、③NH3、④NF3键角由大到小的顺序为(2)合成氨反应过程中各物质的物质的量(mol)与能量(kJ)变化如下图所示:(其中吸附在催化剂表面上的物种用*标注)

已知:H−H键能为435.8 kJ∙mol−1,N≡N键能为944.8 kJ∙mol−1,则N−H键能为
(3)氨的氧化是工业生产硝酸的重要步骤,反应方程式如下:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=−907.28 kJ∙mol−1①
除反应①外,还会发生下列两个副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) △H=−1104.9 kJ∙mol−1②
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=−1269.02 kJ∙mol−1③
三个反应的lgKp(Kp为压强平衡常数)与温度的关系图为

由图可见反应③趋势最大,氨和氧气的反应的主要产物为氮气,但实际生产中NO产率可以达到95−97%,则采取的有效措施可能为
(4)常温下氨水平衡体系中,各组分的分布系数δ与pH的关系如下图所示,X为NH3·H2O或
 ,则NH3·H2O的电离常数Kb值为
,则NH3·H2O的电离常数Kb值为 )
)
(5)一般采用氨水沉淀法去除Cr3+,我国(GB/T14848−93)规定生活用水中铬离子含量不超过10−4 mol∙L−1若处理后的废水溶液中c(NH4+)/c(NH3·H2O)=10,通过计算说明该溶液的铬离子含量是否符合标准
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐2】硫、氮元素形成的有毒有害气体对大气造成严重污染,研究它们的转化关系对消除污染有重要指导作用。已知:标准生成焓是指298K,100kPa条件下,由最稳定的单质生成单位物质的量的纯物质的热效应,△H=生成物标准生成焓总和-反应物标准生成焓总和。
(1)写出NO2氧化SO2的热化学方程式____ (已知NO2自身被还原为NO)。
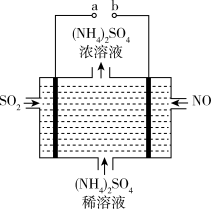
(2)可用如图电解装置将雾霾中的NO、SO2转化为(NH4)2SO4,则a接电源的____ 极,阴极的电极反应式为____ 。
(3)按投料比n(NO):n(Cl2)=2:1将NO和Cl2加入到一恒压密闭容器中,发生反应2NO(g)+Cl2(g) 2NOCl(g),平衡的转化率与温度T的关系如图所示:
2NOCl(g),平衡的转化率与温度T的关系如图所示:
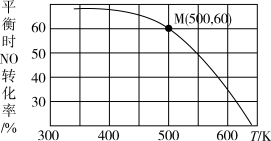
①该反应的ΔH____ 0(填“>”或“<”)。
②已知总压为pMPa,M点时容器内Cl2的转化率为____ 。
| 物质 | 标准生成焓(kJ/mol) | 物质 | 标准生成焓(kJ/mol)) |
| O2(g) | 0 | SO2(g) | -296.9 |
| N2(g) | 0 | SO3(g) | -395.2 |
| S(斜方硫,s) | 0 | NO(g) | 89.9 |
| NO2(g) | 33.9 |
(1)写出NO2氧化SO2的热化学方程式
(2)可用如图电解装置将雾霾中的NO、SO2转化为(NH4)2SO4,则a接电源的

(3)按投料比n(NO):n(Cl2)=2:1将NO和Cl2加入到一恒压密闭容器中,发生反应2NO(g)+Cl2(g)
 2NOCl(g),平衡的转化率与温度T的关系如图所示:
2NOCl(g),平衡的转化率与温度T的关系如图所示:
①该反应的ΔH
②已知总压为pMPa,M点时容器内Cl2的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】天然气的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用。
(1)已知甲烷与氧气、二氧化碳可发生如下反应:
反应Ⅰ: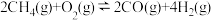 ΔH=
ΔH=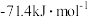
反应Ⅱ: ΔH=
ΔH=
写出表示CO气体燃烧热的热化学方程式___________ 。
(2)在两个体积均为2L的恒容密闭容器A、B中,起始投料如下表所示,温度在753K下进行(1)中反应Ⅱ(不发生其它反应), 的平衡转化率如下表所示:
的平衡转化率如下表所示:
①容器A中,反应从开始到达平衡态所用的时间为2min,则2min内该反应的平均反应速率为:v(CH4)___________ 。
②温度为753K时,该反应的平衡常数K=___________ ;容器B中的反应起始时将___________ 移动(填“正向”、“逆向”或“不”)。
③该反应达到平衡时,其他条件不变,若升高温度,此时v正___________ v逆(填“>”、“ ”或“<”)。
”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4∶3充入盛有催化剂的恒容密闭容器内,发生(1)中反应I,相同时间段内测得CO的体积分数[φ (CO)]与温度(T)的关系如图如示。
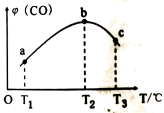
bc段CO的体积分数[φ(CO)]降低的可能原因是___________ 。
(1)已知甲烷与氧气、二氧化碳可发生如下反应:
反应Ⅰ:
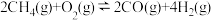 ΔH=
ΔH=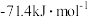
反应Ⅱ:
 ΔH=
ΔH=
写出表示CO气体燃烧热的热化学方程式
(2)在两个体积均为2L的恒容密闭容器A、B中,起始投料如下表所示,温度在753K下进行(1)中反应Ⅱ(不发生其它反应),
 的平衡转化率如下表所示:
的平衡转化率如下表所示:| 容器 | 起始物质的量(n)/mol |  的平衡转化率 的平衡转化率 | |||
| CH4 | CO2 | CO | H2 | ||
| A | 1 | 1 | 0 | 0 | 50% |
| B | 1 | 1 | 2 | 2 | |
①容器A中,反应从开始到达平衡态所用的时间为2min,则2min内该反应的平均反应速率为:v(CH4)
②温度为753K时,该反应的平衡常数K=
③该反应达到平衡时,其他条件不变,若升高温度,此时v正
 ”或“<”)。
”或“<”)。(3)将CH4(g)和O2(g)以物质的量比为4∶3充入盛有催化剂的恒容密闭容器内,发生(1)中反应I,相同时间段内测得CO的体积分数[φ (CO)]与温度(T)的关系如图如示。
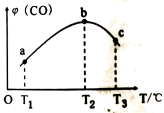
bc段CO的体积分数[φ(CO)]降低的可能原因是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨CO2。该甲醇的制备反应及副反应如下:
ⅰ. (放热反应)
(放热反应)
ⅱ. (吸热反应)
(吸热反应)
(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
若CO2与足量H2发生反应转化为1molCO和水蒸气时吸收热量为42kJ,则
______ 。
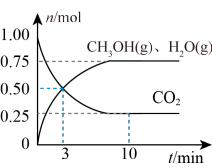
(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:______ 。
②下列措施一定可以提高甲醇生成速率的是______ 。
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是______ 。
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。______ 极,B极的电极反应式为____________ 。
ⅰ.
 (放热反应)
(放热反应)ⅱ.
 (吸热反应)
(吸热反应)(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
化学键 | H-O | C=O(CO2) | H-H |
|
键能/ | 462.8 | 803.0 | 436.0 | x |

(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
②下列措施一定可以提高甲醇生成速率的是
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】合成氨反应 ,在
,在 时,
时, ,
, 。
。
(1)从平衡常数来看,合成氨反应的限度已经很大了,为什么还需要使用催化剂?_______ 。
(2) 、
、 时,在
时,在 的密闭容器中充入
的密闭容器中充入 、
、 和
和 ,开始的瞬间,反应向
,开始的瞬间,反应向_________ (填“正”或“逆”)反应方向进行,反应进行 后体系
后体系_________ (填“吸收”或“放出”)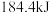 能量,容器内压强与初始压强之比为
能量,容器内压强与初始压强之比为_________ 。
(3)从开始至 时,用
时,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为_________ 。
 ,在
,在 时,
时, ,
, 。
。(1)从平衡常数来看,合成氨反应的限度已经很大了,为什么还需要使用催化剂?
(2)
 、
、 时,在
时,在 的密闭容器中充入
的密闭容器中充入 、
、 和
和 ,开始的瞬间,反应向
,开始的瞬间,反应向 后体系
后体系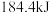 能量,容器内压强与初始压强之比为
能量,容器内压强与初始压强之比为(3)从开始至
 时,用
时,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】反应A(g) B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的物质的量分数与时间关系如图所示。回答下列问题:
B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的物质的量分数与时间关系如图所示。回答下列问题:

(1)上述反应的温度T1___________ T2,平衡常数K(T1)___________ K(T2)。(填“>”、“<”或“=”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为80%,则:
①平衡时体系总的物质的量为___________
②反应的平衡常数K=___________
③反应在0~5min区间的平均反应速率v(A)=___________
(3)在反应体系中加入催化剂,反应速率增大,正逆反应的活化能都___________ ,(填“增大”“减小、”“不变”)。
 B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的物质的量分数与时间关系如图所示。回答下列问题:
B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的物质的量分数与时间关系如图所示。回答下列问题:
(1)上述反应的温度T1
(2)若温度T2时,5min后反应达到平衡,A的转化率为80%,则:
①平衡时体系总的物质的量为
②反应的平衡常数K=
③反应在0~5min区间的平均反应速率v(A)=
(3)在反应体系中加入催化剂,反应速率增大,正逆反应的活化能都
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐1】下表为元素周期表的一部分,表中序号各代表某一元素。请回答下列问题。
(1)③的原子结构示意图是___________ 。
(2)①~⑨中非金属性最强的元素是___________ (填化学式)。
(3)写出元素符号:③_______ ,
(4)元素⑦和⑨组成的化合物中含有的化学键是___________ (填“共价键”或“离子键”)。
(5)元素①的名称为___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑦ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑥ | ⑨ | |||
| 4 | ② | ④ |
(2)①~⑨中非金属性最强的元素是
(3)写出元素符号:③
(4)元素⑦和⑨组成的化合物中含有的化学键是
(5)元素①的名称为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】元素周期表是化学中最重要的基本工具之一、它可以帮助化学家更好地研究元素,在科学研究和工业应用中有广泛应用。近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe—Sm—As—F—O组成的化合物。
(1)比较离子半径:F-___________ O2-(填“大于”“等于”或“小于”)。
(2)Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为___________ 。
(3)元素As与P同族,请举一事实说明非金属性P元素比As元素强___________ 。
(4)已知H3PO4为三元酸,其结构式为: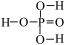 。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是
。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是___________ 。若将足量的KOH与次磷酸(H3PO2)充分反应,则化学方程式为___________ 。
(5)已知KH2PO4溶液呈酸性,可能的原因是___________ 。
(1)比较离子半径:F-
(2)Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为
(3)元素As与P同族,请举一事实说明非金属性P元素比As元素强
(4)已知H3PO4为三元酸,其结构式为:
 。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是
。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是(5)已知KH2PO4溶液呈酸性,可能的原因是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】已知a、b、d、e、 f、g、 h为原子序数依次增大的六种短周期主族元素, 非金属元素a最外层电子数与其周期数相同,b原子的最外层电子数是其所在周期数的2倍。d的一种单质可杀菌消毒,g的最高正价与最低负价代数和为4, f的最高价氧化物可分别与e和h的最高价氧化物的水化物反应,a单质在h单质中燃烧,产物溶于水得到一种强酸甲。请用化学用语回答下列问题:
(1)f在元素周期表中的位置___ 画出与h同族的第四周期元素的原子结构示意图____________ 。
(2)d、e、f、h的简单离子的半径由大到小的顺序_________ 。
(3)下列说法正确的是 。
(4)设计一个简单的实验证明d和g的非金属性强弱: _________ (用化学方程式表示)。
(5)为降低水源中NO 对人体的危害,可在强碱性条件下用f的单质将溶液中的NO
对人体的危害,可在强碱性条件下用f的单质将溶液中的NO 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为______________ 。
(6)将e和f单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积_______ L。最终获得溶液的物质的量浓度为_____ mol∙L−1。
(1)f在元素周期表中的位置
(2)d、e、f、h的简单离子的半径由大到小的顺序
(3)下列说法正确的是 。
| A.氢化物的稳定性d>b |
| B.含氧酸的酸性h>g>b>f |
| C.bg2中b为+4价;g为−2价可说明g的非金属性强于b |
| D.g阴离子能与Fe3+反应而h的阴离子不能,可说明g的非金属性弱于h |
(5)为降低水源中NO
 对人体的危害,可在强碱性条件下用f的单质将溶液中的NO
对人体的危害,可在强碱性条件下用f的单质将溶液中的NO 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为(6)将e和f单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积
您最近一年使用:0次