某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
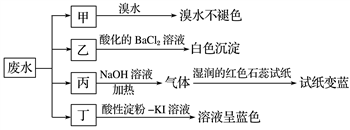
已知废水试样中可能含有下表中的离子:
请回答下列问题:
(1)离子X是______________ (填化学式,下同),离子Y是__________________ 。
(2)表中不能确定是否存在的阴离子是__________ 。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式:___________________ 。

已知废水试样中可能含有下表中的离子:
| 离子 | |
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO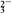 、Y、NO 、Y、NO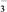 |
(1)离子X是
(2)表中不能确定是否存在的阴离子是
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式:
更新时间:2016-12-09 16:37:21
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图。
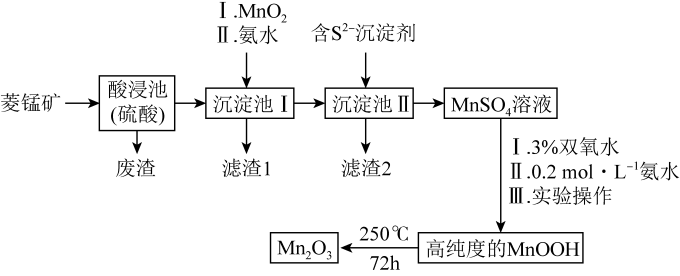
已知:25℃时,相关物质的Ksp见表。
已知:氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
(1)MnOOH中Mn的化合价为____ 价。
(2)向“沉淀池I”中加入MnO2,MnO2的作用是_____ ;“滤渣2”的主要成分是____ (填化学式)。
(3)MnSO4转化为MnOOH的离子方程式为____ 。
(4)MnSO4转化为MnOOH中“III.实验操作”包含过滤、洗涤、干燥。检验MnOOH是否洗涤干净,具体操作为____ 。
(5)高纯度的MnOOH转化为Mn2O3的化学方程式为____ 。
(6)在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为____ (当溶液中某离子浓度c≤1.0×10-5mol·L-1时。可认为该离子沉淀完全)。

已知:25℃时,相关物质的Ksp见表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)MnOOH中Mn的化合价为
(2)向“沉淀池I”中加入MnO2,MnO2的作用是
(3)MnSO4转化为MnOOH的离子方程式为
(4)MnSO4转化为MnOOH中“III.实验操作”包含过滤、洗涤、干燥。检验MnOOH是否洗涤干净,具体操作为
(5)高纯度的MnOOH转化为Mn2O3的化学方程式为
(6)在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】1000ml某待测溶液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
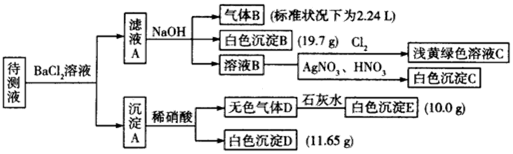
(1)写出生成白色沉淀B的离子方程式:______________ 。
(2)待测液中肯定不存在的阳离子是________________ 。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在___ (填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:______________ 。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________ 。
②沉淀A中能与稀硝酸反应的成分是___________ (写化学式)。
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

(1)写出生成白色沉淀B的离子方程式:
(2)待测液中肯定不存在的阳离子是
(3)若无色气体D是单一气体:判断原溶液中K+是否存在
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是
②沉淀A中能与稀硝酸反应的成分是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】含铬(+6价)的废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:
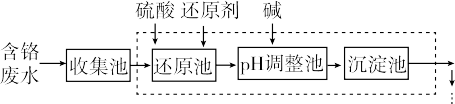
(1)废水中,+6价铬以CrO 或者Cr2O
或者Cr2O 的形式存在,写出其相互转化的离子方程式:
的形式存在,写出其相互转化的离子方程式:_______ ;我国常用NaHSO3作还原剂,写出还原池中主要反应的离子方程式:_______ (还原产物为Cr3+);有人认为Cr3+与A13+性质相似,请写出将CrC13滴入NaCrO2溶液中发生的反应的化学方程式_______ 。
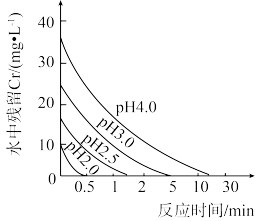
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pIH=2.5~3.0,原因可能是_______ 。
(3)我国规定,工业废水中含Cr(VI)量的排放标准为0.1mg·L-1。已知:Ksp(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO ,达到废水排放标准时,废水中Ba2+浓度最低为
,达到废水排放标准时,废水中Ba2+浓度最低为________ mol·L-1(保留小数点后2位)。用Ba2+除去废水中的CrO (填是或否)可行,原因是
(填是或否)可行,原因是_______ 。
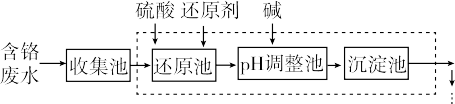
(1)废水中,+6价铬以CrO
 或者Cr2O
或者Cr2O 的形式存在,写出其相互转化的离子方程式:
的形式存在,写出其相互转化的离子方程式:(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pIH=2.5~3.0,原因可能是

(3)我国规定,工业废水中含Cr(VI)量的排放标准为0.1mg·L-1。已知:Ksp(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO
 ,达到废水排放标准时,废水中Ba2+浓度最低为
,达到废水排放标准时,废水中Ba2+浓度最低为 (填是或否)可行,原因是
(填是或否)可行,原因是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】今有一混合物的无色水溶液只可能含有以下离子中的若干种:K+、NH 、Fe2+、Cl-、Ca2+、Ba2+、CO
、Fe2+、Cl-、Ca2+、Ba2+、CO 、SO
、SO ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH 溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。综合上述实验,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是__________ 。
(2)该混合物中一定含有的离子是_________________ ;可能含有的离子是_______ 。
(3)计算K+的物质的量:n(K+)_________________ (具体值或取值范围)。
 、Fe2+、Cl-、Ca2+、Ba2+、CO
、Fe2+、Cl-、Ca2+、Ba2+、CO 、SO
、SO ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH 溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。综合上述实验,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)该混合物中一定含有的离子是
(3)计算K+的物质的量:n(K+)
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】Ⅰ有一份无色溶液,只可能有Na+、Cl-、H+、SO42-、CO32-、Cu2+、NO3-中的几种(忽略水电离产生的少量OH-)。取该溶液检测,发现溶液显强酸性。
(1)不需要进一步实验,可以判断,溶液中一定存在________ ,一定不存在__________ 。
(2)进一步测定,发现该溶液中c(H+)=0.1mol/L,取100mL该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g沉淀。100mL溶液中是否有Cl—______ (填一定有、一定没有、可能有),100mL溶液中Na+的物质的量浓度至少为_______ mol/L。
Ⅱ现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X__________ ,C__________ ,B__________
(2)完成A溶液与X气体反应的离子方程式:__________
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为_____________ 。
(4)已知NaHCO3溶液呈碱性,B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子方程式_________
(1)不需要进一步实验,可以判断,溶液中一定存在
(2)进一步测定,发现该溶液中c(H+)=0.1mol/L,取100mL该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g沉淀。100mL溶液中是否有Cl—
Ⅱ现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X
(2)完成A溶液与X气体反应的离子方程式:
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为
(4)已知NaHCO3溶液呈碱性,B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐1】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)依题意不进行实验即可判断溶液X中一定不存在的离子有____________ 。
(2)下列结论正确的是____________ (填序号)。
(3)产生气体A的离子方程式为__________ 。
(4)转化⑥发生反应的现象为_____________ 。
(5)转化③中氧化剂与还原剂的物质的量之比为_________ 。
(6)对不能确定是否存在的离子,如何确定其是否存在?___________ (简述操作过程)

(1)依题意不进行实验即可判断溶液X中一定不存在的离子有
(2)下列结论正确的是
| A.X中肯定存在Fe2+、Al3+、NH4+ |
| B.气体F经催化氧化可直接生成气体D |
| C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀K可能有Al(OH)3 |
| D.溶液X中,一定没有NO3- |
(4)转化⑥发生反应的现象为
(5)转化③中氧化剂与还原剂的物质的量之比为
(6)对不能确定是否存在的离子,如何确定其是否存在?
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①饱和氨水的浓度约为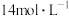
② 为浅青色沉淀
为浅青色沉淀
③ 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)有研究认为蓝色沉淀中还有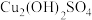 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。___________ ,c=___________ 。
②实验现象是___________ 。
(5)从平衡移动角度,结合化学用语,解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(6)针对实验ii未能成功配制 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:___________ 。
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、___________ 。
| 实验序号 | 操作 | 现象 | |
实验i: 的配制 的配制 | 实验i-a | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的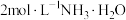 | 产生蓝色沉淀,加入 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的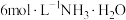 | 产生蓝色沉淀,加入 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的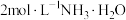 | 产生蓝色沉淀,加入 后沉淀完全溶解,得到澄清的深蓝色溶液。 后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
实验ii: 的配制 的配制 | 实验ii-a | 在试管内混合 溶液和过量 溶液和过量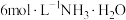 | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合 溶液和过量 溶液和过量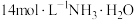 | 得到浅青色沉淀,沉淀未见明显溶解。 | |
实验iii: 的配制 的配制 | 实验iii | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的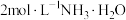 | 产生白色沉淀,加入 后沉淀完全溶解,得到无色溶液。 后沉淀完全溶解,得到无色溶液。 |
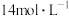
②
 为浅青色沉淀
为浅青色沉淀③
 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)有研究认为蓝色沉淀中还有
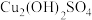 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测
 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。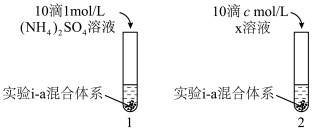
②实验现象是
(5)从平衡移动角度,结合化学用语,解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(6)针对实验ii未能成功配制
 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】如图所示可以分离并回收废旧芯片中的几种贵金属。
请回答:
(1)含金固体可溶于HNO3和NaCl的混合溶液,并产生NO,请写出反应的离子方程式:_______ 。
(2)金的分离还可以加王水,银钯的分离可重复利用某些溶液。
①下列说法正确的是_______ 。
A.芯片中的金是芯片连接的绝佳材料,只是利用其物理性质
B.溶液X可以是NaCl溶液
C.溶液Z的主要成分是Ag(NH3)2Cl,是一种盐
D.N2H4不直接还原固体Y可能的原因是得到的Ag纯度更高
②加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,则该条件下配位能力:Cl_____ NH3(填“>”或“<”)。“加入盐酸,调pH≈1”能将[Pd(NH3)4]2+转化为Pd(NH3)2Cl2的原因_______ 。
(3)溶液Z中加NaCl溶液是否有沉淀?_______ (填“有”或“没有”)。设计实验验证溶液Z中银元素的存在_______ 。
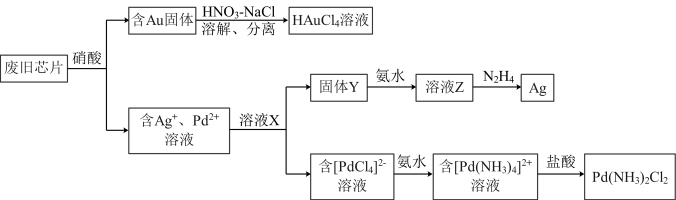
请回答:
(1)含金固体可溶于HNO3和NaCl的混合溶液,并产生NO,请写出反应的离子方程式:
(2)金的分离还可以加王水,银钯的分离可重复利用某些溶液。
①下列说法正确的是
A.芯片中的金是芯片连接的绝佳材料,只是利用其物理性质
B.溶液X可以是NaCl溶液
C.溶液Z的主要成分是Ag(NH3)2Cl,是一种盐
D.N2H4不直接还原固体Y可能的原因是得到的Ag纯度更高
②加入氨水,[PdCl4]2-转化为[Pd(NH3)4]2+,则该条件下配位能力:Cl
(3)溶液Z中加NaCl溶液是否有沉淀?
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
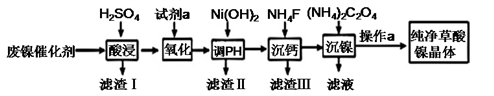
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(NiC2O4)= 4.05×10−10
(1)“酸浸”前将废镍催化剂粉碎的目的是:____ 。“滤渣Ⅰ”的主要成分为:____ 。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____ 。
(3)调节pH的范围为:____ 。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____ ,NH4F的电子式为:____ 。
(5)如果“沉镍”操作后测得滤液中C2O42− 的浓度为0.18 mol·L−1,则溶液中c(Ni2+)=____ mol·L−1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____ 。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×10−10
(1)“酸浸”前将废镍催化剂粉碎的目的是:
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:
(3)调节pH的范围为:
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:
(5)如果“沉镍”操作后测得滤液中C2O42− 的浓度为0.18 mol·L−1,则溶液中c(Ni2+)=
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】锂离子电池正极材料的回收利用具有重大的现实意义。将废旧钴酸锂电池经过放电、拆解等操作后获得正极材料(主要成分是LiCoO2、铝箔和炭黑等),可采用湿法治金工艺回收正极材料中的金属,其流程如下:
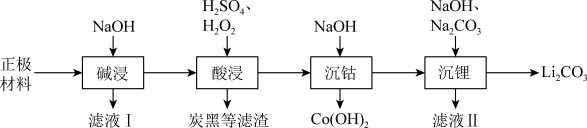
(1)钴酸锂中Co元素的化合价为___________ 。
(2)加快碱浸的可行性措施是___________ 。(任意写一条)
(3)滤液I中的主要成分除了NaOH还有___________ 。(写化学式)
(4)“酸浸”中发生反应的离子方程式是___________ ;在酸浸过程中不使用盐酸做浸出剂的原因可能是___________ 。
(5)常温下,“沉钴”时加入碱使溶液pH = 8.5,此时溶液中c(Co2+)=___________ 。(已知:Ksp[Co(OH)2]=2×10-15)
(6)该工艺得到的Co(OH)2和Li2CO3混合后在空气中于800℃煅烧可进行LiCoO2材料再生,写出LiCoO2材料再生的化学方程式___________ 。

(1)钴酸锂中Co元素的化合价为
(2)加快碱浸的可行性措施是
(3)滤液I中的主要成分除了NaOH还有
(4)“酸浸”中发生反应的离子方程式是
(5)常温下,“沉钴”时加入碱使溶液pH = 8.5,此时溶液中c(Co2+)=
(6)该工艺得到的Co(OH)2和Li2CO3混合后在空气中于800℃煅烧可进行LiCoO2材料再生,写出LiCoO2材料再生的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】联氨(N2H4)是一种无色的可燃液体。请回答下列问题:
(1)联氨是火箭的重要燃料。已知:
(a) N2H4(l)的燃烧热ΔH1 = –624.0 kJ·mol–1
(b)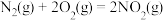 ΔH2 = –66.4 kJ·mol–1
ΔH2 = –66.4 kJ·mol–1
(c)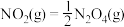 ΔH3 = –28.6 kJ·mol–1
ΔH3 = –28.6 kJ·mol–1
写出N2H4(l)在N2O4(g)中燃烧生成氮气和液态水的热化学方程式________________ 。
(2)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3·xH2O)变成磁性氧化铁,从而可减缓锅炉锈蚀。反应过程中每生成0.1 mol磁性氧化铁,转移的电子数为_________________ 。
(3)联氨-空气燃料电池的电解质为KOH溶液。写出该电池放电时负极的反应式________ 。
(4)联氨的制备方法有多种,尿素法是其中之一。在KMnO4的催化作用下,尿素CO(NH2)2和NaClO、NaOH溶液反应生成联氨、水和两种钠盐,写出该反应的化学方程式_________________ 。
(1)联氨是火箭的重要燃料。已知:
(a) N2H4(l)的燃烧热ΔH1 = –624.0 kJ·mol–1
(b)
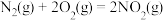 ΔH2 = –66.4 kJ·mol–1
ΔH2 = –66.4 kJ·mol–1(c)
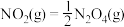 ΔH3 = –28.6 kJ·mol–1
ΔH3 = –28.6 kJ·mol–1写出N2H4(l)在N2O4(g)中燃烧生成氮气和液态水的热化学方程式
(2)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3·xH2O)变成磁性氧化铁,从而可减缓锅炉锈蚀。反应过程中每生成0.1 mol磁性氧化铁,转移的电子数为
(3)联氨-空气燃料电池的电解质为KOH溶液。写出该电池放电时负极的反应式
(4)联氨的制备方法有多种,尿素法是其中之一。在KMnO4的催化作用下,尿素CO(NH2)2和NaClO、NaOH溶液反应生成联氨、水和两种钠盐,写出该反应的化学方程式
您最近一年使用:0次




