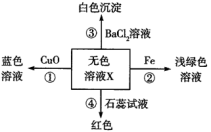
A、B、C、D、E五瓶透明溶液,分别是稀盐酸、BaCl2溶液、Na2CO3溶液、AgNO3溶液、NaHSO4溶液中的一种。它们之间有列关系:
①A与B反应有气体生成;
② B与C反应有沉淀生成;
③ C与D反应有沉淀生成;
④D与E反应有沉淀生成;
⑤ A与E反应有气体生成;
⑥在②和③的反应中生成的沉淀是同一种物质。
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式___________ ;
(2)B是_______ ;D是________ ;
(3)A与E反应的离子方程式是_______________________ 。
①A与B反应有气体生成;
② B与C反应有沉淀生成;
③ C与D反应有沉淀生成;
④D与E反应有沉淀生成;
⑤ A与E反应有气体生成;
⑥在②和③的反应中生成的沉淀是同一种物质。
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式
(2)B是
(3)A与E反应的离子方程式是
更新时间:2017-02-17 14:55:45
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以废旧电池[主要含MnO2、MnOOH、Zn、Zn(OH)2、Fe、KOH、、石墨棒]为原料,制备锰锌铁氧体[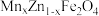 ]的流程如下:
]的流程如下: 在煮沸时易分解。
在煮沸时易分解。
(1)将电池“粉碎”前应先放电,其目的是______________ 。
(2)“酸浸”过程中含锰物质被溶液中的 ,还原为
,还原为 ,其中
,其中 参与反应的离子方程式为
参与反应的离子方程式为______________ 。
(3)“氧化”时加入 将
将 氧化,取氧化后的溶液加入
氧化,取氧化后的溶液加入 ,调节溶液
,调节溶液 为1~2,可制得黄钾铁矾[
为1~2,可制得黄钾铁矾[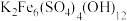 ]沉淀。
]沉淀。
①复杂的含氧酸盐可以表示为氧化物的形式,如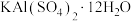 可表示为
可表示为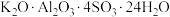 ,则
,则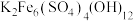 以氧化物的形式可表示为
以氧化物的形式可表示为______________ 。
②写出加入Na2CO3生成黄钾铁矾反应的离子方程式:______________ 。
③检验“氧化”后的溶液中是否还存在Fe2+,可使用的试剂是_______________ (填化学式)。
(4)“共沉淀”前,需测定溶液中锰元素含量。操作步骤:
a.准确量取1.00mL“氧化”后的溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液,振荡;
b.将溶液加热至 ,加入
,加入 充分反应(
充分反应( 被氧化为
被氧化为 )后,再将溶液煮沸;
)后,再将溶液煮沸;
c.冷却后,用 的
的 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液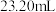 。
。
①步骤b中,煮沸的目的是_______________ 。
②“氧化”后的溶液中 的物质的量浓度为
的物质的量浓度为_________  。
。
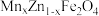 ]的流程如下:
]的流程如下: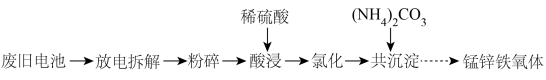
 在煮沸时易分解。
在煮沸时易分解。(1)将电池“粉碎”前应先放电,其目的是
(2)“酸浸”过程中含锰物质被溶液中的
 ,还原为
,还原为 ,其中
,其中 参与反应的离子方程式为
参与反应的离子方程式为(3)“氧化”时加入
 将
将 氧化,取氧化后的溶液加入
氧化,取氧化后的溶液加入 ,调节溶液
,调节溶液 为1~2,可制得黄钾铁矾[
为1~2,可制得黄钾铁矾[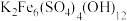 ]沉淀。
]沉淀。①复杂的含氧酸盐可以表示为氧化物的形式,如
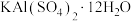 可表示为
可表示为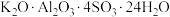 ,则
,则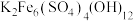 以氧化物的形式可表示为
以氧化物的形式可表示为②写出加入Na2CO3生成黄钾铁矾反应的离子方程式:
③检验“氧化”后的溶液中是否还存在Fe2+,可使用的试剂是
(4)“共沉淀”前,需测定溶液中锰元素含量。操作步骤:
a.准确量取1.00mL“氧化”后的溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液,振荡;
b.将溶液加热至
 ,加入
,加入 充分反应(
充分反应( 被氧化为
被氧化为 )后,再将溶液煮沸;
)后,再将溶液煮沸;c.冷却后,用
 的
的 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液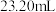 。
。①步骤b中,煮沸的目的是
②“氧化”后的溶液中
 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】有A、B、C三种可溶性正盐,阴、阳离子各不相同,它们的阴离子的摩尔质量按A、B、C的顺序依次增大。将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、 、
、 、
、 五种离子,同时生成一种白色沉淀。请回答下列问题:
五种离子,同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是________ (填序号)。
A. Na+ B. Mg2+ C. Cu2+ D. Ag+
(2)三种盐的化学式分别是A________ ,B________ ,C________ 。
(3)不需要加入任何试剂就能将上述三种盐溶液区分开来,鉴别出来的先后顺序为_____ (填化学式)。
(4)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、 、
、 、K+四种离子且物质的量之比依次为1:2:3:4,则A、B、C三种盐的物质的量之比为
、K+四种离子且物质的量之比依次为1:2:3:4,则A、B、C三种盐的物质的量之比为________ ,若向该溶液中加入过量 ,发生反应的总离子方程式为
,发生反应的总离子方程式为___________ 。
 、
、 、
、 五种离子,同时生成一种白色沉淀。请回答下列问题:
五种离子,同时生成一种白色沉淀。请回答下列问题:(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是
A. Na+ B. Mg2+ C. Cu2+ D. Ag+
(2)三种盐的化学式分别是A
(3)不需要加入任何试剂就能将上述三种盐溶液区分开来,鉴别出来的先后顺序为
(4)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、
 、
、 、K+四种离子且物质的量之比依次为1:2:3:4,则A、B、C三种盐的物质的量之比为
、K+四种离子且物质的量之比依次为1:2:3:4,则A、B、C三种盐的物质的量之比为 ,发生反应的总离子方程式为
,发生反应的总离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铁、铜及其化合物在工业生产中有重要的用途。运用相关知识,回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式_______ 。
(2)甲同学为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤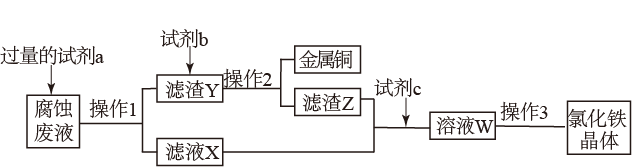
回答下列问题:
①试剂a是_______ (用化学式表示);操作Ⅰ用到的玻璃仪器有_______ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为_______ 。
③上述流程中操作Ⅲ包括蒸发浓缩、_______ 、过滤、洗涤。
(3)乙同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:
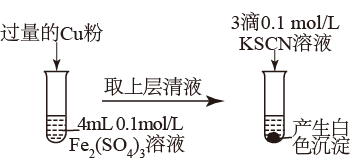
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-的相似;
iii.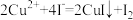 。
。
填写实验方案:
Cu2+与SCN-反应的离子方程式为_______ 。
(1)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式
(2)甲同学为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作Ⅲ包括蒸发浓缩、
(3)乙同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-的相似;
iii.
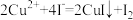 。
。填写实验方案:
| 实验方案 | 实验现象 |
| 步骤Ⅰ:取4mL0.2mol/LFeSO4溶液于试管中,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
| 步骤2:取4mL | 产生白色沉淀 |
Cu2+与SCN-反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠,现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是_______________________________________________________________________
被检出的物质的化学式(分子式)是_____________
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式分别为:
1支试管中有白色沉淀生成:__________________ 。
2支试管中有蓝色沉淀生成:________________________ 、________________________ 。
被检出的物质的化学式(分子式)是_____________ 。
(3)鉴别余下未检出物质的方法和观察到的现象
(i)分别取(2)中能产生蓝色沉淀的两种溶液,向其中加入BaCl2溶液,有白色沉淀生成的是__________________ ,无沉淀生成的是_________________ 。
(ii)分别取少量未检出的溶液,往其中加入NaOH溶液,无明显现象的是_____________ ,有刺激性气味气体产生的是___________________ 。
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是
被检出的物质的化学式(分子式)是
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式分别为:
1支试管中有白色沉淀生成:
2支试管中有蓝色沉淀生成:
被检出的物质的化学式(分子式)是
(3)鉴别余下未检出物质的方法和观察到的现象
(i)分别取(2)中能产生蓝色沉淀的两种溶液,向其中加入BaCl2溶液,有白色沉淀生成的是
(ii)分别取少量未检出的溶液,往其中加入NaOH溶液,无明显现象的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】下列为实验室常用仪器:

(1)某同学在实验室提纯粗盐的流程如图:
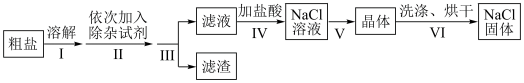
①粗盐溶于水可导电,粗盐______ (填“是”或“不是”)电解质。
②步骤Ⅲ中,用到的仪器是______ (填标号)。
③粗盐中含有Ca2+,Mg2+、 等杂质离子,步骤Ⅱ所用的除杂试剂有:a.碳酸钠溶液b.氯化钡溶液c.氢氧化钠溶液。则加入试剂的顺序是
等杂质离子,步骤Ⅱ所用的除杂试剂有:a.碳酸钠溶液b.氯化钡溶液c.氢氧化钠溶液。则加入试剂的顺序是______ (填标号)。
A.bca B.abc C.bac D.cab
④步骤Ⅳ的离子方程式为_____________________ ;____________________ 。
⑤步骤Ⅴ的操作名称为______ 。
(2)现有如图仪器:

①海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的_______ (填序号);蒸馏时除加入适量海水外,还需加入_______ ,其作用是________ 。
②海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述中的仪器,该仪器名称________ 。为了使该仪器中液体可以顺利流下,应进行的具体操作是__________ 。

(1)某同学在实验室提纯粗盐的流程如图:

①粗盐溶于水可导电,粗盐
②步骤Ⅲ中,用到的仪器是
③粗盐中含有Ca2+,Mg2+、
 等杂质离子,步骤Ⅱ所用的除杂试剂有:a.碳酸钠溶液b.氯化钡溶液c.氢氧化钠溶液。则加入试剂的顺序是
等杂质离子,步骤Ⅱ所用的除杂试剂有:a.碳酸钠溶液b.氯化钡溶液c.氢氧化钠溶液。则加入试剂的顺序是A.bca B.abc C.bac D.cab
④步骤Ⅳ的离子方程式为
⑤步骤Ⅴ的操作名称为
(2)现有如图仪器:

①海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的
②海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述中的仪器,该仪器名称
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】某强酸性溶液X,含有Fe3+、Fe2+、Ba2+、Al3+、NH4+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)写出步骤①生成气体A的离子方程式_________________________ 。
(2)气体F的电子式为__________ ,实验中,可以观察到反应②的现象是:______________ 。
(3)检验溶液I中存在的阳离子的方法是__________________ 。
(4)沉淀G的化学式为___________ ;写出反应⑦的离子方程式___________________ 。
(5)溶液X中肯定不存在的离子有_____________ ;对不能确定是否存在的离子,可以另取X溶液于试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是____________ 。(选填序号:①pH试纸,②酚酞试剂,③石蕊试剂,④KSCN溶液,⑤NaOH溶液,⑥KMnO4溶液)

依据以上信息,回答下列问题:
(1)写出步骤①生成气体A的离子方程式
(2)气体F的电子式为
(3)检验溶液I中存在的阳离子的方法是
(4)沉淀G的化学式为
(5)溶液X中肯定不存在的离子有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】有四瓶失去标签的溶液A、B、C、D,它们可能分别是硫酸、盐酸、碳酸钠和硝酸钾溶液中的某一种。各取少量分别放入四支试管里,先向各试管中滴加BaCl2溶液,则A、B有白色沉淀,C、D无明显现象,再向A、B白色沉淀中加入稀硝酸,则A试管中白色沉淀溶解,并有无色气体产生,B试管无变化。另取C、D各少量,分别加入AgNO3溶液,则C试管有白色沉淀,D试管无变化。由此判断:(填化学式)
A.____ B.____ C.____ D.___
A.
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】某溶液呈酸性,可能含有: 、
、 、
、 、
、 、
、 、
、 中的若干种。对其进行如下实验:
中的若干种。对其进行如下实验:
Ⅰ.取少量溶液,向其中加入过量 ,生成白色沉淀
,生成白色沉淀 和无色气体
和无色气体 ,该无色气体在空气中变为红棕色。
,该无色气体在空气中变为红棕色。
Ⅱ.将Ⅰ中所得溶液滤去沉淀后,加入过量浓 溶液,生成无色气体,最终得到红棕色沉淀
溶液,生成无色气体,最终得到红棕色沉淀 。
。
(1)上述6种离子中,该溶液肯定存在的为____________ ,肯定不存在 的为______ ,不能 确定是否存在的为______ 。
(2)请设计实验检验原溶液中是否存在 ,写出操作方法、现象及结论
,写出操作方法、现象及结论___________ 。
(3)生成无色气体 的离子方程式为
的离子方程式为____________ 。
(4)步骤Ⅱ中发生反应的离子方程式为___________________ 。
 、
、 、
、 、
、 、
、 、
、 中的若干种。对其进行如下实验:
中的若干种。对其进行如下实验:Ⅰ.取少量溶液,向其中加入过量
 ,生成白色沉淀
,生成白色沉淀 和无色气体
和无色气体 ,该无色气体在空气中变为红棕色。
,该无色气体在空气中变为红棕色。Ⅱ.将Ⅰ中所得溶液滤去沉淀后,加入过量浓
 溶液,生成无色气体,最终得到红棕色沉淀
溶液,生成无色气体,最终得到红棕色沉淀 。
。(1)上述6种离子中,该溶液肯定存在的为
(2)请设计实验检验原溶液中是否存在
 ,写出操作方法、现象及结论
,写出操作方法、现象及结论(3)生成无色气体
 的离子方程式为
的离子方程式为(4)步骤Ⅱ中发生反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】中学化学中几种常见物质的转化关系如下图(部分产物未列出),A是一种金属单质,D是一种非金属固体单质。
请回答下列问题:

(1)A、C的化学式分别为A_________ ,C_________ ;
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是_____ ;
A.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4═FeSO4+H2↑
C.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4═FeSO4+H2O
(3)写出反应E+H2O2→F的化学方程式:____________ ;
(4)若反应F+D→E转移电子数为6.02×1023,则消耗D的质量为___________ 。
请回答下列问题:

(1)A、C的化学式分别为A
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是
A.C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2OB.Fe+H2SO4═FeSO4+H2↑
C.Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2OD.FeO+H2SO4═FeSO4+H2O
(3)写出反应E+H2O2→F的化学方程式:
(4)若反应F+D→E转移电子数为6.02×1023,则消耗D的质量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】某淡黄色粉末可在潜水艇中作为氧气的来源,常被用作供氧剂。根据下图所示转化关系及现象填空:
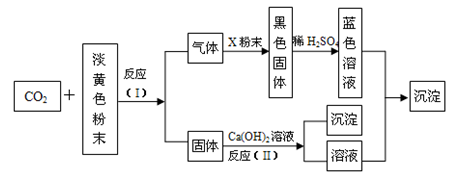
(1)该淡黄色粉末为__________________ ;
(2)X粉末的名称或化学式为__________________ ;
(3)反应(I)的化学方程式为______________________________ ;
(4)反应(II)的化学方程式为_____________________________ ;
(5)反应(Ⅲ)的化学方程式为______________________________ 。

(1)该淡黄色粉末为
(2)X粉末的名称或化学式为
(3)反应(I)的化学方程式为
(4)反应(II)的化学方程式为
(5)反应(Ⅲ)的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为BaCO3,还含有SiO2及含Ca、Mg、Fe、Al的化合物)为原料制备BaCl2·2H2O的工艺流程如下:
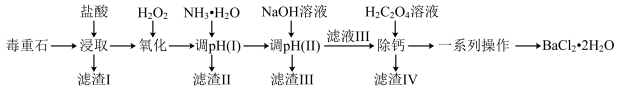
已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有_______ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是_______ ;判断“浸取”的最佳液固比为_______ 。
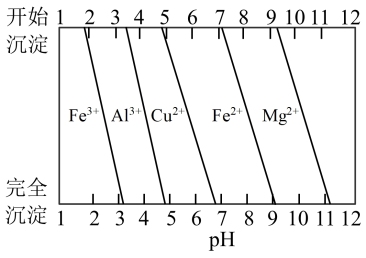
(3)常温时,几种金属离子沉淀的pH如图所示,加H2O2时发生反应的离子方程式为_______ 。“调pH(I)”时,调节溶液pH≈5,则“滤渣II”的主要成分为_______ (填化学式)。
(4)“一系列操作”中洗涤晶体时,通常采用乙醇洗而不采用水洗,原因是_______ 。
(5)“除钙”前,需测定溶液中钙离子的含量,从而确定加入草酸的量,测钙离子含量的操作为取“滤液III”V1mL,加入稍过量的铬酸钾,使钡离子完全沉淀,过滤,将滤液转入250mL容量瓶后再加水定容,取其中25. 00 mL于锥形瓶中,用NaOH溶液将pH调为13,加入黄绿素作指示剂(黄绿素溶液为红色,能与钙离子形成络合物使溶液呈黄绿色) ,用0.100 mol·L-1的标准EDTA溶液滴定(EDTA能与Ca2+以1: 1形成无色络合物)至终点,消耗标准EDTA溶液V2 mL。
①滴定至终点时的现象为_______ 。
②该溶液中钙离子的浓度为_______ (用含 V1、V2的代数式表示)g·mL-1。

已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25。 | 3:1 | 4:1 | 5:1 | 6:1 | |||
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 | ||
分析表中数据,温度越高钡的浸出率越低的可能原因是
(3)常温时,几种金属离子沉淀的pH如图所示,加H2O2时发生反应的离子方程式为

(4)“一系列操作”中洗涤晶体时,通常采用乙醇洗而不采用水洗,原因是
(5)“除钙”前,需测定溶液中钙离子的含量,从而确定加入草酸的量,测钙离子含量的操作为取“滤液III”V1mL,加入稍过量的铬酸钾,使钡离子完全沉淀,过滤,将滤液转入250mL容量瓶后再加水定容,取其中25. 00 mL于锥形瓶中,用NaOH溶液将pH调为13,加入黄绿素作指示剂(黄绿素溶液为红色,能与钙离子形成络合物使溶液呈黄绿色) ,用0.100 mol·L-1的标准EDTA溶液滴定(EDTA能与Ca2+以1: 1形成无色络合物)至终点,消耗标准EDTA溶液V2 mL。
①滴定至终点时的现象为
②该溶液中钙离子的浓度为
您最近一年使用:0次