(1)硫元素位于元素周期表第____ 列;硫元素原子核外有2个未成对电子,这2个电子所处亚层的符号是_______ ;硫、氯元素的原子均可形成与Ar原子电子层结构相同的简单离子,且硫离子的半径更大,请解释__________________ 。
(2)S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有___ 个S-S键;已知:H-S键键能:339 kJ/mol;H-Se键键能:314 kJ/mol。以上键能数据能否比较S、Se非金属性的强弱______ (选填“能”、“否”;下同);能否比较H2S、H2Se沸点的高低______ 。
(3)在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此判断NaHSO3溶液显___ 性。
(4)在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32-)=c (HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)___________ 。
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)已知Na2SO3溶液中存在水解平衡:SO32-+H2O HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是__________ ,操作和现象是__________________ 。
(2)S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有
(3)在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此判断NaHSO3溶液显
(4)在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32-)=c (HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)已知Na2SO3溶液中存在水解平衡:SO32-+H2O
 HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是
2015·上海静安·二模 查看更多[3]
更新时间:2017-04-06 10:16:51
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol· L-1;
H2CO3的电离常数Ka1=4.2×10-7mol·L-1、Ka2=5.6×10-11mol·L-1。
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因________________ 。
②常温下,物质的量浓度相同的下列四种溶液:a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、碳酸氢钠溶液。其pH由大到小的顺序是:___________ (填序号)。
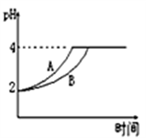
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则表示醋酸溶液pH变化的曲线是___ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。则 m1 ___ m2 ( 选填“<”、“=”、“>”)。
(3)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图如下,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是_______ ;该醋酸溶液稀释过程中,下列各量一定变小的是______________ 。
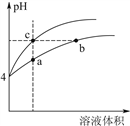
a.c(H+) b.c(OH-)
c. d.
d.
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
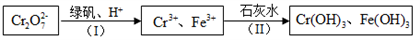
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________ 。{Ksp[Cr(OH)3]=6.0×10-31}
已知室温下:Ka(CH3COOH)=1.7×10-5 mol· L-1;
H2CO3的电离常数Ka1=4.2×10-7mol·L-1、Ka2=5.6×10-11mol·L-1。
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因
②常温下,物质的量浓度相同的下列四种溶液:a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、碳酸氢钠溶液。其pH由大到小的顺序是:
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则表示醋酸溶液pH变化的曲线是

(3)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图如下,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是

a.c(H+) b.c(OH-)
c.
 d.
d.
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
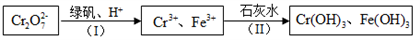
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2(s)]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l) 2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=
2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=___ 。关于该反应的下列说法正确的是___ (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
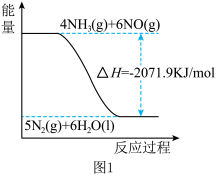
②尿素在一定条件下可将氮的氧化物还原为氮气,结合①及图1中信息,尿素还原NO(g)为N2的热化学方程式是___ 。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)___ b点的逆反应速率v逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是___ 。

(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2gNO2和Na2CO3溶液完全反应时生成两种盐并转移电子0.1mol,此反应的化学反应方程式是___ 。
(1)尿素[CO(NH2)2(s)]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l)
 2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=
2NH3(g)+CO2(g) △H=+133.6kJ/mol。该反应的化学平衡常数的表达式K=a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气,结合①及图1中信息,尿素还原NO(g)为N2的热化学方程式是

③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)
 CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图2所示,则a点的正反应速率v正(CO2)
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2gNO2和Na2CO3溶液完全反应时生成两种盐并转移电子0.1mol,此反应的化学反应方程式是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
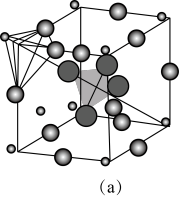
【推荐3】固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子 如
如 提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图
提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图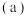 所示的锂超离子导体
所示的锂超离子导体 和图
和图 所示的有“点缺陷”的NaCl。
所示的有“点缺陷”的NaCl。
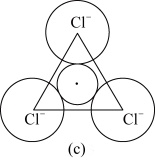
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态Cl的________ 能级,此过程会_______  填“吸收”或“释放”
填“吸收”或“释放” 能量。
能量。
(2)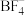 中B的杂化形式为
中B的杂化形式为__________ ,其等电子体为:___________  任写一种
任写一种 。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是
。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是____________ 。
(3)图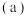 所示晶胞中
所示晶胞中 位于
位于__________ 位置;若将晶体中形成宽敞通道的 换成
换成 ,导电能力会明显降低,原因是
,导电能力会明显降低,原因是_____________ 。
(4)图 中,若缺陷处填充了
中,若缺陷处填充了 ,则它
,则它____________  填“是”或“不是”
填“是”或“不是”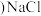 的晶胞,在NaCl晶体中,
的晶胞,在NaCl晶体中, 填充在
填充在 堆积而成的
堆积而成的___________ 面体空隙中。
 如
如 提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图
提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图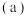 所示的锂超离子导体
所示的锂超离子导体 和图
和图 所示的有“点缺陷”的NaCl。
所示的有“点缺陷”的NaCl。


根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态Cl的
 填“吸收”或“释放”
填“吸收”或“释放” 能量。
能量。(2)
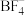 中B的杂化形式为
中B的杂化形式为 任写一种
任写一种 。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是
。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是(3)图
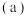 所示晶胞中
所示晶胞中 位于
位于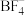 换成
换成 ,导电能力会明显降低,原因是
,导电能力会明显降低,原因是(4)图
 中,若缺陷处填充了
中,若缺陷处填充了 ,则它
,则它 填“是”或“不是”
填“是”或“不是”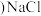 的晶胞,在NaCl晶体中,
的晶胞,在NaCl晶体中, 填充在
填充在 堆积而成的
堆积而成的
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】下列是将原子序数为1~18的元素按原子序数递增顺序、按一定规律排列而成的。
请用适当化学用语 (化学符号、化学式、化学方程式等)或适当文字回答以下问题:
(1)请写出下列元素符号:⑥_________ ,⑨__________ 。
(2)在第三周期中,金属性最强的元素是___________ (填化学式,下同),形成气态氢化物中最稳定的是_________ ,⑤的氧化物与NaOH反应的离子方程式是:___________________________________ 。
(3)③与④形成化合物的化学式为___________ ,高温灼烧该化合物时,火焰呈_________ 色。
(4)由③、⑤、⑧三种元素形成的简单离子,离子半径由小到大顺序为______________________ 。
| ① | ② | ③ | ||||||
| ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
请用适当
(1)请写出下列元素符号:⑥
(2)在第三周期中,金属性最强的元素是
(3)③与④形成化合物的化学式为
(4)由③、⑤、⑧三种元素形成的简单离子,离子半径由小到大顺序为
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】下表列出了①~⑨九种元素在周期表中的位置。
请按要求回答下列问题:
(1)元素⑦的原子结构示意图:__________________ ,元素⑤与⑧组成的化合物的电子式:____________ 。
(2)元素⑤~⑧中原子半径最大的是____________ (填元素符号)。
(3)元素①~⑨中化学性质最不活泼的是____________ (填元素符号)。
(4)元素③的氢化物,分子的空间构型呈____________ 形。
(5)元素⑤和⑥的最高价氧化物对应的水化物分别为X和Y,其中属于两性氢氧化物的是______ (填化学式),X和Y反应的离子方程式:__________________ 。
(6)元素①与②所形成的最简单有机物分子中含有____________ 个电子。元素①与②所形成的最简单烯烃为Z,写出Z与水在催化剂、加热、加压条件下反应的化学方程式:___________ ,该反应生成物的官能团是_____________ (填名称),反应类型为____________ 。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素⑦的原子结构示意图:
(2)元素⑤~⑧中原子半径最大的是
(3)元素①~⑨中化学性质最不活泼的是
(4)元素③的氢化物,分子的空间构型呈
(5)元素⑤和⑥的最高价氧化物对应的水化物分别为X和Y,其中属于两性氢氧化物的是
(6)元素①与②所形成的最简单有机物分子中含有
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】下表是元素周期表的一部分,表中的每个序号代表一种短周期元素。
(1)元素①和②原子半径较大的是_________ ;
(2)元素③的最高价氧化物对应的水化物的化学式为___________ ;
(3)元素④和⑤可组成原子个数比为1:1的化合物,化学式为_________ ;
(4)元素⑤和⑥分别形成的最高价氧化物对应的水化物之间发生反应的离子方程式为_______________ ;
(5)在元素⑦和⑧的原子分别形成的简单阴离子中,离子半径较大的是________ (填离子符号)。
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素①和②原子半径较大的是
(2)元素③的最高价氧化物对应的水化物的化学式为
(3)元素④和⑤可组成原子个数比为1:1的化合物,化学式为
(4)元素⑤和⑥分别形成的最高价氧化物对应的水化物之间发生反应的离子方程式为
(5)在元素⑦和⑧的原子分别形成的简单阴离子中,离子半径较大的是
您最近半年使用:0次



