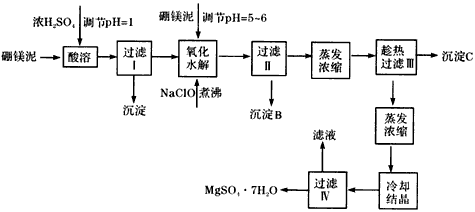
七水硫酸镁(MgSO4·7H2O)为白色细小四角柱状结晶,无臭,味苦,在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、CaO、B2O3、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2两种盐的溶解度(单位为g/100g水)
硼镁泥制取七水硫酸镁的工艺流程如下
根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施_______________ 。
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式_____________________
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:__________________ 。
(4)加入硼镁泥调节pH=5~6目的是________________ 。
(5)得到的沉淀C的组成是_________________ (填化学式),过滤Ⅲ需趁热过滤,原因是___________ 。
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是____________ 。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | — |
根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:
(4)加入硼镁泥调节pH=5~6目的是
(5)得到的沉淀C的组成是
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是
更新时间:2017-04-26 10:31:11
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】2021年10月16日6时56分,神舟十三号载人飞船与空间站组合体完成自主快速交会对接。中国空间站开启有人长期驻留时代。空间站的水气整合系统利用“萨巴蒂尔反应”,将CO2转化为CH4和水蒸气,配合O2生成系统可实现O2的再生。回答下列问题:
Ⅰ. 萨巴蒂尔反应为:CO2(g)+ 4H2(g) CH4(g)+2H2O(g)△H1
CH4(g)+2H2O(g)△H1
(1)常温常压下,已知:① 和
和 的燃烧热(
的燃烧热( )分别为-285.5 kJ/mol和-890.0 kJ/mol;
)分别为-285.5 kJ/mol和-890.0 kJ/mol;
② △H2=+44.0 kJ/mol。则
△H2=+44.0 kJ/mol。则 =
=___________ kJ/mol。
(2)在某一恒容密闭容器中加入CO2、H2,其分压分别为15kPa、 30kPa, 加入催化剂并加热使其发生萨巴蒂尔反应。研究表明CH4的反应速率v(CH4)= 1.2×10-6p(CO2)p4(H2) (kPa﹒s-1), 某时刻测得H2O(g)的分压为10kPa,则该时刻v(H2)=___________ 。
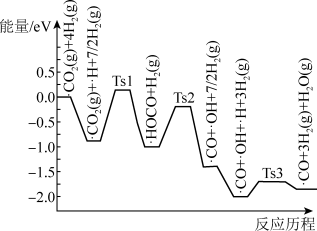
(3)研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“﹒”标注,Ts 表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会___________ (填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为___________ 。
Ⅱ.某研究团队经实验证明,CO2在一定条件下与H2O发生氧再生反应:
CO2(g)+ 2H2O(g) CH4(g)+2O2(g)△H1=
CH4(g)+2O2(g)△H1=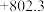

(4)恒压条件时,按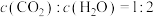 投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。
投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。
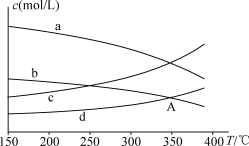
350℃时,A点的平衡常数为
______ (填计算结果)。为提高CO2的转化率,除改变温度外,还可采取的措施为____________ 。
(5)氧再生反应可以通过酸性条件下半导体光催化转化实现;反应机理如图所示:

①光催化CO2转化为CH4的阴极方程式为__________________ 。
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是_____________ 。
Ⅰ. 萨巴蒂尔反应为:CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g)△H1
CH4(g)+2H2O(g)△H1(1)常温常压下,已知:①
 和
和 的燃烧热(
的燃烧热( )分别为-285.5 kJ/mol和-890.0 kJ/mol;
)分别为-285.5 kJ/mol和-890.0 kJ/mol;②
 △H2=+44.0 kJ/mol。则
△H2=+44.0 kJ/mol。则 =
=(2)在某一恒容密闭容器中加入CO2、H2,其分压分别为15kPa、 30kPa, 加入催化剂并加热使其发生萨巴蒂尔反应。研究表明CH4的反应速率v(CH4)= 1.2×10-6p(CO2)p4(H2) (kPa﹒s-1), 某时刻测得H2O(g)的分压为10kPa,则该时刻v(H2)=
(3)研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“﹒”标注,Ts 表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会

Ⅱ.某研究团队经实验证明,CO2在一定条件下与H2O发生氧再生反应:
CO2(g)+ 2H2O(g)
 CH4(g)+2O2(g)△H1=
CH4(g)+2O2(g)△H1=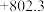

(4)恒压条件时,按
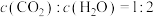 投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。
投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。
350℃时,A点的平衡常数为

(5)氧再生反应可以通过酸性条件下半导体光催化转化实现;反应机理如图所示:

①光催化CO2转化为CH4的阴极方程式为
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是
您最近半年使用:0次
【推荐2】氨是最重要的氮肥,也是产量最大的化工产品之一
Ⅰ.合成氨工艺是人工固氮的重要途径。
(1)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:
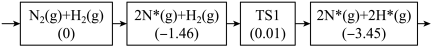
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字单位:eV)其中,TS表示过渡态,*表示吸附态。
①请写出N2参与化学吸附的反应方程式:___________ ;
②以上历程须克服的最大势垒为___________ eV。
(2)在使用同一催化剂时,将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化(a点恰好达到平衡),曲线B表示T1时n(NH3)的变化。
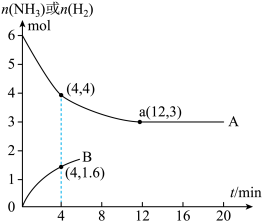
①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)___________ v(逆)(填“>”、“<”或“=”)。
②能否由图中数据得出温度T1>T2,并说明理由___________ 。
Ⅱ.氨也可以用电化学法合成。
(3)如图是用低温固体质子导体作为电解质,用Pt-C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
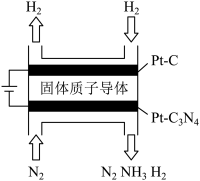
①Pt-C3N4电极反应产生NH3的电极反应式为___________ ;
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因___________ 。
Ⅲ.
(4)25℃时用氨水吸收甲酸可得到HCOONH4溶液,已知25℃时甲酸的电离常数Ka=1.8×10-4,NH3•H2O的电离常数Kb=1.8×10-5。计算反应NH3•H2O+HCOOH HCOO-+NH
HCOO-+NH +H2O的平衡常数K=
+H2O的平衡常数K=___________ 。
Ⅰ.合成氨工艺是人工固氮的重要途径。
(1)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:

注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字单位:eV)其中,TS表示过渡态,*表示吸附态。
①请写出N2参与化学吸附的反应方程式:
②以上历程须克服的最大势垒为
(2)在使用同一催化剂时,将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2时n(H2)的变化(a点恰好达到平衡),曲线B表示T1时n(NH3)的变化。

①T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的80%,则此时v(正)
②能否由图中数据得出温度T1>T2,并说明理由
Ⅱ.氨也可以用电化学法合成。
(3)如图是用低温固体质子导体作为电解质,用Pt-C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:

①Pt-C3N4电极反应产生NH3的电极反应式为
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因
Ⅲ.
(4)25℃时用氨水吸收甲酸可得到HCOONH4溶液,已知25℃时甲酸的电离常数Ka=1.8×10-4,NH3•H2O的电离常数Kb=1.8×10-5。计算反应NH3•H2O+HCOOH
 HCOO-+NH
HCOO-+NH +H2O的平衡常数K=
+H2O的平衡常数K=
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】化合物PH4I是一种白色晶体,受热不稳定,易分解产生PH3。PH3是无色剧毒气体, 广泛用于半导体器件和集成电路生产的外延、离子注入和掺杂。
(1)在2L真空密闭容器中加入一定量PH4I固体,T1℃ 时发生如下反应: PH4I(s) ⇌ PH3(g) + HI(g)
①下列可以作为反应达到平衡的判据是_____ 。
A.容器内气体的压强不变
B.容器内 HI 的气体体积分数不变
C.容器内 PH4I 质量不变
D.容器内气体的密度不变
E.容器内气体的平均相对分子质量不变
②t1时刻反应达到平衡后,在t2时刻维持温度不变瞬间缩小容器体积至1L,t3时刻反应重新达到 平衡。在下图中画出t2~t4时段的υ正、υ逆随时间变化图______ 。

(2)PH4I固体分解产生的PH3和HI均不稳定,在一定温度下也开始分解。在2L真空密闭容器中加 入一定量PH4I固体,已知在T2℃ 时存在如下反应:
Ⅰ PH4I(s) ⇌ PH3(g) + HI(g) ΔH1
Ⅱ 4 PH3(g)⇌ P4(g) + 6 H2(g) ΔH2
Ⅲ 2 HI(g)⇌ H2 (g) + I2(g) ΔH3
①已知:298K,101kPa,H-P键、P-P键、H-H键的键能分别为322 kJ·mol-1、200 kJ·mol-1、436 kJ·mol-1试计算ΔH2 =______________ 。
②各反应均达平衡时,测得体系中 n(PH3)=a mol ,n(P4)=b mol ,n(H2)=c mol ,则 T2℃时 反应I的平衡常数K值为___________________ 。(用a、b、c表示)
③维持温度不变,缩小体积增大压强,达到新的平衡后,发现其它各成分的物质的量均发生变化,而n(I2)基本不变,试解释可能原因_____ 。
(1)在2L真空密闭容器中加入一定量PH4I固体,T1℃ 时发生如下反应: PH4I(s) ⇌ PH3(g) + HI(g)
①下列可以作为反应达到平衡的判据是
A.容器内气体的压强不变
B.容器内 HI 的气体体积分数不变
C.容器内 PH4I 质量不变
D.容器内气体的密度不变
E.容器内气体的平均相对分子质量不变
②t1时刻反应达到平衡后,在t2时刻维持温度不变瞬间缩小容器体积至1L,t3时刻反应重新达到 平衡。在下图中画出t2~t4时段的υ正、υ逆随时间变化图

(2)PH4I固体分解产生的PH3和HI均不稳定,在一定温度下也开始分解。在2L真空密闭容器中加 入一定量PH4I固体,已知在T2℃ 时存在如下反应:
Ⅰ PH4I(s) ⇌ PH3(g) + HI(g) ΔH1
Ⅱ 4 PH3(g)⇌ P4(g) + 6 H2(g) ΔH2
Ⅲ 2 HI(g)⇌ H2 (g) + I2(g) ΔH3
①已知:298K,101kPa,H-P键、P-P键、H-H键的键能分别为322 kJ·mol-1、200 kJ·mol-1、436 kJ·mol-1试计算ΔH2 =
②各反应均达平衡时,测得体系中 n(PH3)=a mol ,n(P4)=b mol ,n(H2)=c mol ,则 T2℃时 反应I的平衡常数K值为
③维持温度不变,缩小体积增大压强,达到新的平衡后,发现其它各成分的物质的量均发生变化,而n(I2)基本不变,试解释可能原因
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:
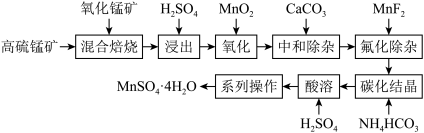
已知:
①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为________ 。
(2)“氧化”时,发生反应的离子方程式为_________________________ 。若省略“氧化”步骤,造成的后果是_________________________ 。
(3)“中和除杂”时,生成沉淀的主要成分为______________________ (填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________ 。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“系列操作”指___________ 、过滤、洗涤、干燥。

已知:
①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为
(2)“氧化”时,发生反应的离子方程式为
(3)“中和除杂”时,生成沉淀的主要成分为
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于
(5)“系列操作”指
您最近半年使用:0次
【推荐2】I.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂,对臭氧层无破坏作用。
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H=—90.8kJ/mol
CH3OH(g) △H=—90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=—23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=—23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=—41.3kJ/mol
CO2(g)+H2(g) △H=—41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H =
CH3OCH3(g)+CO2(g)的△H =___________ ,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,下列选项中可以采取的措施是:___________ 。(填序号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.分离出二甲醚
(2)已知上述(1)中反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
①比较此时正、逆反应速率的大小:v正___________ v逆(填“>”、“<”或“=”)。
②若在此密闭容器中开始加入21molCH3OH,则达到平衡时c(CH3OH)=___________ ;
II.工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为:
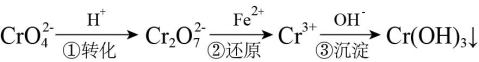
(3)流程第①步存在平衡:2CrO +2H+
+2H+ Cr2O
Cr2O +H2O,能说明第①步反应达平衡状态的是
+H2O,能说明第①步反应达平衡状态的是____ (填序号)
A.Cr2O 和CrO
和CrO 的浓度相同 B.2v(Cr2O
的浓度相同 B.2v(Cr2O )=v(CrO
)=v(CrO ) C.溶液的颜色不变
) C.溶液的颜色不变
(4)流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH—(aq)常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为
Cr3+(aq)+3OH—(aq)常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为_____ 。
方法2:电解法
(5)该法用Fe做电极电解含Cr2O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是_____ 。
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g) △H=—90.8kJ/mol
CH3OH(g) △H=—90.8kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H=—23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=—23.5kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) △H=—41.3kJ/mol
CO2(g)+H2(g) △H=—41.3kJ/mol总反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的△H =
CH3OCH3(g)+CO2(g)的△H =a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.分离出二甲醚
(2)已知上述(1)中反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量/(mol) | 4.0 | 6.0 | 6.0 |
②若在此密闭容器中开始加入21molCH3OH,则达到平衡时c(CH3OH)=
II.工业废水中常含有一定量的Cr2O
 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。方法1:还原沉淀法。该法的工艺流程为:

(3)流程第①步存在平衡:2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O,能说明第①步反应达平衡状态的是
+H2O,能说明第①步反应达平衡状态的是A.Cr2O
 和CrO
和CrO 的浓度相同 B.2v(Cr2O
的浓度相同 B.2v(Cr2O )=v(CrO
)=v(CrO ) C.溶液的颜色不变
) C.溶液的颜色不变(4)流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH—(aq)常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为
Cr3+(aq)+3OH—(aq)常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为方法2:电解法
(5)该法用Fe做电极电解含Cr2O
 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、 Al2O3、MgO、CaO等杂质) 制备钴的氧化物,其制备工艺流程如下:
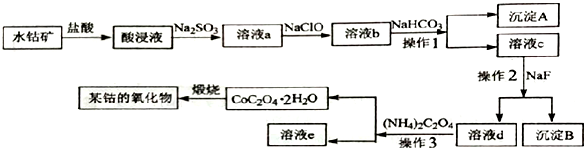
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________ (任写一种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______________________________ 。
(3)溶液a中加入NaClO的作用为_______________________________ 。
(4)沉淀A 的成分为__________________ 。操作2的名称是___________________ 。
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时溶液中c(Ca2+)最大等于_________ mol·L-1。
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为_______________________________ 。

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式
(3)溶液a中加入NaClO的作用为
(4)沉淀A 的成分为
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时溶液中c(Ca2+)最大等于
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为
您最近半年使用:0次



