高铁酸钠(Na2FeO4)是一种新型、高效的水处理剂,与水反应的化学方程式为:4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH。电解制备 Na2FeO4装置示意图如下。
(1)a是电源的______________ 极(填“正”或“负”)。电解时,石墨电极附近溶液的碱性____________ (填“增强”、“减弱”或“不变”)。
(2)铁电极的反应式为__________________________ 。
(3)维持一定的电流强度和电解温度,NaOH起始浓度对Na2FeO4浓度影响如下图(电解液体积相同情况下进行实验)。
①电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是______________ (填“增大”、“不变”或“减小”)。
②当NaOH起始浓度为16mol·L-1,1.0~2.0h内生成Na2FeO4的速率是_____________ mol·L-1·h-1。
③A 点与B 点相比,n[Fe(OH)3]: A_____________ B (填“>”、 “=”或“<” )
(4)提纯电解所得Na2FeO4,采用重结晶、过滤、洗涤、低温烘干的方法,则洗涤剂最好选用______________ 溶液(填标号)和异丙醇。
A.Fe(NO3)3B.NH4ClC.CH3COONa
(5)次氯酸钠氧化法也可以制得Na2FeO4。
已知 2H2(g)+O2(g)=2H2O (1) △H=akJ·mol-1
NaCl(aq)+ H2O(1)=NaClO(aq)+H2(g) △H=bkJ·mol-1
4Na2FeO4(aq)+10H2O(1)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) △H=c kJ·mol-1
反应 2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1)的△H=______________ kJ·mol-1。

(1)a是电源的
(2)铁电极的反应式为
(3)维持一定的电流强度和电解温度,NaOH起始浓度对Na2FeO4浓度影响如下图(电解液体积相同情况下进行实验)。

①电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是
②当NaOH起始浓度为16mol·L-1,1.0~2.0h内生成Na2FeO4的速率是
③A 点与B 点相比,n[Fe(OH)3]: A
(4)提纯电解所得Na2FeO4,采用重结晶、过滤、洗涤、低温烘干的方法,则洗涤剂最好选用
A.Fe(NO3)3B.NH4ClC.CH3COONa
(5)次氯酸钠氧化法也可以制得Na2FeO4。
已知 2H2(g)+O2(g)=2H2O (1) △H=akJ·mol-1
NaCl(aq)+ H2O(1)=NaClO(aq)+H2(g) △H=bkJ·mol-1
4Na2FeO4(aq)+10H2O(1)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) △H=c kJ·mol-1
反应 2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1)的△H=
更新时间:2017-05-11 19:48:07
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)据反应①②③可推导出K1、K2与K3之间的关系,则K3=___________ (用K1、K2表示)。
(2)反应③的△H___________0(填“>”或“<”)。
(3)500°C时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为1.0、0.1、0.3、0.15,则此时v正___________ v逆(填“>”“=”或“<”)。
(Ⅱ)工业制硫酸的过程中,SO2(g)转化为SO3(g)是关键的一步,550°C时,在1L的恒温容器中,反应过程中部分数据见下表:
(4)若在起始时总压为p0kPa,反应速率若用单位时间内分压的变化表示,气态物质分压=总压×气态物质的物质的量分数,则10min内SO2(g)的反应速率v(SO2)=___________ kPa·min-1.
| 化学反应 | 平衡常数 | 温度/°C | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | ||
(2)反应③的△H___________0(填“>”或“<”)。
(3)500°C时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为1.0、0.1、0.3、0.15,则此时v正
(Ⅱ)工业制硫酸的过程中,SO2(g)转化为SO3(g)是关键的一步,550°C时,在1L的恒温容器中,反应过程中部分数据见下表:
| 反应时间/min | SO2(g)/mol | O2(g)/mol | SO3(g)/mol |
| 0 | 4 | 2 | 0 |
| 5 | 1.5 | ||
| 10 | 2 | ||
| 15 | 1 |
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】按要求写热化学方程式:
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式___________________ 。
(2)碳的燃烧热为393.50kJ·mol-1,写出表示C燃烧热的热化学方程式:____________________________________________ 。
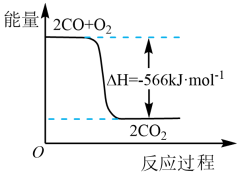
(3)已知CO转化成CO2的能量关系如下图所示。写出该反应的热化学方程式:_______________________________________________ 。
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+ O2(g)=H2O(l) ΔH3=-285.8kJ/mol
O2(g)=H2O(l) ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式____________________ 。
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(2)碳的燃烧热为393.50kJ·mol-1,写出表示C燃烧热的热化学方程式:
(3)已知CO转化成CO2的能量关系如下图所示。写出该反应的热化学方程式:

(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+
 O2(g)=H2O(l) ΔH3=-285.8kJ/mol
O2(g)=H2O(l) ΔH3=-285.8kJ/mol写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】一碳产品是石油的良好替代品,一碳化学与绿色化工结合可以实现经济与环境的协调发展。甲醇-水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇-水蒸气重整制氢的部分反应过程如图1所示:
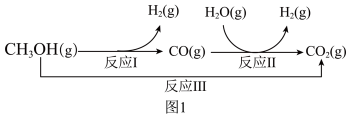
(1)已知一定条件下
反应I:CH3OH(g) ⇌CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) ⇌H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=_______ 。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。
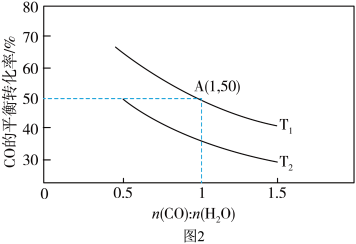
①比较T1、T2的大小,T1_______ T2(填“>”“<”或“=”)。原因为: _______
②T1温度时,按下表数据开始反应建立平衡:
应进行到t时刻时,判断v(正)、v(逆)的大小关系为断v(正)_______ v(逆(填“>“<”或“=”)。
(3)CO2在生产中有着广泛的用途。在弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。
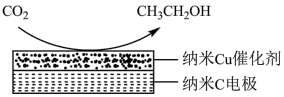
CO2参与反应的一极为_______ (填“阴极”或“阳极”),电极反应式是_______ 。

(1)已知一定条件下
反应I:CH3OH(g) ⇌CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) ⇌H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。

①比较T1、T2的大小,T1
②T1温度时,按下表数据开始反应建立平衡:
| CO | H2O | H2 | CO2 | |
| 起始浓度/(mol·L-1) | 2 | 1 | 0 | 0 |
| t时刻浓度/(mol·L-1) | 1.5 | 0.5 | 0.5 | 0.5 |
(3)CO2在生产中有着广泛的用途。在弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。
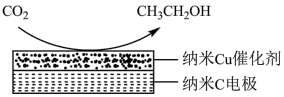
CO2参与反应的一极为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
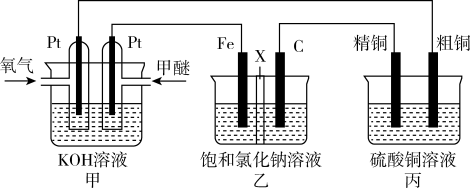
(1)写出负极的电极反应式________________________ 。
(2)石墨电极(C)的电极反应式为___________________ 。
(3)反应一段时间后,乙装置中生成NaOH主要在__________ (填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中锌先于金属铜放电进入溶液,反应一段时间,硫酸铜溶液浓度将_________ (填“增大”、“减小”或“不变”)
(5)若在标准状况下,有2.24L氧气参加反应,则在乙装置中铁电极上生成的气体在标准状况下的体积为__________________

(1)写出负极的电极反应式
(2)石墨电极(C)的电极反应式为
(3)反应一段时间后,乙装置中生成NaOH主要在
(4)如果粗铜中含有锌、银等杂质,丙装置中锌先于金属铜放电进入溶液,反应一段时间,硫酸铜溶液浓度将
(5)若在标准状况下,有2.24L氧气参加反应,则在乙装置中铁电极上生成的气体在标准状况下的体积为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】按要求填空。
(1)利用铅蓄电池电解氯化钠溶液,其在充电时阳极反应为____ ,放电生成的固体会附聚在电极表面,工作过程中若正极质量增重96g时,理论上电路中转移的电子数为____ 。
(2)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为_______ 。
(3)某实验小组同学对电化学原理进行了一系列探究活动。
①如图1为某实验小组依据氧化还原反应:(用离子方程式表示)_____ 设计的原电池装置
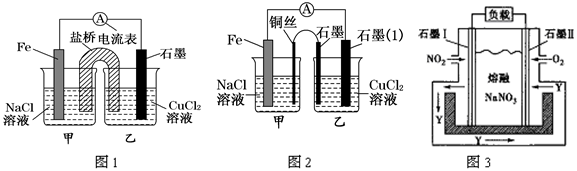
②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图2所示。
在甲装置中铜电极反应为_______________ ;乙装置中石墨(1)为________ 极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为_________________ .
③某课题组利用图3所示装置,探究NO2和O2化合生成N2O5形成原电池的过程,该电池的正极反应式应为___________ 。
(1)利用铅蓄电池电解氯化钠溶液,其在充电时阳极反应为
(2)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为
(3)某实验小组同学对电化学原理进行了一系列探究活动。
①如图1为某实验小组依据氧化还原反应:(用离子方程式表示)

②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图2所示。
在甲装置中铜电极反应为
③某课题组利用图3所示装置,探究NO2和O2化合生成N2O5形成原电池的过程,该电池的正极反应式应为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】I .按下图装置进行实验,并回答下列问题:

(1)锌极为_____ 极,电极反应式为_____________ 。
(2)石墨棒C1为____ 极,电极反应式为____________ ;石墨棒C2附近发生的实验现象为___________ 。
(3)当C2极析出224mL气体(标准状态)时,锌的质量减少____ g;此时装置B中OH-的物质的量为____ mol。
II. (1)电工经常说的一句口头禅:铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:________________ 。
(2)请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请写出电极反应式,负极_______ ,正极___________ 。
(3)并在方框内画出实验装置图,并标出外电路电子流向。

(1)锌极为
(2)石墨棒C1为
(3)当C2极析出224mL气体(标准状态)时,锌的质量减少
II. (1)电工经常说的一句口头禅:铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:
(2)请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请写出电极反应式,负极
(3)并在方框内画出实验装置图,并标出外电路电子流向。
您最近一年使用:0次



