25 ℃时,水的电离达到平衡:H2O H++OH-。下列叙述错误的是
H++OH-。下列叙述错误的是
 H++OH-。下列叙述错误的是
H++OH-。下列叙述错误的是| A.向水中通入氨气,平衡逆向移动,c(OH-)增大 |
| B.向水中加入少量稀硫酸,c(H+)增大,Kw不变 |
| C.将水加热平衡正向移动,Kw变大 |
| D.升高温度,平衡正向移动,c(H+)增大,pH不变 |
2017高三·江苏·专题练习 查看更多[11]
福建省德化一中、永安一中、漳平一中三校协作2023-2024学年高二上学期12月联考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第47练 水的电离和溶液的pH山东省济南市莱钢高级中学2022-2023学年高二上学期期中考试化学试题山东省2022-2023学年高二上学期学业水平测试化学试题山东师范大学附属中学2022-2023学年高二上学期第一次月考化学试题(已下线)第22讲 水的电离与溶液的pH(练)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题2 水的电离平衡复习题河北省张家口市怀来县新保安第二中学2019-2020学年高二上学期11月月考化学试题河北省张家口市宣化一中、张北一中2019-2020学年高二上学期期中联考化学试题(已下线)2019年10月13日 《每日一题》选修4-每周一测2018版化学(苏教版)高考总复习专题八课时跟踪训练--水的电离和溶液的酸碱性
更新时间:2017-08-19 09:43:22
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,向1 L0.1 mol·L-1 NH4C1溶液中,逐渐加入NaOH固体粉末,随着n(NaOH)的变化,c(NH4+)与c(NH3·H2O)的变化趋势如下图所示(不考虑体积变化、氨的挥发、温度的变化)。下列说法正确的是
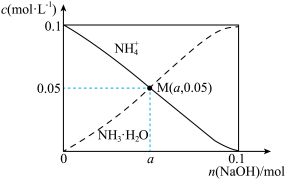

| A.M点溶液中水的电离程度比原溶液大 |
| B.在M点时,n(OH-)+0.1 mol=(a+0.05)mol |
| C.随着NaOH的加入,c(H+)/c(NH4+)不断减小 |
| D.当n(NaOH)=0.1 mol时,c(Na+)<c(NH4+)+c(NH3·H2O) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,向20mL0.01mol·L-1的NaOH溶液中逐滴加入0.01mol·L-1的CH3COOH溶液,溶液中水所电离出的c(OH-)的对数随加入 CH3COOH溶液的体积变化如图所示,下列说法正确的是
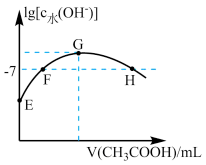

| A.F点溶液显中性 |
| B.若G点由水电离出的c(OH-)=2.24×10-6mol·L-1,则Ka(CH3COOH)≈1×10-6 |
| C.H点离子浓度关系为c( CH3COO-)=c(Na+)>c(H+)=c(OH-) |
| D.E点由水电离的c(H+)=10-3mol·L-1 |
您最近一年使用:0次

 时,水的电离达到平衡:
时,水的电离达到平衡:
 ,下列叙述正确的是
,下列叙述正确的是 增大,
增大, 增大
增大 增大
增大 ,
, 增大
增大 浓溶液,平衡逆向移动,
浓溶液,平衡逆向移动, 降低
降低

