氰化钠被广泛用于电镀、金的提取以及有机合成中,但含氰废水属于高毒类,必须对其进行处理。
(1)向NaCN溶液中通入CO2能发生反应:NaCN+H2O+CO2=HCN+NaHCO3,说明酸性:HCN_______ H2CO3(填“>”或“<”)。
(2)含CN-浓度较低的废水可直接用FeSO4·7H2O处理,得到一种蓝色沉淀M,M的摩尔质量为592 g·mol-1,则M的化学式为_______ 。
(3)pH在7.5〜10之间且铜作催化剂的条件下,用SO2-空气处理含氰废水会生成NH3、碳酸氢盐及硫酸盐,已知参与反应的SO2与O2的物质的量之比为1∶1,则该反应的离子方程式为_______ 。
(4)工业上常用碱性氯化法处理含氰废水,其原理如下图所示:
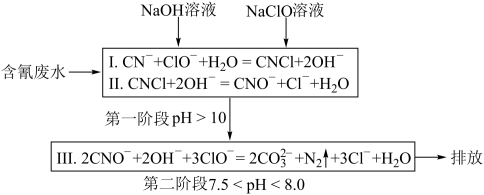
①第一阶段的中间体CNCl中碳元素的化合价为_______ 。
②某工厂含氰废水中NaCN的含量为14.7 mg·L-1,处理10m3这样的废水,理论上需要5 mol·L-1 NaClO溶液_______ L。
(1)向NaCN溶液中通入CO2能发生反应:NaCN+H2O+CO2=HCN+NaHCO3,说明酸性:HCN
(2)含CN-浓度较低的废水可直接用FeSO4·7H2O处理,得到一种蓝色沉淀M,M的摩尔质量为592 g·mol-1,则M的化学式为
(3)pH在7.5〜10之间且铜作催化剂的条件下,用SO2-空气处理含氰废水会生成NH3、碳酸氢盐及硫酸盐,已知参与反应的SO2与O2的物质的量之比为1∶1,则该反应的离子方程式为
(4)工业上常用碱性氯化法处理含氰废水,其原理如下图所示:

①第一阶段的中间体CNCl中碳元素的化合价为
②某工厂含氰废水中NaCN的含量为14.7 mg·L-1,处理10m3这样的废水,理论上需要5 mol·L-1 NaClO溶液
更新时间:2017-10-15 17:58:21
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】有关物质的量的计算填空:
(1)2 mol NH3▪H2O中约含_____ 个H原子,所含氧原子跟_____ g H2O所含氧原子个数相等。
(2)①标准状况下,22.4 LNH3;②1.5 mol CH4;③1.204×1024个H2O;④标准状况下,73 g HCl。所含H原子个数由多到少的顺序是_____ (填序号)。
(3)20.6 g Na2R含有Na+0.2 mol,则NaR的摩尔质量为_____ 。
(4)100 mL某Al2(SO4)3溶液中,n(Al3+)=0.2mol,则其中c(SO )=
)=_____ mol▪L-1。
(1)2 mol NH3▪H2O中约含
(2)①标准状况下,22.4 LNH3;②1.5 mol CH4;③1.204×1024个H2O;④标准状况下,73 g HCl。所含H原子个数由多到少的顺序是
(3)20.6 g Na2R含有Na+0.2 mol,则NaR的摩尔质量为
(4)100 mL某Al2(SO4)3溶液中,n(Al3+)=0.2mol,则其中c(SO
 )=
)=
您最近一年使用:0次
【推荐2】实验室常用邻苯二甲酸氢钾(KHC8H4O4)来测定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。若氢氧化钠溶液的浓度为0.1mol·L-1,到达终点时,溶液的pH约为9.1。
(1)在测定氢氧化钠溶液浓度时,有下列操作:①向溶液中加入1-2滴指示剂②向锥形瓶中加20-30mL蒸馏水溶解③用氢氧化钠溶液滴定到终点,半分钟不褪色④重复以上操作⑤准确称取0.4-0.5g邻苯二甲酸氢钾加入250mL锥形瓶中⑥根据两次实验数据计算氢氧化钠的物质的量浓度。
以上各步中,正确的(填序号)操作顺序是___ 。
(2)该实验应选用___ 作指示剂,达到滴定终点时溶液由___ 色变为___ 色。
(3)上述操作中,将邻苯二甲酸氢钾直接放到锥形瓶中溶解,对实验是否有影响?___ ,并说明理由:___ 。
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作将造成实验结果___ (填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(分子量204.2)晶体0.5105g,溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH20.00mL,则NaOH溶液的浓度为___ (结果保留四位有效数字)。
(1)在测定氢氧化钠溶液浓度时,有下列操作:①向溶液中加入1-2滴指示剂②向锥形瓶中加20-30mL蒸馏水溶解③用氢氧化钠溶液滴定到终点,半分钟不褪色④重复以上操作⑤准确称取0.4-0.5g邻苯二甲酸氢钾加入250mL锥形瓶中⑥根据两次实验数据计算氢氧化钠的物质的量浓度。
以上各步中,正确的(填序号)操作顺序是
(2)该实验应选用
(3)上述操作中,将邻苯二甲酸氢钾直接放到锥形瓶中溶解,对实验是否有影响?
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作将造成实验结果
(5)现准确称取KHC8H4O4(分子量204.2)晶体0.5105g,溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH20.00mL,则NaOH溶液的浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】请按要求填空:
(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为___________ 。
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍。则X的相对原子质量为___________ 。
(3)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mL A受热完全分解生成15mL O2和10mL F2,则A的化学式为___________ 。
(4)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为___________ 。
(5)质量分数为98%,密度为1.84g·cm-3的某浓硫酸,溶质的物质的量浓度为___________ 。
(6)a个X原子的总质量为b g,则X的相对原子质量可表示为___________ 。
(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍。则X的相对原子质量为
(3)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mL A受热完全分解生成15mL O2和10mL F2,则A的化学式为
(4)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为
(5)质量分数为98%,密度为1.84g·cm-3的某浓硫酸,溶质的物质的量浓度为
(6)a个X原子的总质量为b g,则X的相对原子质量可表示为
您最近一年使用:0次
【推荐1】氢氧化钠是白色固体,易潮解,具有强腐蚀性,所以又叫火碱、烧碱、苛性钠。是常用的碱性干燥剂,是重要的化工原料。
工业制法:氯碱工业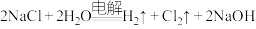
苛化法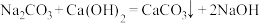
在实验室,钠、氧化钠 、过氧化钠
、过氧化钠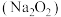 分别与水反应都生成
分别与水反应都生成
回答下列问题:
(1)在“氯碱工业”反应中,反应前后氯元素的化合价变化是_______ (填“升高”、“降低”、“不变”)。
(2) 可拆写,苛化法反应前后
可拆写,苛化法反应前后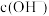
___________ (填“变大”、“变小”、“不变”)。
(3)写出 与水反应的化学方程式
与水反应的化学方程式___________ 。
(4)补项:过氧化钠与水反应为: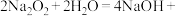
___________ ↑。
(5) 固体不能干燥酸性气体。能用
固体不能干燥酸性气体。能用 固体干燥的气体是
固体干燥的气体是___________ (填序号)。
a. b.
b. c.
c. (碱性气体) d.
(碱性气体) d.
(6)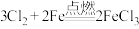 ,氯化铁能催化双氧水分解
,氯化铁能催化双氧水分解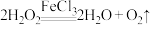 其反应机理为:①
其反应机理为:① ;②
;② 。在反应①中,
。在反应①中, 是还原剂,在反应②中,
是还原剂,在反应②中, 是
是___________ 剂(填“氧化”或“还原”)。
工业制法:氯碱工业
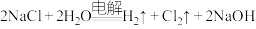
苛化法
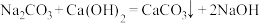
在实验室,钠、氧化钠
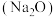 、过氧化钠
、过氧化钠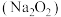 分别与水反应都生成
分别与水反应都生成
回答下列问题:
(1)在“氯碱工业”反应中,反应前后氯元素的化合价变化是
(2)
 可拆写,苛化法反应前后
可拆写,苛化法反应前后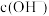
(3)写出
 与水反应的化学方程式
与水反应的化学方程式(4)补项:过氧化钠与水反应为:
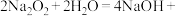
(5)
 固体不能干燥酸性气体。能用
固体不能干燥酸性气体。能用 固体干燥的气体是
固体干燥的气体是a.
 b.
b. c.
c. (碱性气体) d.
(碱性气体) d.
(6)
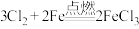 ,氯化铁能催化双氧水分解
,氯化铁能催化双氧水分解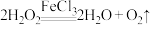 其反应机理为:①
其反应机理为:① ;②
;② 。在反应①中,
。在反应①中, 是还原剂,在反应②中,
是还原剂,在反应②中, 是
是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(12分)现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣=H2O,该离子反应对应的化学方程式为______________ 。
(2)⑩在水中的电离方程式为___________________________ 。
(3)以上属于电解质的共有____________ 种。
(4)过量的 ④通入⑥的溶液中反应的离子方程式为_____________________________ 。
(5)② 与 ⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,当有5.4g Al发生反应时,转移电子的物质的量为______ ,该反应的离子方程式为__________ 。
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣=H2O,该离子反应对应的化学方程式为
(2)⑩在水中的电离方程式为
(3)以上属于电解质的共有
(4)过量的 ④通入⑥的溶液中反应的离子方程式为
(5)② 与 ⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,当有5.4g Al发生反应时,转移电子的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】按要求填空:
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是________ ,只有还原性的是________ ,既有氧化性又有还原性的是________ 。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是________ 。
(3)下列三个氧化还原反应中,氧化性最强的物质是______ 。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是
(3)下列三个氧化还原反应中,氧化性最强的物质是
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
您最近一年使用:0次



