分析如图所示装置,完成下列各题。
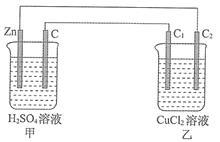
(1)一段时间后,可能发现的现象是:甲池,Zn棒逐渐溶解,石墨棒上有____________ 产生。与Zn棒相连的石墨棒质量____________ (填“增大”“减小”或“不变”)。
(2)甲池Zn极为____________ 极,电极反应式:____________________________________ 。
乙池中C1为____________ 极,电极反应式:____________________________________ 。乙池总反应式:____________________________________ 。

(1)一段时间后,可能发现的现象是:甲池,Zn棒逐渐溶解,石墨棒上有
(2)甲池Zn极为
乙池中C1为
2017高二·全国·课时练习 查看更多[2]
更新时间:2017-11-27 16:00:43
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1稀硫酸中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

(1)写出甲池中发生的有关电极反应式:负极__________ ,正极_____________ 。
(2)乙池中负极为________ ,正极发生________ 反应,总反应的离子方程式为___________ 。
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________ (填写元素符号,下同)活动性更强,而乙会判断出________ 活动性更强。
(4)由此实验,可得到如下哪些结论?________ 。
a.利用原电池反应判断金属活动性顺序应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序表已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应条件多变,应具体问题具体分析
(5)上述实验也反过来证明了“利用金属活动性顺序直接判断原电池中正、负极”的做法________ (填“可靠”或“不可靠”)。如不可靠,则请你提出另一个判断原电池正、负极可行的实验方案:__________ 。

(1)写出甲池中发生的有关电极反应式:负极
(2)乙池中负极为
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验,可得到如下哪些结论?
a.利用原电池反应判断金属活动性顺序应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序表已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应条件多变,应具体问题具体分析
(5)上述实验也反过来证明了“利用金属活动性顺序直接判断原电池中正、负极”的做法
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】原电池的发明是化学对人类的一项重大贡献。
I:如图所示,烧杯中都盛有稀硫酸。

(1)中反应的离子方程式为______________ ,
(2)中的电极反应:Fe:______________ 、Sn:______________ Sn极附近溶液的pH______________ (填增大、减小或不变),
(3)中被腐蚀的金属是______________ 、比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是______________
II:依据氧化还原反应:Cu+2Fe3+=2Fe2++Cu2+ 设计的原电池如图所示。

(1)电极 X 的材料是_____ ;电解质溶液 Y 是_____ 。
(2)Ag 电极上发生的反应为:_________ 。
(3)针对上述原电池装置,下列说法中不正确的是_____ 。(双选)
A.原电池工作时的总反应:Cu+2Fe3+=2Fe2++Cu2+
B.原电池工作时,X 电极流出电子,发生氧化反应
C.原电池工作时,银电极上发生氧化反应
D.原电池工作时,阴离子向 Ag 极移动
I:如图所示,烧杯中都盛有稀硫酸。

(1)中反应的离子方程式为
(2)中的电极反应:Fe:
(3)中被腐蚀的金属是
II:依据氧化还原反应:Cu+2Fe3+=2Fe2++Cu2+ 设计的原电池如图所示。

(1)电极 X 的材料是
(2)Ag 电极上发生的反应为:
(3)针对上述原电池装置,下列说法中不正确的是
A.原电池工作时的总反应:Cu+2Fe3+=2Fe2++Cu2+
B.原电池工作时,X 电极流出电子,发生氧化反应
C.原电池工作时,银电极上发生氧化反应
D.原电池工作时,阴离子向 Ag 极移动
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上___ (填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上____ (填“有”或“没有”)气泡产生。

(2)乙、丙装置是将_____ 能转化为____ 能的装置,人们把它叫做________ 。
Ⅱ.将质量相等的锌片和铜片用导线相连,并浸入500 mL硫酸铜溶液中构成如图所示的装置。

(1)该装置中总反应的离子方程式为____________ ,铜片周围溶液会出现_________ 的现象。
(2)若2 min后测得锌片质量减少1.3 g,则导线中流过的电子为________ mol。

(2)乙、丙装置是将
Ⅱ.将质量相等的锌片和铜片用导线相连,并浸入500 mL硫酸铜溶液中构成如图所示的装置。

(1)该装置中总反应的离子方程式为
(2)若2 min后测得锌片质量减少1.3 g,则导线中流过的电子为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)氢气是一种热值高、环境友好型燃料。等物质的量的氢气完全燃烧生成液态水与生成气态水相比,生成液态水时放出热量_______ (填“多”“少”或“相等”)。
(2)拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436kJ/mol,H─N键能为391kJ/mol,N≡N键能为946kJ/mol。根据键能计算工业合成氨时消耗1molN2能_______ (填“吸收”或“放出”)_______ kJ热量。
(3)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为_______ ,当线路中转移0.4mol电子时,则被腐蚀铜的质量为_______ g。
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH,请回答下列问题:
①放电时,正极发生_______ (填“氧化”或“还原”)反应,已知负极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应为_______ 。
②放电时,_______ (填“正”或“负”)极附近溶液的碱性增强。
(1)氢气是一种热值高、环境友好型燃料。等物质的量的氢气完全燃烧生成液态水与生成气态水相比,生成液态水时放出热量
(2)拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436kJ/mol,H─N键能为391kJ/mol,N≡N键能为946kJ/mol。根据键能计算工业合成氨时消耗1molN2能
(3)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH,请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH,请回答下列问题:①放电时,正极发生
②放电时,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】工业合成氨是最重要的人工固氮途径,发生反应: 。请回答:
。请回答:
(1)已知断开1mol的某化学键所需能量如表所示。若固氮反应中有2mol 生成时,
生成时,______ (填 “吸收”或“放出”)热量______ kJ。
(2)恒温恒压条件下,向密闭容器中投入等物质的量的 和
和 发生反应,下列描述能说明反应已达到化学平衡状态的是______。
发生反应,下列描述能说明反应已达到化学平衡状态的是______。
(3)利用 可消除大气污染物NO,可将反应设计为原电池提供电能,如图所示。该电池中M为原电池的
可消除大气污染物NO,可将反应设计为原电池提供电能,如图所示。该电池中M为原电池的______ 极(填“正”或“负”),其电极方程式为______ 。______ (填“a”、“b”或“c”)______
 。请回答:
。请回答:(1)已知断开1mol的某化学键所需能量如表所示。若固氮反应中有2mol
 生成时,
生成时,化学键 |
|
|
|
能量(kJ) | 436 | 391 | 946 |
(2)恒温恒压条件下,向密闭容器中投入等物质的量的
 和
和 发生反应,下列描述能说明反应已达到化学平衡状态的是______。
发生反应,下列描述能说明反应已达到化学平衡状态的是______。A.反应速率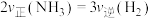 | B.混合气体的密度不再变化 |
| C.混合气体的平均摩尔质量不再变化 | D. 的体积分数不再变化 的体积分数不再变化 |
(3)利用
 可消除大气污染物NO,可将反应设计为原电池提供电能,如图所示。该电池中M为原电池的
可消除大气污染物NO,可将反应设计为原电池提供电能,如图所示。该电池中M为原电池的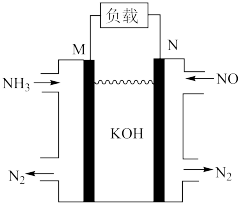


您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列内容。
(1)已知: 、
、 的燃烧热(
的燃烧热( )分别为
)分别为 和
和 ;
;
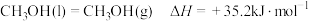 ;
;
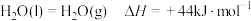 。
。
则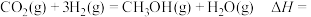
_______  。
。
(2)2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图所示)。其中吸附在Pd表面上的物种用*标注。该历程中最大能垒(活化能)为_______  ,该步骤的化学方程式为
,该步骤的化学方程式为_______ 。

(3)《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示。

多孔碳电极的电极反应式为_______ ,铝极反应为_______ ,随着反应的进行,碳呼吸电池中 浓度
浓度_______ (填“增大”“减小”或“不变”)。
(1)已知:
 、
、 的燃烧热(
的燃烧热( )分别为
)分别为 和
和 ;
;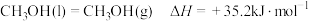 ;
;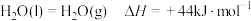 。
。则
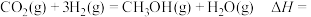
 。
。(2)2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图所示)。其中吸附在Pd表面上的物种用*标注。该历程中最大能垒(活化能)为
 ,该步骤的化学方程式为
,该步骤的化学方程式为
(3)《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示。

多孔碳电极的电极反应式为
 浓度
浓度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 和
和 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:

(1)甲烷燃料电池正负极的电极反应分别为_______ ,_______ 。
(2)闭合K开关后,a、b电极上均有气体产生。其中b电极上得到的是_______ ,电极a的电极反应方程式为_______ ;
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上最多能产生的氯气体积为_______ L(标准状况),通过电解池的电量为_______ (法拉第常数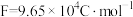 列式计算)。
列式计算)。
Ⅱ.如图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。

(4)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是_______ ,D电极上的电极反应式为_______ 。
(5)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时C电极上的电极反应式为_______ ,整套实验装置的总的离子方程式为_______ 。
 和
和 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
(1)甲烷燃料电池正负极的电极反应分别为
(2)闭合K开关后,a、b电极上均有气体产生。其中b电极上得到的是
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上最多能产生的氯气体积为
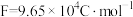 列式计算)。
列式计算)。Ⅱ.如图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。

(4)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是
(5)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时C电极上的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】已知:①甲为 CH4和 O2形成的燃料电池,电解质为固体电解质,能传导 O2-。
②乙中为 100 mL NaCl 溶液(足量),滴有酚酞,丙为 CuSO4 溶液。
③若 c、d 为惰性电极,通电时 c 电极附近首先出现红色。 请回答下列问题:

(1)b 处通入_____ (填“CH4”或“O2”),电极反应式为:_____ 。
(2)当乙中 pH=13 时,a 处通入标准状况下_____ mL 的_____ 气体(填“O2”或 “CH4”),c 电极的电极反应式为:_____ 。
(3)若用丙装置在 Fe 上镀 Cu,则 e 为_____ (填“Fe”或“Cu”),若 e,f 为惰性电极, 写出电解反应的离子方程式:_____ 。若 e,f 为惰性电极,丙中溶液为不饱和 Na2CO3溶液, 则电解过程中pH_____ (填“变大”、“不变”或“变小”),原因是_____ 。
②乙中为 100 mL NaCl 溶液(足量),滴有酚酞,丙为 CuSO4 溶液。
③若 c、d 为惰性电极,通电时 c 电极附近首先出现红色。 请回答下列问题:

(1)b 处通入
(2)当乙中 pH=13 时,a 处通入标准状况下
(3)若用丙装置在 Fe 上镀 Cu,则 e 为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某课外活动小组用如图所示装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则A极的电极反应式为___________ 。
(2)若开始时开关K与b极连接,则B极的电极反应式为___________ ,总反应的离子方程式为___________ 。
(3)若开始时开关K与b连接,下列说法正确的是___________  填字母
填字母 。
。
A.溶液中Cl-向B极移动。
B.该装置中电流的方向是:电源正极→石墨→饱和食盐水→ 铁。
C.反应一段时间后(食盐水的浓度足够大),加适量盐酸可恢复到电解前电解质溶液的浓度。
D.从A极处逸出的气体能使湿润的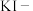 淀粉试纸变蓝,但一段时间后蓝色褪去。
淀粉试纸变蓝,但一段时间后蓝色褪去。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
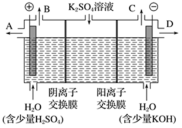
①该电解槽的阳极反应式为___________ 。
②制得的H2SO4溶液从出口___________  填“A”“B”“C”或“D”
填“A”“B”“C”或“D” 导出。
导出。
③在C出口收集到6.72 L(标况)的气体,则能制得___________ mol 的硫酸。

(1)若开始时开关K与a连接,则A极的电极反应式为
(2)若开始时开关K与b极连接,则B极的电极反应式为
(3)若开始时开关K与b连接,下列说法正确的是
 填字母
填字母 。
。A.溶液中Cl-向B极移动。
B.该装置中电流的方向是:电源正极→石墨→饱和食盐水→ 铁。
C.反应一段时间后(食盐水的浓度足够大),加适量盐酸可恢复到电解前电解质溶液的浓度。
D.从A极处逸出的气体能使湿润的
 淀粉试纸变蓝,但一段时间后蓝色褪去。
淀粉试纸变蓝,但一段时间后蓝色褪去。(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为
②制得的H2SO4溶液从出口
 填“A”“B”“C”或“D”
填“A”“B”“C”或“D” 导出。
导出。③在C出口收集到6.72 L(标况)的气体,则能制得
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图所示。

(1)完成“氧化”过程中反应的化学方程式:______FeCl3+______NaOH+______NaClO==______Na2FeO4+______ +______
+______ 。
。____________ 其中氧化剂是________ (填化学式)。
(2)“转化”过程中发生反应的化学方程式为____________________________________ 。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用________________ 溶解,然后________________ 。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为________________________________ 。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图所示。

(1)完成“氧化”过程中反应的化学方程式:______FeCl3+______NaOH+______NaClO==______Na2FeO4+______
 +______
+______ 。
。(2)“转化”过程中发生反应的化学方程式为
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,A、B、F三者原子序数之和为25,且知B、F同主族, 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成 氢气
氢气 标准状况下
标准状况下 ,
,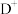 和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
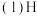 该元素在周期表中的位置
该元素在周期表中的位置__________ .
 由F、G二种元素形成化合物
由F、G二种元素形成化合物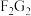 的电子式
的电子式______ ,含有化学键的类别为___________ .
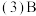 、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为
、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为________  用化学式表示
用化学式表示
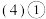 由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式
由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式__________
 在碱性条件下,G的单质可与
在碱性条件下,G的单质可与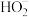 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐 ,该反应的离子方程式是
,该反应的离子方程式是_______ .
 熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气
熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气 ,用空气与
,用空气与 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入
的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入 的一极发生反应的电极反应式
的一极发生反应的电极反应式______ 。
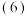 利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
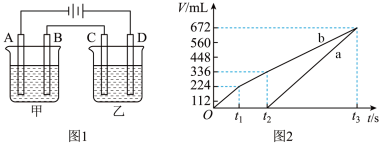
Ⅰ 甲槽电解的是
甲槽电解的是 一定浓度的NaCl与
一定浓度的NaCl与 的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示
的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示 气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计
气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计 。
。 的物质的量浓度为
的物质的量浓度为________  。
。
Ⅱ 乙槽为
乙槽为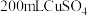 溶液,通电一段时间,当C极析出
溶液,通电一段时间,当C极析出 物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入
物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入________  填字母
填字母 。
。
A. B.
B. C.
C. D.
D.
 若通电一段时间后,向所得的乙槽溶液中加入
若通电一段时间后,向所得的乙槽溶液中加入 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________ 。
 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成 氢气
氢气 标准状况下
标准状况下 ,
,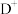 和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题: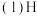 该元素在周期表中的位置
该元素在周期表中的位置 由F、G二种元素形成化合物
由F、G二种元素形成化合物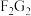 的电子式
的电子式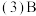 、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为
、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为 用化学式表示
用化学式表示
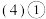 由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式
由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式 在碱性条件下,G的单质可与
在碱性条件下,G的单质可与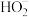 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐 ,该反应的离子方程式是
,该反应的离子方程式是 熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气
熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气 ,用空气与
,用空气与 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入
的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入 的一极发生反应的电极反应式
的一极发生反应的电极反应式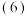 利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
Ⅰ
 甲槽电解的是
甲槽电解的是 一定浓度的NaCl与
一定浓度的NaCl与 的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示
的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示 气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计
气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计 。
。 的物质的量浓度为
的物质的量浓度为 。
。Ⅱ
 乙槽为
乙槽为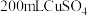 溶液,通电一段时间,当C极析出
溶液,通电一段时间,当C极析出 物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入
物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入 填字母
填字母 。
。A.
 B.
B. C.
C. D.
D.
 若通电一段时间后,向所得的乙槽溶液中加入
若通电一段时间后,向所得的乙槽溶液中加入 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】用 O2 将 HCl 转化为 Cl2,可提高效益,减少污染
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s) H2O(g)+CuCl2(g)△H1.反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为
H2O(g)+CuCl2(g)△H1.反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为_______ (反应热用△H1 和△H2 表示)。
(2)新型 RuO2 催化剂对上述 HCl 转化为 Cl2 的总反应具有更好的催化活性,

①实验测得在一定压强下,总反应的 HCl 平衡转化率随温度变化的 aHCl—T 曲线如图,则总反应的△H_______ 0(填“>”、“﹦”或“<”);A、B 两点的平衡常数 K(A)与 K(B)中较大的是_______ 。
②恒温恒容,下列能说明反应达到平衡状态的是_______ 。
A.△H 不变 B.密度不变 C.平均摩尔质量不变 D.颜色不变
③下列措施中有利于提高 aHCl 的有_______ 。
A.增大 n(HCl) B.增大 n(O2)
C.使用更好的催化剂 D.移去 H2O
(3)氯碱工业是制备氯气常用的工业制法,也是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能 30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

①电解池 A 中的 X 物质为_______
②燃料电池 B 中的负极电极反应式为_______
③图中三处 NaOH 溶液浓度由大到小的关系是_______ (用 a、b、c 表示)
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s)
 H2O(g)+CuCl2(g)△H1.反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为
H2O(g)+CuCl2(g)△H1.反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为(2)新型 RuO2 催化剂对上述 HCl 转化为 Cl2 的总反应具有更好的催化活性,

①实验测得在一定压强下,总反应的 HCl 平衡转化率随温度变化的 aHCl—T 曲线如图,则总反应的△H
②恒温恒容,下列能说明反应达到平衡状态的是
A.△H 不变 B.密度不变 C.平均摩尔质量不变 D.颜色不变
③下列措施中有利于提高 aHCl 的有
A.增大 n(HCl) B.增大 n(O2)
C.使用更好的催化剂 D.移去 H2O
(3)氯碱工业是制备氯气常用的工业制法,也是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能 30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

①电解池 A 中的 X 物质为
②燃料电池 B 中的负极电极反应式为
③图中三处 NaOH 溶液浓度由大到小的关系是
您最近一年使用:0次






