关于相同体积pH均为3的醋酸和盐酸,下列说法正确的是
| A.稀释10倍后,两者的pH变化醋酸大于盐酸 |
| B.中和相同浓度的氢氧化钠溶液,消耗氢氧化钠的物质的量盐酸大于醋酸 |
| C.加入一定量的锌粉,产生气体的体积相同,则醋酸一定过量 |
D.加入足量的锌粉,产生氢气的速率随时间的变化如图所示 |
2017·湖北荆州·一模 查看更多[6]
湖北省荆州市2018届高三第一次质量检查化学试题(已下线)【艺体生文化课百题突围系列-基础练测】专题2.8 水溶液中的离子平衡安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)模块十 水溶液中的离子平衡(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)
更新时间:2017-12-04 19:56:34
|
【知识点】 一元强酸与一元弱酸的比较解读
相似题推荐
单选题
|
较易
(0.85)
【推荐1】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7
②相同温度,相同浓度的HCl(强酸)和HF溶液做导电性实验,HF溶液灯泡很暗
③HF与NaCl不能发生反应;④常温下0.1mol/L的HF溶液的pH为3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
①常温下NaF溶液的pH大于7
②相同温度,相同浓度的HCl(强酸)和HF溶液做导电性实验,HF溶液灯泡很暗
③HF与NaCl不能发生反应;④常温下0.1mol/L的HF溶液的pH为3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
| A.①②⑦ | B.②③⑤ | C.①④⑤ | D.①②④ |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】常温下,下列叙述正确的是
A.稀释pH=3的 溶液,溶液中所有离子的浓度均降低 溶液,溶液中所有离子的浓度均降低 |
| B.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
C.pH均为11的NaOH溶液和 溶液中,水的电离程度相同 溶液中,水的电离程度相同 |
D.一定浓度的 溶液和NaOH溶液混合,溶液呈中性,则混合液 溶液和NaOH溶液混合,溶液呈中性,则混合液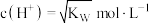 |
您最近一年使用:0次




