已知氨气在生活、生产、科研中有极广泛用途。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和液态水 的热化学方程式为___________________ ,该反应在_________ 条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________ ;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________ ;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______ mol(保留2位有效数字)。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=②计算得到可逆反应AgCl (s)+2NH3(aq)
 Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
更新时间:2017-12-31 15:10:17
|
相似题推荐
【推荐1】氮氧化物是主要大气污染物,可采用多种方法消除,其中氢气选择性催化还原(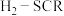 )是一种理想的方法。其相关反应如下:
)是一种理想的方法。其相关反应如下:
主反应: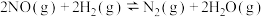

副反应: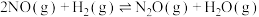

(1)已知:
 ,
,
 ,则
,则
_______ (用含有 和
和 的代数式表示)
的代数式表示)
(2)恒温条件下,将 、
、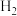 充入某恒容密闭容器中,在催化剂作用下进行反应。
充入某恒容密闭容器中,在催化剂作用下进行反应。
①下列有关说法错误 的是_______ 。(填字母序号)
a.当容器内的压强不再变化时说明主、副反应均达到平衡
b.平衡后,若向容器内再充入少量 ,主、副反应平衡常数均增大
,主、副反应平衡常数均增大
c.平衡后, 、
、 和
和 三者的物质的量之比保持不变
三者的物质的量之比保持不变
d.平衡后,
②在不同温度下,反应相同时间时测得混合气体中N2、 的体积分数随温度的变化关系如图所示,温度高于205℃时,
的体积分数随温度的变化关系如图所示,温度高于205℃时, 的体积分数随温度的升高而减小的原因可能
的体积分数随温度的升高而减小的原因可能_______ 。(答一点) 、
、 按物质的量比1:3充入某恒容密闭容器中,若平衡后
按物质的量比1:3充入某恒容密闭容器中,若平衡后 与
与 物质的量之比为3:1,
物质的量之比为3:1, 的转化率为80%,则
的转化率为80%,则 的有效去除率(转化为
的有效去除率(转化为 的
的 的量与起始量的比值)为
的量与起始量的比值)为_______ %, 的物质的量分数为
的物质的量分数为_______ %。(结果保留两位有效数字)
(4)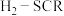 在
在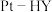 催化剂表面的反应机理如下图:
催化剂表面的反应机理如下图: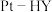 催化剂中,
催化剂中, 表面上形成的
表面上形成的 以
以 的形式被储存。随后在
的形式被储存。随后在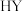 载体上,
载体上, 与
与 和
和 产生
产生 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。(已知发生反应的 、
、 物质的量之比为1:1)
物质的量之比为1:1)
(5)除了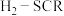 ,还有其他有效的方法消除氮氧化物,例如可用电解法将
,还有其他有效的方法消除氮氧化物,例如可用电解法将 转变为
转变为 ,其工作原理如图。M极为电解池的
,其工作原理如图。M极为电解池的_______ 极,N极的电极反应式为_______ 。
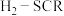 )是一种理想的方法。其相关反应如下:
)是一种理想的方法。其相关反应如下:主反应:
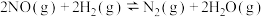

副反应:
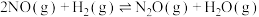

(1)已知:

 ,
,
 ,则
,则
 和
和 的代数式表示)
的代数式表示)(2)恒温条件下,将
 、
、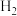 充入某恒容密闭容器中,在催化剂作用下进行反应。
充入某恒容密闭容器中,在催化剂作用下进行反应。①下列有关说法
a.当容器内的压强不再变化时说明主、副反应均达到平衡
b.平衡后,若向容器内再充入少量
 ,主、副反应平衡常数均增大
,主、副反应平衡常数均增大c.平衡后,
 、
、 和
和 三者的物质的量之比保持不变
三者的物质的量之比保持不变d.平衡后,

②在不同温度下,反应相同时间时测得混合气体中N2、
 的体积分数随温度的变化关系如图所示,温度高于205℃时,
的体积分数随温度的变化关系如图所示,温度高于205℃时, 的体积分数随温度的升高而减小的原因可能
的体积分数随温度的升高而减小的原因可能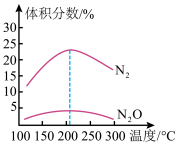
 、
、 按物质的量比1:3充入某恒容密闭容器中,若平衡后
按物质的量比1:3充入某恒容密闭容器中,若平衡后 与
与 物质的量之比为3:1,
物质的量之比为3:1, 的转化率为80%,则
的转化率为80%,则 的有效去除率(转化为
的有效去除率(转化为 的
的 的量与起始量的比值)为
的量与起始量的比值)为 的物质的量分数为
的物质的量分数为(4)
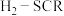 在
在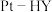 催化剂表面的反应机理如下图:
催化剂表面的反应机理如下图: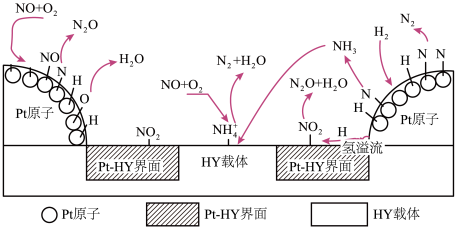
 催化剂中,
催化剂中, 表面上形成的
表面上形成的 以
以 的形式被储存。随后在
的形式被储存。随后在 载体上,
载体上, 与
与 和
和 产生
产生 ,该反应的离子方程式为
,该反应的离子方程式为 、
、 物质的量之比为1:1)
物质的量之比为1:1)(5)除了
 ,还有其他有效的方法消除氮氧化物,例如可用电解法将
,还有其他有效的方法消除氮氧化物,例如可用电解法将 转变为
转变为 ,其工作原理如图。M极为电解池的
,其工作原理如图。M极为电解池的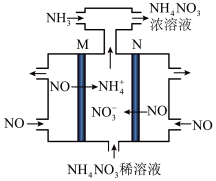
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】高铁酸钠(Na2FeO4)是一种新型、高效的水处理剂,与水反应的化学方程式为:4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH。电解制备 Na2FeO4装置示意图如下。
(1)a是电源的______________ 极(填“正”或“负”)。电解时,石墨电极附近溶液的碱性____________ (填“增强”、“减弱”或“不变”)。
(2)铁电极的反应式为__________________________ 。
(3)维持一定的电流强度和电解温度,NaOH起始浓度对Na2FeO4浓度影响如下图(电解液体积相同情况下进行实验)。
①电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是______________ (填“增大”、“不变”或“减小”)。
②当NaOH起始浓度为16mol·L-1,1.0~2.0h内生成Na2FeO4的速率是_____________ mol·L-1·h-1。
③A 点与B 点相比,n[Fe(OH)3]: A_____________ B (填“>”、 “=”或“<” )
(4)提纯电解所得Na2FeO4,采用重结晶、过滤、洗涤、低温烘干的方法,则洗涤剂最好选用______________ 溶液(填标号)和异丙醇。
A.Fe(NO3)3B.NH4ClC.CH3COONa
(5)次氯酸钠氧化法也可以制得Na2FeO4。
已知 2H2(g)+O2(g)=2H2O (1) △H=akJ·mol-1
NaCl(aq)+ H2O(1)=NaClO(aq)+H2(g) △H=bkJ·mol-1
4Na2FeO4(aq)+10H2O(1)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) △H=c kJ·mol-1
反应 2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1)的△H=______________ kJ·mol-1。

(1)a是电源的
(2)铁电极的反应式为
(3)维持一定的电流强度和电解温度,NaOH起始浓度对Na2FeO4浓度影响如下图(电解液体积相同情况下进行实验)。

①电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是
②当NaOH起始浓度为16mol·L-1,1.0~2.0h内生成Na2FeO4的速率是
③A 点与B 点相比,n[Fe(OH)3]: A
(4)提纯电解所得Na2FeO4,采用重结晶、过滤、洗涤、低温烘干的方法,则洗涤剂最好选用
A.Fe(NO3)3B.NH4ClC.CH3COONa
(5)次氯酸钠氧化法也可以制得Na2FeO4。
已知 2H2(g)+O2(g)=2H2O (1) △H=akJ·mol-1
NaCl(aq)+ H2O(1)=NaClO(aq)+H2(g) △H=bkJ·mol-1
4Na2FeO4(aq)+10H2O(1)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) △H=c kJ·mol-1
反应 2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1)的△H=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】一碳产品是石油的良好替代品,一碳化学与绿色化工结合可以实现经济与环境的协调发展。甲醇-水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇-水蒸气重整制氢的部分反应过程如图1所示:
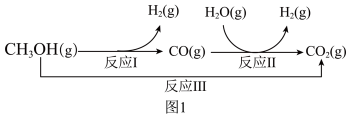
(1)已知一定条件下
反应I:CH3OH(g) ⇌CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) ⇌H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=_______ 。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。
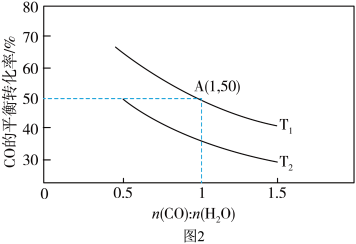
①比较T1、T2的大小,T1_______ T2(填“>”“<”或“=”)。原因为: _______
②T1温度时,按下表数据开始反应建立平衡:
应进行到t时刻时,判断v(正)、v(逆)的大小关系为断v(正)_______ v(逆(填“>“<”或“=”)。
(3)CO2在生产中有着广泛的用途。在弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。
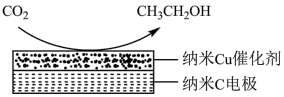
CO2参与反应的一极为_______ (填“阴极”或“阳极”),电极反应式是_______ 。

(1)已知一定条件下
反应I:CH3OH(g) ⇌CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) ⇌H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。

①比较T1、T2的大小,T1
②T1温度时,按下表数据开始反应建立平衡:
| CO | H2O | H2 | CO2 | |
| 起始浓度/(mol·L-1) | 2 | 1 | 0 | 0 |
| t时刻浓度/(mol·L-1) | 1.5 | 0.5 | 0.5 | 0.5 |
(3)CO2在生产中有着广泛的用途。在弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。
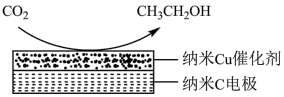
CO2参与反应的一极为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】丙酮蒸气热裂解可生产乙烯酮,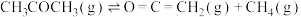
 ,现对该热裂解反应进行研究,回答下列问题:
,现对该热裂解反应进行研究,回答下列问题:
(1)①根据表格中的键能数据,计算
___________  ;
;
②该反应在___________ (填“低温”或“高温”或“任意温度”)条件下可自发进行。
(2)在恒容绝热密闭容器中,充入丙酮蒸气,不能判断下列到达平衡状态的是___________ 。
A. 消耗速率与
消耗速率与 生成速率相等
生成速率相等
B.容器内压强不再变化
C.反应的平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
E. 和
和 的浓度比保持不变
的浓度比保持不变
(3)丙酮的平衡转化率随温度、压强变化如图所示:
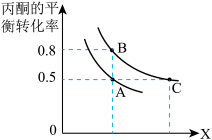
①图中X表示的物理量是___________ ;
②A、C两点化学平衡常数
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是___________ 。
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110 kPa)。
①经过时间t min,丙酮分解10%。用单位时间内气体分压变化表示的反应速率v(丙酮)=_______ kPa/min;
②该条件平衡时丙酮分解率为a,则
___________ (以分压表示,分压=总压×物质的量分数)。
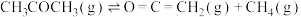
 ,现对该热裂解反应进行研究,回答下列问题:
,现对该热裂解反应进行研究,回答下列问题:(1)①根据表格中的键能数据,计算

 ;
;| 化学键 |  |  | C=C |
键能 | 412 | 348 | 612 |
(2)在恒容绝热密闭容器中,充入丙酮蒸气,不能判断下列到达平衡状态的是
A.
 消耗速率与
消耗速率与 生成速率相等
生成速率相等B.容器内压强不再变化
C.反应的平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
E.
 和
和 的浓度比保持不变
的浓度比保持不变(3)丙酮的平衡转化率随温度、压强变化如图所示:

①图中X表示的物理量是
②A、C两点化学平衡常数

 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110 kPa)。
①经过时间t min,丙酮分解10%。用单位时间内气体分压变化表示的反应速率v(丙酮)=
②该条件平衡时丙酮分解率为a,则

您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】某反应的平衡常数表达式为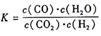 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:_________________________
(2)温度升高,该反应的K值______________ (填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________ (填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K=_________
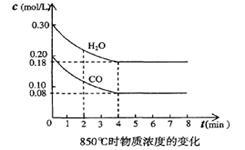
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气0.08 mol/L,此时v(正)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气0.08 mol/L,此时v(正)_____ v(逆)(“大于”“小于”“等于”)
 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:(1)该反应的化学方程式为:
(2)温度升高,该反应的K值
(3)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则0—4min的平均反应速率v(CO)=

(4)850℃时,在相同容器中发生反应CO2+ H2
 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气0.08 mol/L,此时v(正)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气0.08 mol/L,此时v(正)
您最近一年使用:0次
填空题
|
较难
(0.4)
真题
【推荐3】铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
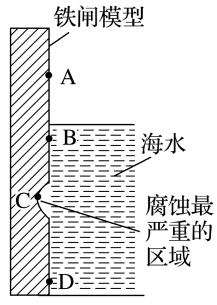
①该电化腐蚀称为__________________ 。
②图中A、B、C、D四个区域,生成铁锈最多的是_________ (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
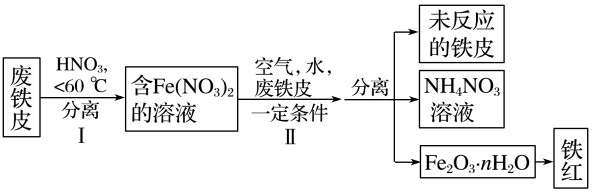
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为____________________ 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为________________________ 。
③上述生产流程中,能体现“绿色化学”思想的是____________________ (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=_____________ 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=___________________ 。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为
②图中A、B、C、D四个区域,生成铁锈最多的是
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
③上述生产流程中,能体现“绿色化学”思想的是
(3)已知t℃时,反应FeO(s)+CO(g)
 Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。①t℃时,反应达到平衡时n(CO):n(CO2)=
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=
您最近一年使用:0次



