某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
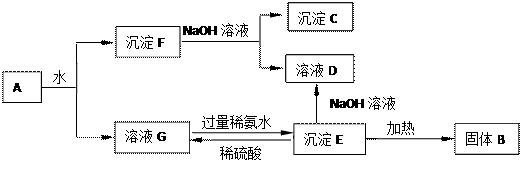
请回答下列问题。
(1)B、C、D、E 4种物质的化学式为:
B____________ 、C____________ 、D____________ 、E____________ 。
(2)沉淀F与NaOH溶液反应的离子方程式为________________________________ 。
沉淀E与稀硫酸反应的离子方程为____________________________________ 。
溶液G与过量稀氨水反应的化学方程为________________________________ 。

请回答下列问题。
(1)B、C、D、E 4种物质的化学式为:
B
(2)沉淀F与NaOH溶液反应的离子方程式为
沉淀E与稀硫酸反应的离子方程为
溶液G与过量稀氨水反应的化学方程为
更新时间:2018-01-20 11:02:45
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】亚硝酸钠(NaNO2)用途很广泛:可制药,作食品防腐剂、显色剂,作印染工业的媒染剂、漂白剂、缓蚀剂等。实验室用以下装置制取亚硝酸钠。
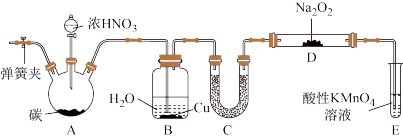
已知:①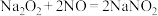 ②
②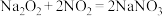
③NO可被KMnO4氧化成 ④Na2S2O3可被I2氧化为Na2S2O6
④Na2S2O3可被I2氧化为Na2S2O6
⑤
【制备NaNO2】
(1)仪器C的作用是___________ ;C中的试剂可以是___________ 。
(2)以上装置有设计缺陷,会使得到的产品杂质增多。改进方法是___________ 。
(3)E中反应的离子方程式为___________ 。
【测定NaNO2纯度】
(4)①称量0.5000 g制得的样品,溶于水配成250 mL溶液。
②取20.00 mL待测液于锥形瓶中,加入足量KI酸性溶液,滴入2~3滴淀粉溶液。
③取一支___________ (填“酸”或“碱”)式滴定管依次用自来水、蒸馏水洗净后,用0.02 mol/L Na2S2O3溶液润洗,装液,排出下端尖嘴内的气泡,调整液面,记下读数。
④进行滴定,记录读数。重复实验后,平均消耗Na2S2O3溶液的体积为20.00 mL。
(5)下列情况可能会使测得的NaNO2纯度偏高的是___________。
(6)样品中NaNO2的质量分数为___________ 。

已知:①
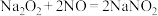 ②
②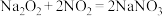
③NO可被KMnO4氧化成
 ④Na2S2O3可被I2氧化为Na2S2O6
④Na2S2O3可被I2氧化为Na2S2O6⑤

【制备NaNO2】
(1)仪器C的作用是
(2)以上装置有设计缺陷,会使得到的产品杂质增多。改进方法是
(3)E中反应的离子方程式为
【测定NaNO2纯度】
(4)①称量0.5000 g制得的样品,溶于水配成250 mL溶液。
②取20.00 mL待测液于锥形瓶中,加入足量KI酸性溶液,滴入2~3滴淀粉溶液。
③取一支
④进行滴定,记录读数。重复实验后,平均消耗Na2S2O3溶液的体积为20.00 mL。
(5)下列情况可能会使测得的NaNO2纯度偏高的是___________。
| A.滴定结束时,发现滴定管尖嘴部分有气泡 |
| B.滴定前平视读数,滴定结束时,仰视记录读数 |
| C.滴定操作过慢,用时过长 |
| D.当最后半滴Na2S2O3溶液,溶液由蓝色变为无色时,停止滴定。 |
您最近一年使用:0次
【推荐2】铊(Tl)被广泛用于军工、航天、通讯等各个方面。工业上以富铊灰(主要成分PbO、ZnO、Fe2O3、FeO、Tl2O等)为原料生产Tl,工艺流程如下:
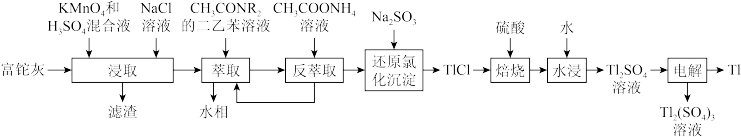
已知:萃取剂对铊有很高选择性,萃取的反应原理为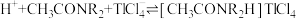
回答下列问题:
(1)“浸取”过程中生成可溶性的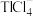 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ ;滤渣的主要成分为_______ (填化学式)。
(2)“反萃取”过程中加入CH3COONH4的作用是_______ 。
(3)“还原、氯化、沉淀”过程中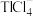 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)“电解”的装置如图所示,所用离子交换膜为_______ 离子交换膜(填“阳”或“阴”);电解前离子交换膜左右两边溶液质量相等,转移2 mol e-时左右两边溶液质量差为_______ g。
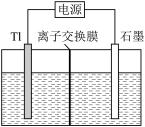
(5)电解所得Tl2(SO4)3溶液可返回_______ (填操作单元名称)。

已知:萃取剂对铊有很高选择性,萃取的反应原理为
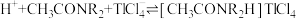
回答下列问题:
(1)“浸取”过程中生成可溶性的
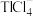 ,发生反应的离子方程式为
,发生反应的离子方程式为(2)“反萃取”过程中加入CH3COONH4的作用是
(3)“还原、氯化、沉淀”过程中
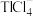 发生反应的离子方程式为
发生反应的离子方程式为(4)“电解”的装置如图所示,所用离子交换膜为

(5)电解所得Tl2(SO4)3溶液可返回
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】电镀厂排放的废水中含有大量毒性较强的 ,可将其转化为
,可将其转化为 、
、 等难溶物,从体系中分离而除去。
等难溶物,从体系中分离而除去。
已知:ⅰ. 的氧化性强于
的氧化性强于 ,且
,且 能够水解产生
能够水解产生 ;
;
ⅱ.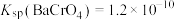 ;
;
ⅲ.根据国家标准,水中含有的 浓度在
浓度在 以下才能排放。
以下才能排放。
Ⅰ.直接沉淀法:
将 、
、 与
与 反应直接生成难溶物
反应直接生成难溶物 ,从体系中分离。
,从体系中分离。
(1) 水解产生
水解产生 的离子方程式是
的离子方程式是_______ 。
(2)加入可溶性钡盐时,废水中 的浓度应大于
的浓度应大于_______  ,处理后的水才能达到国家排放标准。
,处理后的水才能达到国家排放标准。
Ⅱ.还原沉淀法:
利用还原沉淀法除去废水中的 ,工业流程如下。
,工业流程如下。
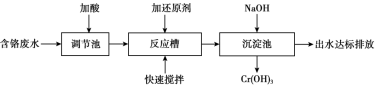
(3)调节池中需加酸的目的是_______ 。
(4)在反应槽中使用 为还原剂时,发生反应的离子方程式是
为还原剂时,发生反应的离子方程式是_______ 。
Ⅲ.电解法:
采用电解法处理含 的酸性废水时,使用耐酸电解槽,用铁板作阴、阳极,槽内盛放含铬废水。工作时
的酸性废水时,使用耐酸电解槽,用铁板作阴、阳极,槽内盛放含铬废水。工作时 在阳极区被还原成为
在阳极区被还原成为 ,在阴极区生成
,在阴极区生成 沉淀除去,工作原理如图。
沉淀除去,工作原理如图。
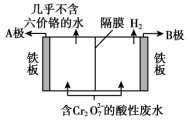
(5)B极与外接电源_______ (填正极、负极)相连。
(6)电解时阴极的电极反应式是_______ 。
(7) 被还原为
被还原为 的离子方程式是
的离子方程式是_______ 。
 ,可将其转化为
,可将其转化为 、
、 等难溶物,从体系中分离而除去。
等难溶物,从体系中分离而除去。已知:ⅰ.
 的氧化性强于
的氧化性强于 ,且
,且 能够水解产生
能够水解产生 ;
;ⅱ.
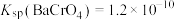 ;
;ⅲ.根据国家标准,水中含有的
 浓度在
浓度在 以下才能排放。
以下才能排放。Ⅰ.直接沉淀法:
将
 、
、 与
与 反应直接生成难溶物
反应直接生成难溶物 ,从体系中分离。
,从体系中分离。(1)
 水解产生
水解产生 的离子方程式是
的离子方程式是(2)加入可溶性钡盐时,废水中
 的浓度应大于
的浓度应大于 ,处理后的水才能达到国家排放标准。
,处理后的水才能达到国家排放标准。Ⅱ.还原沉淀法:
利用还原沉淀法除去废水中的
 ,工业流程如下。
,工业流程如下。
(3)调节池中需加酸的目的是
(4)在反应槽中使用
 为还原剂时,发生反应的离子方程式是
为还原剂时,发生反应的离子方程式是Ⅲ.电解法:
采用电解法处理含
 的酸性废水时,使用耐酸电解槽,用铁板作阴、阳极,槽内盛放含铬废水。工作时
的酸性废水时,使用耐酸电解槽,用铁板作阴、阳极,槽内盛放含铬废水。工作时 在阳极区被还原成为
在阳极区被还原成为 ,在阴极区生成
,在阴极区生成 沉淀除去,工作原理如图。
沉淀除去,工作原理如图。
(5)B极与外接电源
(6)电解时阴极的电极反应式是
(7)
 被还原为
被还原为 的离子方程式是
的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某胶囊是一种常用的治疗胃酸过多的药品,其主要成分为一种两性氢氧化物。某同学欲对该胶囊内的白色固体的主要成分进行检验,设计了如下实验步骤:

(1) 操作Ⅱ所需要的玻璃仪器有_________ 、_________ 、________ 。
(2) 写出下列反应的方程式:
③的化学方程式:____________________________________________________ ,
④的离子方程式:______________________________________________________ 。
(3) 根据实验推测,该胃药的主要成分为_________________________________________ 。
(4) 该同学通过阅读课外读物了解到:常用胃药中除了上述实验已检出的物质外,还有NaHCO3,请你帮助该同学完成对滤液C中主要成分的探究实验(简要描述操作步骤):_____________________ 。

(1) 操作Ⅱ所需要的玻璃仪器有
(2) 写出下列反应的方程式:
③的化学方程式:
④的离子方程式:
(3) 根据实验推测,该胃药的主要成分为
(4) 该同学通过阅读课外读物了解到:常用胃药中除了上述实验已检出的物质外,还有NaHCO3,请你帮助该同学完成对滤液C中主要成分的探究实验(简要描述操作步骤):
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D、E五种化合物,均含有常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
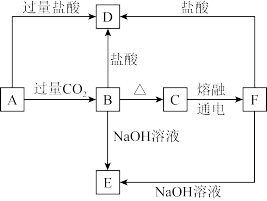
(1)写出化学式;
A______ ,C______ ,D______ ,E______
(2)写出下列反应的离子方程式:
①A→B:_____________________________________________
②B→E:_____________________________________________
③C→E:_____________________________________________
④F→E:_____________________________________________

(1)写出化学式;
A
(2)写出下列反应的离子方程式:
①A→B:
②B→E:
③C→E:
④F→E:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
(1) X在元素周期表中的位置为_______ ;画出X的简单离子结构示意图_______ 。
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_____________ 。
(2)四种元素简单离子的半径由大到小为_____________ (用离子符号表达)。
(3)W、X的最简单氢化物稳定性为_______ >________ (填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为______ 。
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________ 。
| W | X | |||
| Y | Z |
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号
(2)四种元素简单离子的半径由大到小为
(3)W、X的最简单氢化物稳定性为
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知A为金属单质,如图所示流程中的各步反应的最后生成物E是白色沉淀。

(1)请写出其化学式:A________ 、C__________ 。
(2)写出下列各步反应的离子方程式。
②_______________________ ;④________________________ ;⑤________________________ 。

(1)请写出其化学式:A
(2)写出下列各步反应的离子方程式。
②
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】在下图所示的一些常见单质、化合物等物质之间的转化关系中(有些反应的条件和部分物质未全部列出),已知在常温常压下,F为红棕色气体;L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应;G是硝酸;J是无色气体,且能够使燃着的木条熄灭;A为金属单质,其氧化物具有两性;D为非金属气态单质,是大气中含量最多的物质;H为非金属固态单质,其原子核中有6个质子。
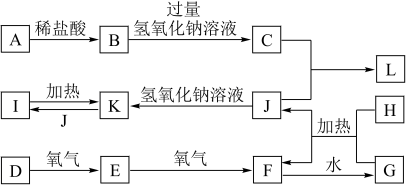
(1)化合物C的化学式为______________ 。
(2)物质I在生产生活中的用途有_______________ (任答一条)。
(3)写出E+氧气→F的化学方程式:_________________________________________ 。
(4)写出A与稀盐酸反应的离子方程式:_____________________________________ 。

(1)化合物C的化学式为
(2)物质I在生产生活中的用途有
(3)写出E+氧气→F的化学方程式:
(4)写出A与稀盐酸反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
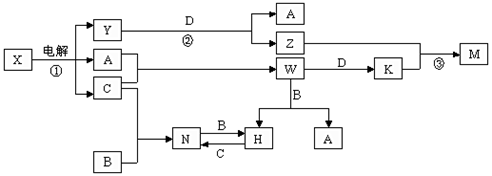
已知:A、B、C、D是单质,其余是化合物。其中B、D是常见金属。又知A在C中点燃有苍白色火焰。请回答下列问题:
(1)W的电子式是_______________ 。
(2)N的化学式______ ,写出由饱和的N溶液制备红褐色胶体的化学方程式:____________ ,
(3)写出下列反应的离子方程式:
反应①_____________________________________ ,
反应②______________________________________ ,
反应③______________________________________ 。

已知:A、B、C、D是单质,其余是化合物。其中B、D是常见金属。又知A在C中点燃有苍白色火焰。请回答下列问题:
(1)W的电子式是
(2)N的化学式
(3)写出下列反应的离子方程式:
反应①
反应②
反应③
您最近一年使用:0次



