下列有关实验操作、实验现象和所得结论均正确的是
| 实验操作 | 实验现象 | 结论 | |
| A | 在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液 | 产生大量气泡 | Fe3+能催化H2O2的分解 |
| B | 用0.100mol•L-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) | 溶液由橙色变红色,且在半分钟内不恢复 | 滴定到达终点 |
| C | 向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
| D | 往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液 | 产生白色沉淀,红色褪去 | 证明CO32-水解呈碱性 |
| A.A | B.B | C.C | D.D |
更新时间:2018/02/22 20:57:20
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】298K时,在20.00 mL 0.1 mol·L-1 C6H5COOH(苯甲酸)溶液中滴加0.1 mol·L-1 NaOH溶液,溶液中离子浓度与pH关系如图所示。下列说法正确的是
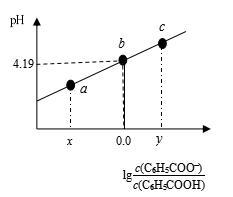

| A.a点:溶液中c(Na+)>c(C6H5COO-)>c(H+)>c(OH-) |
| B.b点:对应的NaOH溶液体积为10 mL |
| C.对b点溶液加热(不考虑挥发),实现曲线由b点向c点的变化 |
| D.298K时,C6H5COOH的电离常数为1×10-4.19 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列关于酸碱中和滴定的叙述中,正确的是
| A.进行酸碱中和滴定实验时,盛装待测液的锥形瓶使用前应先用待测液润洗 |
| B.滴定前应排除尖嘴部分的气泡 |
| C.滴定结束时仰视标准液读数会使测定结果偏小 |
| D.锥形瓶内溶液颜色突变说明到达滴定终点 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列图示与对应的叙述相符的是
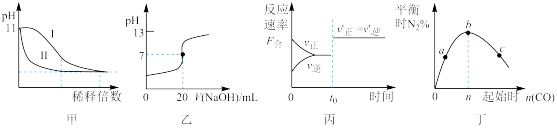

| A.图甲表示常温下稀释pH=11的NaOH溶液和氨水时溶液pH的变化,曲线Ⅱ表示氨水 |
| B.图乙表示常温下,0.1000mol∙L-1NaOH 溶液滴定20.00mL0.1000mol∙L-1醋酸溶液的滴定曲线 |
C.图丙表示某可逆反应的反应速率随时间的变化,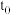 时刻改变的条件一定是使用了催化剂 时刻改变的条件一定是使用了催化剂 |
D.图丁表示反应4CO(g)+2NO2(g) N2(g)+4CO2(g),在其他条件不变的情况下改变起始CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c>b>a N2(g)+4CO2(g),在其他条件不变的情况下改变起始CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c>b>a |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列有关该反应的推理错误的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理错误的是
 CuS(s)+Mn2+(aq)。下列有关该反应的推理错误的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理错误的是| A.该反应达到平衡时:c(Cu2+)=c(Mn2+) |
| B.相同温度下,CuS的溶解度比MnS的溶解度小 |
| C.向含有等物质的量的CuSO4和MnSO4混合溶液中逐滴加入Na2S溶液,最先出现CuS沉淀 |
| D.往平衡体系中加入少量CuSO4(s)后,c(Mn2+)变大 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】由下列实验及现象不能推出相应结论的是
| 实验 | 现象 | 结论 | |
| A | 向氯水中加入碳酸钙粉末 | 有气体生成 | 酸性:HClO>H2CO3 |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 向2mL0.1mol/LFeCl3的溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| D | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐3】下列关于实验的说法正确的是
| 选项 | 实验目的 | 实验操作、现象 |
| A | 分离Fe(OH)3 胶体和FeCl3溶液 | 将混合液倒入过滤器中过滤 |
| B | 证明Ksp(CuS)<Ksp(ZnS) | 向10mL0.1mol/LNa2S溶液中滴入几滴0.1mol/LZnCl2溶液,产生白色沉淀,再加入CuSO4溶液,产生黑色沉淀 |
| C | 证明还原性:Br->Cl- | 向NaBr溶液中滴入少量氯水和苯,振荡,静置,溶液上层呈橙红色 |
| D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没,产生气泡 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



