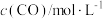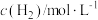燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物),冬季空气污染严重也跟冬季燃煤密切相关。
SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是______ (填字母)。
a.PM2.5在空气中一定能形成气溶胶
b.PM2.5比表面积大能吸附大量的有毒有害物质
c.PM2.5 主要来源于直接排放的工业污染物和汽车尾气等
d.酸雨、臭氧层破坏等环境问题与PM2.5无关
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ•mol-1
CH3OH(g)+H2O(g) △H=-a kJ•mol-1
2H2(g)+O2(g)=2H2O(g) △H=-b kJ•mol-1
H2O(g)-H2O(l) △H=-c kJ•mol-1
CH3OH(g)=CH3OH(l) △H=-d kJ•mol-1
则表示CH3OH(l)燃烧热的热化学方程式为________________________________ 。
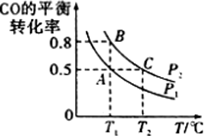
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是______ (填字母)。
a.H2的消耗速率是CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA_____ PB (填“>”、“<”或“=”)。
③若达到化学平衡状态A时。容器的体积为20L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=____________ L。
(4)SO2在一定条件下可与氧气构成原电池。右图是利用该电池在铁表面镀铜的装置示意图:
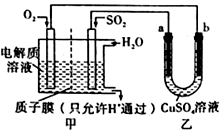
①该电池的负极反应:__________________________________ ;质于膜(只允许H通过)
②当甲中消耗2.24 LO2(标准状况)时,乙中__________ (填“a”或“b”)增重_________ g。
SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是
a.PM2.5在空气中一定能形成气溶胶
b.PM2.5比表面积大能吸附大量的有毒有害物质
c.PM2.5 主要来源于直接排放的工业污染物和汽车尾气等
d.酸雨、臭氧层破坏等环境问题与PM2.5无关
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2
 CH3OH+H2O
CH3OH+H2O已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-a kJ•mol-1
CH3OH(g)+H2O(g) △H=-a kJ•mol-1 2H2(g)+O2(g)=2H2O(g) △H=-b kJ•mol-1
H2O(g)-H2O(l) △H=-c kJ•mol-1
CH3OH(g)=CH3OH(l) △H=-d kJ•mol-1
则表示CH3OH(l)燃烧热的热化学方程式为
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是
a.H2的消耗速率是CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA
③若达到化学平衡状态A时。容器的体积为20L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=
(4)SO2在一定条件下可与氧气构成原电池。右图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:
②当甲中消耗2.24 LO2(标准状况)时,乙中
更新时间:2018-04-01 11:08:52
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知反应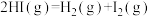 的
的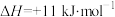 ,1 mol
,1 mol  、1 mol
、1 mol  分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1 molHI(g)分子中化学键断裂时需吸收的能量为
分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1 molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(2)Bodensteins研究了下列反应: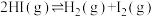 ,在716K时,气体混合物中碘化氢的物质的量分数
,在716K时,气体混合物中碘化氢的物质的量分数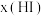 与反应时间t的关系如下表:
与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为:_______ 。
②上述反应中,正反应速率为 ,逆反应速率为
,逆反应速率为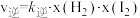 ,其中
,其中 、
、 为速率常数,若
为速率常数,若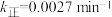 ,在t=40min时,
,在t=40min时,
_______ 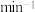 (保留三位有效数字)。如图(
(保留三位有效数字)。如图( ,T表示温度)所示a、b、c、d四条斜线中,能表示
,T表示温度)所示a、b、c、d四条斜线中,能表示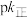 随T变化的是斜线
随T变化的是斜线_______ ,能表示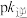 随T变化的是斜线,图中A、B、C、D点的坐标分别为m+4、m+2、m-2、m-4,则温度T1时化学平衡常数
随T变化的是斜线,图中A、B、C、D点的坐标分别为m+4、m+2、m-2、m-4,则温度T1时化学平衡常数
_______ 。

③由上述实验数据计算得到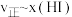 和
和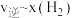 的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ 、_______ (填字母)

(1)已知反应
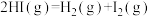 的
的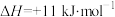 ,1 mol
,1 mol  、1 mol
、1 mol  分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1 molHI(g)分子中化学键断裂时需吸收的能量为
分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1 molHI(g)分子中化学键断裂时需吸收的能量为(2)Bodensteins研究了下列反应:
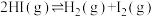 ,在716K时,气体混合物中碘化氢的物质的量分数
,在716K时,气体混合物中碘化氢的物质的量分数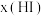 与反应时间t的关系如下表:
与反应时间t的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:
②上述反应中,正反应速率为
 ,逆反应速率为
,逆反应速率为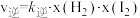 ,其中
,其中 、
、 为速率常数,若
为速率常数,若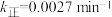 ,在t=40min时,
,在t=40min时,
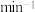 (保留三位有效数字)。如图(
(保留三位有效数字)。如图( ,T表示温度)所示a、b、c、d四条斜线中,能表示
,T表示温度)所示a、b、c、d四条斜线中,能表示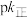 随T变化的是斜线
随T变化的是斜线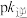 随T变化的是斜线,图中A、B、C、D点的坐标分别为m+4、m+2、m-2、m-4,则温度T1时化学平衡常数
随T变化的是斜线,图中A、B、C、D点的坐标分别为m+4、m+2、m-2、m-4,则温度T1时化学平衡常数

③由上述实验数据计算得到
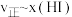 和
和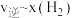 的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72−和CrO42−)工业废水的常用方法,过程如下:

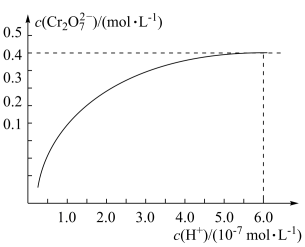
①已知:常温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________ 。
②还原过程中氧化剂与还原剂的物质的量之比为__________ 。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________ 。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L−1(即沉淀完全),应调节至溶液的pH=_____ 。
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________ (用离子浓度符号和“>”号表示)。
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。

已知部分弱电解质的电离常数(25℃)如下:
(i)(NH4)2SO3溶液呈____ (填“酸”、“碱”或“中”)性,其原因是_________________ 。
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=_________ 。
(1)还原沉淀法是处理含铬(Cr2O72−和CrO42−)工业废水的常用方法,过程如下:

①已知:常温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为

②还原过程中氧化剂与还原剂的物质的量之比为
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L−1(即沉淀完全),应调节至溶液的pH=
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。

已知部分弱电解质的电离常数(25℃)如下:
| 电解质 | 电离常数 |
| H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| NH3·H2O | Kb=1.74×10-5 |
(i)(NH4)2SO3溶液呈
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】人类的生存与发展都和能源有密切关系,其中煤炭的能源利用是人类最早开发的能源之一。在现代化工业中,煤炭的气化是以煤炭为原料,在高温高压下使煤炭中的有机物质和气化剂发生一系列的化学反应,使固体的煤炭转化成可燃性气体的生产过程。生要反应如下:
Ⅰ.C(s)+CO2(g)=2CO(g) ∆H1=+172.8kJ·mol-1
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g) ∆H2=+131.8kJ·mol-1
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ∆H3=-41.0kJ·mol-1
Ⅳ.C(s)+2H2O(g)=CO2(g)+2H2(g) ∆H4
回答下列问题:
(1)CO2的电子式是___ ;∆H4=___ kJ·mol-1。
(2)分别向初始温度为T℃,体职为2L的两个刚性密闭容器中,各充入足量的C(a)和1molH2O(g),一个容器为恒温容器,一个容器为绝热容器,若只发生反应II。两容器中压强随时间的变化关系如图所示:
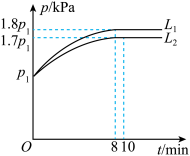
①图中代表恒温容器的曲线是___ (填“L1,"或“L2”)。
②绝热容器中,从反应开始至达到平衡,平均反应速率v(H2O)=__ mol·L-1·min-1。
③恒温容器中,T°C时,该反应的平衡常数Kp=__ kPa(Kp是以分压表示的平衡常数,分压=总压×物质的量分数。用含P1的代数式表示)
(3)若在恒温容器中,同时发生以上四个反应,其中C(s)足量。下列说法正确的是__ (填序号)。
a.当CO浓度不再发生变化时,容器中所有反应均达到平衡状态
b.缩小容器容积,反应I正反应速率降低,逆反应速率升高,平衡初逆方向移动
c.根据平衡常数公式,若从密闭容器中分离出所有C(s),各气体的浓度保持不变
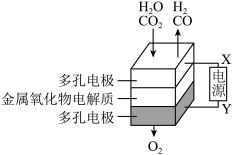
(4)煤炭是不可再生资源,而在固态金属氧化物电解池中,高温电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。X是电源的___ 极,阴极的电极反应式有:__ 。
Ⅰ.C(s)+CO2(g)=2CO(g) ∆H1=+172.8kJ·mol-1
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g) ∆H2=+131.8kJ·mol-1
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ∆H3=-41.0kJ·mol-1
Ⅳ.C(s)+2H2O(g)=CO2(g)+2H2(g) ∆H4
回答下列问题:
(1)CO2的电子式是
(2)分别向初始温度为T℃,体职为2L的两个刚性密闭容器中,各充入足量的C(a)和1molH2O(g),一个容器为恒温容器,一个容器为绝热容器,若只发生反应II。两容器中压强随时间的变化关系如图所示:

①图中代表恒温容器的曲线是
②绝热容器中,从反应开始至达到平衡,平均反应速率v(H2O)=
③恒温容器中,T°C时,该反应的平衡常数Kp=
(3)若在恒温容器中,同时发生以上四个反应,其中C(s)足量。下列说法正确的是
a.当CO浓度不再发生变化时,容器中所有反应均达到平衡状态
b.缩小容器容积,反应I正反应速率降低,逆反应速率升高,平衡初逆方向移动
c.根据平衡常数公式,若从密闭容器中分离出所有C(s),各气体的浓度保持不变
(4)煤炭是不可再生资源,而在固态金属氧化物电解池中,高温电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。X是电源的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究氮氧化物的处理对建设美丽中国具有重要意义。
(1)目前汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应生成 和
和 。
。
已知: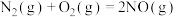
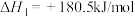
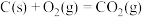
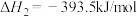

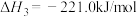
则反应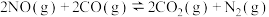 的
的 为
为___________ kJ/mol。
(2)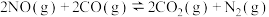 的反应历程如图(图中所有物质均为气态)。
的反应历程如图(图中所有物质均为气态)。

该反应的决速步骤是反应___________ (填对应序号)。
(3)向绝热恒容密闭容器中充入等物质的量的NO和CO进行反应,下列能判断反应已达到化学平衡状态的是___________ 。
a.容器中的压强不变b.
c.气体的平均相对分子质量保持不变d.NO和CO的体积比保持不变
(4) ,将等物质的量的NO和CO充入容积为2L的恒容密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如下图所示。
,将等物质的量的NO和CO充入容积为2L的恒容密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如下图所示。

该反应的化学平衡常数
___________ ;平衡时若保持温度不变,再向容器中充入CO、 各0.2mol,则平衡将
各0.2mol,则平衡将___________ (填“向左”、“向右”或“不”)移动。
(5)某研究小组探究催化剂Ⅰ、Ⅱ对CO、NO转化的影响。将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示。
的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示。

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为___________ 。
②温度低于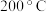 时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是
时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是___________ 。
(1)目前汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应生成
 和
和 。
。已知:
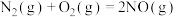
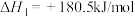
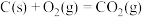
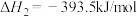

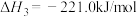
则反应
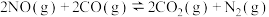 的
的 为
为(2)
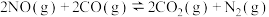 的反应历程如图(图中所有物质均为气态)。
的反应历程如图(图中所有物质均为气态)。
该反应的决速步骤是反应
(3)向绝热恒容密闭容器中充入等物质的量的NO和CO进行反应,下列能判断反应已达到化学平衡状态的是
a.容器中的压强不变b.

c.气体的平均相对分子质量保持不变d.NO和CO的体积比保持不变
(4)
 ,将等物质的量的NO和CO充入容积为2L的恒容密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如下图所示。
,将等物质的量的NO和CO充入容积为2L的恒容密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如下图所示。
该反应的化学平衡常数

 各0.2mol,则平衡将
各0.2mol,则平衡将(5)某研究小组探究催化剂Ⅰ、Ⅱ对CO、NO转化的影响。将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中
 的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示。
的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示。
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为
②温度低于
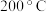 时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是
时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】在化工生产、污水处理中广泛涉及硫单质及其化合物。
Ⅰ.煤制得的化工原料中含有羰基硫(O===C===S),该物质可转化为H2S,主要反应如下:①水解反应:COS(g)+H2O(g) H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
(1)请计算CO(g)和H2O(g)生成H2(g)和CO2(g)的反应热ΔH=______ 。
(2)在定温定容的密闭容器中进行反应①,下列事实说明反应①达到平衡状态的是_____ (填字母)。
A.容器的压强不再改变
B.混合气体的密度不再改变
C.化学平衡常数不再改变
D.生成1 mol H—O键,同时生成1 mol H—S键
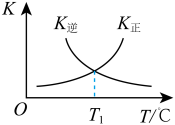
(3)反应②的正、逆反应的平衡常数(K)与温度(T)的关系如图所示。在T1℃时,向容积为5 L的密闭容器中加入2 mol COS(g)和1 mol H2(g),充分反应,COS的平衡转化率为______ 。
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:2H2S(g) 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
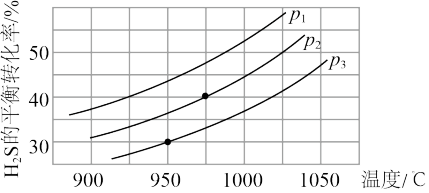
(4)图中压强p1、p2、p3由大到小的顺序是______ 。
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=_______ 。
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为_____ (保留2位有效数字)。对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),pB=p总×B的物质的量分数,则此条件下该反应的平衡常数Kp=___ MPa。
Ⅰ.煤制得的化工原料中含有羰基硫(O===C===S),该物质可转化为H2S,主要反应如下:①水解反应:COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。(1)请计算CO(g)和H2O(g)生成H2(g)和CO2(g)的反应热ΔH=
(2)在定温定容的密闭容器中进行反应①,下列事实说明反应①达到平衡状态的是
A.容器的压强不再改变
B.混合气体的密度不再改变
C.化学平衡常数不再改变
D.生成1 mol H—O键,同时生成1 mol H—S键
(3)反应②的正、逆反应的平衡常数(K)与温度(T)的关系如图所示。在T1℃时,向容积为5 L的密闭容器中加入2 mol COS(g)和1 mol H2(g),充分反应,COS的平衡转化率为
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:2H2S(g)
 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
(4)图中压强p1、p2、p3由大到小的顺序是
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
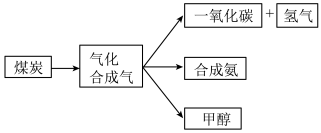
【推荐3】如图是煤的综合利用过程中化工产业链的一部分。
回答下列问题:
(1)煤的气化发生的主要反应是: 。
。
(2)用煤气化后得到的H2合成氨: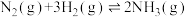
 。在容积为2L的密闭容器中投入N2和H2充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
。在容积为2L的密闭容器中投入N2和H2充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是___________ (填字母)。

a.t1时可能增大了 的浓度 b.t2时可能充入了氦气
的浓度 b.t2时可能充入了氦气
c.t3时可能降低了温度 d.t4时可能分离出氨气
(3)某温度时合成甲醇的反应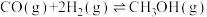
 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示:
②该温度下的平衡常数为___________ (可用分数表示) 。
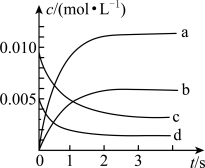
800℃时在2L密闭容器内反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表所示:
2NO2(g)体系中,n(NO)随时间的变化如下表所示:
(4)达平衡时NO的转化率为___________ 。
(5)下图中表示NO2的变化的曲线是___________ (填字母),用O2表示从0~2s内该反应的平均速率v(O2)=___________ 。
(6)能说明该反应一定达到平衡状态的是___________ (填字母)。
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2v逆(NO)=v正(O2) d.容器内压强保持不变
(7)能增大该反应的反应速率的是___________ (填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂

回答下列问题:
(1)煤的气化发生的主要反应是:
 。
。已知: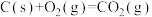
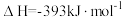
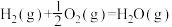
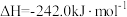
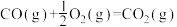
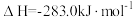
煤气化时发生主要反应的热化学方程式是: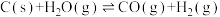
 H=
H=
(2)用煤气化后得到的H2合成氨:
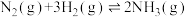
 。在容积为2L的密闭容器中投入N2和H2充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
。在容积为2L的密闭容器中投入N2和H2充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
a.t1时可能增大了
 的浓度 b.t2时可能充入了氦气
的浓度 b.t2时可能充入了氦气c.t3时可能降低了温度 d.t4时可能分离出氨气
(3)某温度时合成甲醇的反应
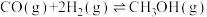
 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示:| 浓度 时间 |
|
|
|
| 0 | 1.0 | 1.8 | 0 |
| 2min | 0.5 | 0.5 | |
| 4min | 0.4 | 0.6 | 0.6 |
| 6min | 0.4 | 0.6 | 0.6 |
①前2min的反应速率
②该温度下的平衡常数为
800℃时在2L密闭容器内反应:2NO(g)+O2(g)
 2NO2(g)体系中,n(NO)随时间的变化如下表所示:
2NO2(g)体系中,n(NO)随时间的变化如下表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(4)达平衡时NO的转化率为
(5)下图中表示NO2的变化的曲线是

(6)能说明该反应一定达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2v逆(NO)=v正(O2) d.容器内压强保持不变
(7)能增大该反应的反应速率的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为ZnO,并含少量的CuO、MnO2、Fe2O3)为原料制备氧化锌的工艺流程如下:

已知:①“浸取”时, 转化为可溶性
转化为可溶性 离子,
离子, 转化为可溶性
转化为可溶性 离子;②常温下,
离子;②常温下, ,
,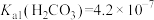 ,
,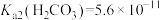 。
。
回答下列问题:
(1) 在周期表中的位置为
在周期表中的位置为_______ ,其基态原子价电子轨道表示式为_______ 。
(2) 所含元素的电负性由大到小的顺序为
所含元素的电负性由大到小的顺序为_______ ,“浸取”时加入的 溶液显
溶液显_______ (填“酸性”、“碱性”或“中性”)。
(3)“除杂”加入过量锌粉发生的离子方程式为_______ ;“冷凝吸收”过程中通入过量 ,发生反应的离子方程式为:
,发生反应的离子方程式为:_______ 。
(4)常温下二价锌在水溶液中的存在形式与 的关系如图,横坐标为溶液的
的关系如图,横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数(假设
物质的量浓度的对数(假设 离子浓度
离子浓度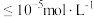 时,
时, 离子已沉淀完全)。从图中数据计算可得
离子已沉淀完全)。从图中数据计算可得 的溶度积
的溶度积
_______ ,某废液中含 离子,为沉淀
离子,为沉淀 离子可以控制溶液中
离子可以控制溶液中 值的范围是
值的范围是_______ 。

(5)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。

①中间隔室b可以得到的主要物质Z是_______ (填化学式)。
②阳极的电极反应式是_______ 。

已知:①“浸取”时,
 转化为可溶性
转化为可溶性 离子,
离子, 转化为可溶性
转化为可溶性 离子;②常温下,
离子;②常温下, ,
,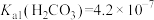 ,
,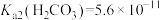 。
。回答下列问题:
(1)
 在周期表中的位置为
在周期表中的位置为(2)
 所含元素的电负性由大到小的顺序为
所含元素的电负性由大到小的顺序为 溶液显
溶液显(3)“除杂”加入过量锌粉发生的离子方程式为
 ,发生反应的离子方程式为:
,发生反应的离子方程式为:(4)常温下二价锌在水溶液中的存在形式与
 的关系如图,横坐标为溶液的
的关系如图,横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数(假设
物质的量浓度的对数(假设 离子浓度
离子浓度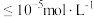 时,
时, 离子已沉淀完全)。从图中数据计算可得
离子已沉淀完全)。从图中数据计算可得 的溶度积
的溶度积
 离子,为沉淀
离子,为沉淀 离子可以控制溶液中
离子可以控制溶液中 值的范围是
值的范围是
(5)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。

①中间隔室b可以得到的主要物质Z是
②阳极的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】如何降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 引起了全世界的普遍重视。目前工业上有一种方法是用
引起了全世界的普遍重视。目前工业上有一种方法是用 生产燃料甲醇(
生产燃料甲醇( ),反应的化学方程式为:
),反应的化学方程式为: 。请回答下列问题。
。请回答下列问题。
(1)该反应的能量变化如图所示,观察图象可知,反应过程中断裂反应物中的化学键吸收的总能量___________ (填“ ”、“
”、“ ”或“
”或“ ”)形成生成物中的化学键释放的总能量。
”)形成生成物中的化学键释放的总能量。

(2)某温度时,在体积为 的密闭容器中,充入
的密闭容器中,充入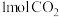 和
和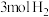 发生反应,测得
发生反应,测得 的物质的量随时间变化如下表所示:
的物质的量随时间变化如下表所示:
①从反应开始到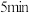 末,用
末,用 的浓度变化表示该反应的平均速率为
的浓度变化表示该反应的平均速率为___________  。
。
②反应达平衡时, 的转化率为
的转化率为___________  。
。
③下列反应条件的改变对反应速率的影响叙述正确的是___________ (填标号)。
A.升高体系温度能加快反应速率
B.充入稀有气体增大压强能加快反应速率
C.将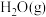 从体系中分离能减慢反应速率
从体系中分离能减慢反应速率
D.使用催化剂对反应速率无影响
④恒温恒容时,能说明该反应已达到化学平衡状态的是___________ (填标号)。
A. 的消耗速率与
的消耗速率与 的生成速率之比为
的生成速率之比为
B. 、
、 、
、 、
、 的浓度均不再变化
的浓度均不再变化
C.容器中压强保持不变
D.混合气体的密度保持不变
(3)如图所示,将甲醇设计成燃料电池,则 为
为___________ 极(填“正”或“负”); 极的电极反应式为
极的电极反应式为___________ 。

 的含量及有效地开发利用
的含量及有效地开发利用 引起了全世界的普遍重视。目前工业上有一种方法是用
引起了全世界的普遍重视。目前工业上有一种方法是用 生产燃料甲醇(
生产燃料甲醇( ),反应的化学方程式为:
),反应的化学方程式为: 。请回答下列问题。
。请回答下列问题。(1)该反应的能量变化如图所示,观察图象可知,反应过程中断裂反应物中的化学键吸收的总能量
 ”、“
”、“ ”或“
”或“ ”)形成生成物中的化学键释放的总能量。
”)形成生成物中的化学键释放的总能量。
(2)某温度时,在体积为
 的密闭容器中,充入
的密闭容器中,充入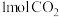 和
和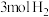 发生反应,测得
发生反应,测得 的物质的量随时间变化如下表所示:
的物质的量随时间变化如下表所示:时间/ | 0 | 2 | 5 | 10 | 15 |
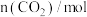 | 1 | 0.85 | 0.7 | 0.25 | 0.25 |
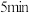 末,用
末,用 的浓度变化表示该反应的平均速率为
的浓度变化表示该反应的平均速率为 。
。②反应达平衡时,
 的转化率为
的转化率为 。
。③下列反应条件的改变对反应速率的影响叙述正确的是
A.升高体系温度能加快反应速率
B.充入稀有气体增大压强能加快反应速率
C.将
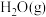 从体系中分离能减慢反应速率
从体系中分离能减慢反应速率D.使用催化剂对反应速率无影响
④恒温恒容时,能说明该反应已达到化学平衡状态的是
A.
 的消耗速率与
的消耗速率与 的生成速率之比为
的生成速率之比为
B.
 、
、 、
、 、
、 的浓度均不再变化
的浓度均不再变化C.容器中压强保持不变
D.混合气体的密度保持不变
(3)如图所示,将甲醇设计成燃料电池,则
 为
为 极的电极反应式为
极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)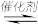 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=_________ 。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______ (填“A” 或“B ”)。
(2)CO2可以被NaOH溶液捕获。
①若所得溶液pH=13,CO2主要转化为_______ (写离子符号);若所得溶液c(HCO3−)∶c(CO32−)=2∶1,溶液pH=___________ 。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)
②当2molCO2通入3molNaOH被吸收时,溶液中离子浓度关系正确的是(选填字母)________ 。
a.c(Na+)+c(H+)=c(CO32−)+c(HCO3-)+c(OH-)
b.c(Na+)>c(HCO3-)>c(CO32−)> c(OH-)>c(H+)
c.3c(Na+)=2[c(CO32−)+c(HCO3-) +c(H2CO3)]
(3)CO2辅助的CO—O2燃料电池,工作原理如图所示,固体介质中CO32— 可定向移动。电池的负极反应式:________________________________ 电池工作时需向某电极通入CO2以触发反应,该电极为_____________ (填“甲”或“乙”)

(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)
 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=
(2)CO2可以被NaOH溶液捕获。
①若所得溶液pH=13,CO2主要转化为
②当2molCO2通入3molNaOH被吸收时,溶液中离子浓度关系正确的是(选填字母)
a.c(Na+)+c(H+)=c(CO32−)+c(HCO3-)+c(OH-)
b.c(Na+)>c(HCO3-)>c(CO32−)> c(OH-)>c(H+)
c.3c(Na+)=2[c(CO32−)+c(HCO3-) +c(H2CO3)]
(3)CO2辅助的CO—O2燃料电池,工作原理如图所示,固体介质中CO32— 可定向移动。电池的负极反应式:

您最近一年使用:0次