人类的生存与发展都和能源有密切关系,其中煤炭的能源利用是人类最早开发的能源之一。在现代化工业中,煤炭的气化是以煤炭为原料,在高温高压下使煤炭中的有机物质和气化剂发生一系列的化学反应,使固体的煤炭转化成可燃性气体的生产过程。生要反应如下:
Ⅰ.C(s)+CO2(g)=2CO(g) ∆H1=+172.8kJ·mol-1
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g) ∆H2=+131.8kJ·mol-1
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ∆H3=-41.0kJ·mol-1
Ⅳ.C(s)+2H2O(g)=CO2(g)+2H2(g) ∆H4
回答下列问题:
(1)CO2的电子式是___ ;∆H4=___ kJ·mol-1。
(2)分别向初始温度为T℃,体职为2L的两个刚性密闭容器中,各充入足量的C(a)和1molH2O(g),一个容器为恒温容器,一个容器为绝热容器,若只发生反应II。两容器中压强随时间的变化关系如图所示:
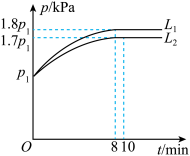
①图中代表恒温容器的曲线是___ (填“L1,"或“L2”)。
②绝热容器中,从反应开始至达到平衡,平均反应速率v(H2O)=__ mol·L-1·min-1。
③恒温容器中,T°C时,该反应的平衡常数Kp=__ kPa(Kp是以分压表示的平衡常数,分压=总压×物质的量分数。用含P1的代数式表示)
(3)若在恒温容器中,同时发生以上四个反应,其中C(s)足量。下列说法正确的是__ (填序号)。
a.当CO浓度不再发生变化时,容器中所有反应均达到平衡状态
b.缩小容器容积,反应I正反应速率降低,逆反应速率升高,平衡初逆方向移动
c.根据平衡常数公式,若从密闭容器中分离出所有C(s),各气体的浓度保持不变
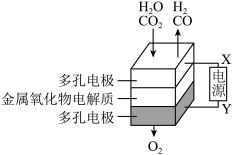
(4)煤炭是不可再生资源,而在固态金属氧化物电解池中,高温电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。X是电源的___ 极,阴极的电极反应式有:__ 。
Ⅰ.C(s)+CO2(g)=2CO(g) ∆H1=+172.8kJ·mol-1
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g) ∆H2=+131.8kJ·mol-1
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ∆H3=-41.0kJ·mol-1
Ⅳ.C(s)+2H2O(g)=CO2(g)+2H2(g) ∆H4
回答下列问题:
(1)CO2的电子式是
(2)分别向初始温度为T℃,体职为2L的两个刚性密闭容器中,各充入足量的C(a)和1molH2O(g),一个容器为恒温容器,一个容器为绝热容器,若只发生反应II。两容器中压强随时间的变化关系如图所示:

①图中代表恒温容器的曲线是
②绝热容器中,从反应开始至达到平衡,平均反应速率v(H2O)=
③恒温容器中,T°C时,该反应的平衡常数Kp=
(3)若在恒温容器中,同时发生以上四个反应,其中C(s)足量。下列说法正确的是
a.当CO浓度不再发生变化时,容器中所有反应均达到平衡状态
b.缩小容器容积,反应I正反应速率降低,逆反应速率升高,平衡初逆方向移动
c.根据平衡常数公式,若从密闭容器中分离出所有C(s),各气体的浓度保持不变
(4)煤炭是不可再生资源,而在固态金属氧化物电解池中,高温电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。X是电源的

更新时间:2020-02-17 15:20:26
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】化学原理是中学化学学习的重要内容。请回答下列问题:
(1)①已知:CH4、H2的燃烧热(△H)分别为﹣890.3kJ/mol、﹣285.8kJ/mol,则CO2和H2反应生成CH4的热化学方程式是__________________________ 。
②有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是________ ,A是____ 。

(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g) CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
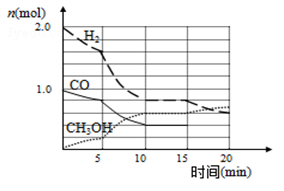
①从反应开始至平衡时,用CO表示化学反应速率为________ ,该温度下的平衡常数为__ ;
②5min至10min时速率变化的原因可能是__________________ ;
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化);如果溶液pH=7,此时V的取值___ 20.00(填“>”、“=”或“<”),溶液中c(Na+)、c(CH3COO﹣)、c(H+)、c(OH﹣)的大小关系是_____________________ ;
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为_______ (用含有a、b字母的代数式表示)。
(1)①已知:CH4、H2的燃烧热(△H)分别为﹣890.3kJ/mol、﹣285.8kJ/mol,则CO2和H2反应生成CH4的热化学方程式是
②有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是

(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g)
 CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下在容积为2L的密闭容器中进行该反应,其相关数据见图:
①从反应开始至平衡时,用CO表示化学反应速率为
②5min至10min时速率变化的原因可能是
(3)①常温下,将V mL、0.1000mol/L氢氧化钠溶液逐滴加入到20.00mL、0.1000mol/L醋酸溶液中,充分反应(忽略溶液体积的变化);如果溶液pH=7,此时V的取值
②常温下,将a mol/L的醋酸与b mol/L的氢氧化钠溶液等体积混合,反应后,溶液呈中性,则醋酸的电离常数为
您最近一年使用:0次
【推荐2】氮、碳氧化物的排放会对环境造成污染。多年来化学工作者对氮、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) N2O2(g) (快) ∆H1<0;
N2O2(g) (快) ∆H1<0;
v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) 2NO2(g) (慢) ∆H2< 0;
2NO2(g) (慢) ∆H2< 0;
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①在两步的反应中,哪一步反应的活化能更大___ (填“第一步”或“第二步”)。
②一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________ ;
II.(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH1>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH3<0
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=______________________ (用含 ΔH1 、ΔH2 、 ΔH3的代数式表示)若固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。


同温度下CO2的平衡转化率大于CH4的平衡转化率,原因是_________ 。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____ v(逆)(填 “大于”“小于”或“等于”)。已知气体分压(p 分)=气体总压(p 总)× 气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x 点对应温度下反应的平衡常数Kp=__________________ 。
III.根据2CrO42﹣+2H+ Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的_________ 极,电解制备过程的总反应化学方程式为_________ 。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为_________ 。若选择用熔融K2CO3作介质的甲烷(CH4)燃料电池充当电源,则负极反应式为________________ 。
I.已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:第一步:2NO(g)
 N2O2(g) (快) ∆H1<0;
N2O2(g) (快) ∆H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)
 2NO2(g) (慢) ∆H2< 0;
2NO2(g) (慢) ∆H2< 0;v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①在两步的反应中,哪一步反应的活化能更大
②一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=II.(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH1>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH3<0
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=


同温度下CO2的平衡转化率大于CH4的平衡转化率,原因是
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g)
 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)III.根据2CrO42﹣+2H+
 Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】十九大报告提出“要像对待生命一样对待生态环境”,对硫、氮、碳元素形成的有毒有害气体进行处理成为科学研究热点。请回答下列问题:
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为___________ 。
(2)利用现代传感技术探究压强对2NO2 (g) N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。

①B、E两点对应的正反应速率大小为vB_____ vE(填“>” 或“<”)。
②E、F、H三点对应气体的平均相对分子质量最大的点为_____ (填字母序号)。
(3)可用下图装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为_________ 。

Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g) HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:
(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
①已知:vp(B)= 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为__________ kPa∙min-1。
②T1℃时,反应的平衡常数Kp=______ kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数;结果保留三位有效数字)。
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g)
 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-12NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为
(2)利用现代传感技术探究压强对2NO2 (g)
 N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
①B、E两点对应的正反应速率大小为vB
②E、F、H三点对应气体的平均相对分子质量最大的点为
(3)可用下图装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为

Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g)
 HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=
 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为②T1℃时,反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g) 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=________ kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________ 。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1molCO和2mol H2,在不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。

①该反应自发进行的条件是________ (填“低温”、“高温”或“任意温度”)
②506K时,反应平衡时H2的转化率为________ ;压强:p1________ (填“>”“<”或“=”)p2。
③反应速率:N点v正(CO)________ (填“>”“<”或“=”)M点v逆(CO)。
(4)已知常温下,H2A在水中存在以下平衡:H2A H++HA﹣,HA﹣
H++HA﹣,HA﹣ H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0。
H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________ 。
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2③2CH4(g)+O2(g)
 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1(1)ΔH2=
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是
A.正反应速率先增大后减少
 B.化学平衡常数K减少
B.化学平衡常数K减少C.再加入一定量碳
 D.反应物气体体积分数增大
D.反应物气体体积分数增大(3)在体积可变的密闭容器中投入1molCO和2mol H2,在不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
①该反应自发进行的条件是
②506K时,反应平衡时H2的转化率为
③反应速率:N点v正(CO)
(4)已知常温下,H2A在水中存在以下平衡:H2A
 H++HA﹣,HA﹣
H++HA﹣,HA﹣ H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0。
H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)⇌Ca2+(aq)+A2﹣(aq)△H>0。①温度升高时,Ksp
②滴加少量浓盐酸,c(Ca2+)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】请回答下列问题。
I.1-丁烯是一种重要的化工原料,可由正丁烷催化脱氢制备。
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) △H1
②C4H10(g)+ O2(g)=C4H8(g)+H2O(g) △H2=-119kJ•mol-1
O2(g)=C4H8(g)+H2O(g) △H2=-119kJ•mol-1
③H2(g)+ O2(g)=H2O(g) △H3=-242kJ•mol-1
O2(g)=H2O(g) △H3=-242kJ•mol-1
反应①的△H1为______ kJ·mol-1。
(2)如图是反应①平衡转化率与反应温度及压强的关系图,x_____ 0.1(填“>”或“<”);欲使丁烯的平衡产率提高,应采取的措施是_____ 。
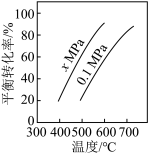
A.升高温度 B.降低温度 C.增大压强 D.降低压强
Ⅱ.煤化工是将煤经过化学加工转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(3)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)=CO2(g)+H2(g),得到如表两组数据:
①实验1中以 (CO2)表示的化学反应速率为
(CO2)表示的化学反应速率为______ 。
②该反应的逆反应为______ (填“吸”或“放”)热反应。
(4)在一容积为2L的密闭容器内加入2molCO和6molH2,在一定条件下发生如下反应:CO(g)+2H2(g) CH3OH(g) △H<0。该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) △H<0。该反应的逆反应速率与时间的关系如图所示:
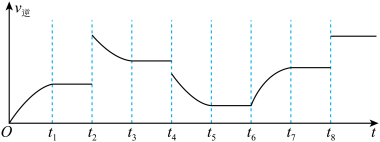
由图可知反应在有t1、t3、t5、t7时都达到了平衡,而在t2、t4、t6、t8时都改变了条件,改变的条件分别是t6:______ t8:______ 。
I.1-丁烯是一种重要的化工原料,可由正丁烷催化脱氢制备。
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) △H1
②C4H10(g)+
 O2(g)=C4H8(g)+H2O(g) △H2=-119kJ•mol-1
O2(g)=C4H8(g)+H2O(g) △H2=-119kJ•mol-1③H2(g)+
 O2(g)=H2O(g) △H3=-242kJ•mol-1
O2(g)=H2O(g) △H3=-242kJ•mol-1反应①的△H1为
(2)如图是反应①平衡转化率与反应温度及压强的关系图,x

A.升高温度 B.降低温度 C.增大压强 D.降低压强
Ⅱ.煤化工是将煤经过化学加工转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(3)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)=CO2(g)+H2(g),得到如表两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验1中以
 (CO2)表示的化学反应速率为
(CO2)表示的化学反应速率为②该反应的逆反应为
(4)在一容积为2L的密闭容器内加入2molCO和6molH2,在一定条件下发生如下反应:CO(g)+2H2(g)
 CH3OH(g) △H<0。该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) △H<0。该反应的逆反应速率与时间的关系如图所示:
由图可知反应在有t1、t3、t5、t7时都达到了平衡,而在t2、t4、t6、t8时都改变了条件,改变的条件分别是t6:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH2)2]
已知:①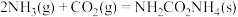
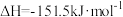
②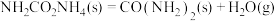
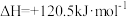
③
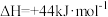
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为_______ 。
(2)工业上常用如下反应消除氮氧化物的污染: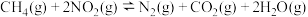
 。在温度为
。在温度为 和
和 时,分别将0.40 mol CH4和0.9 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:
时,分别将0.40 mol CH4和0.9 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①根据图判断该反应的∆H_______ 0(填“>”、“<”或“=”)。
②温度为 时,
时, 内NO2的平均反应速率v(NO2)=
内NO2的平均反应速率v(NO2)=____ ,反应的平衡常数K=____ 。
③该反应达到平衡后,为提高反应速率同时提高NO2的转化率,可采取的措施有_______ (填标号)。
A.改用高效催化剂 B.增加CH4的浓度 C.缩小容器的体积 D.升高温度
(3)如图是一个化学过程的示意图。

①请回答图中甲、乙两池的名称,甲池是_______ 装置,乙池是_______ 装置。
②请回答下列电极的名称:B(Ag)电极的名称是_______ 。
③写出电极反应式:通入CH3OH的电极的电极反应式是____ 。D(Pt)电极的电极反应式为_____ 。
④当乙池中B(Ag)极的质量增加 时,甲池中理论上消耗O2
时,甲池中理论上消耗O2_______ mL(标准状况下)。
(1)用CO2和NH3可合成氮肥尿素[CO(NH2)2]
已知:①
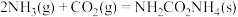
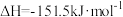
②
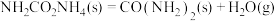
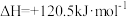
③

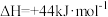
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为
(2)工业上常用如下反应消除氮氧化物的污染:
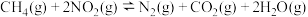
 。在温度为
。在温度为 和
和 时,分别将0.40 mol CH4和0.9 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:
时,分别将0.40 mol CH4和0.9 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:
①根据图判断该反应的∆H
②温度为
 时,
时, 内NO2的平均反应速率v(NO2)=
内NO2的平均反应速率v(NO2)=③该反应达到平衡后,为提高反应速率同时提高NO2的转化率,可采取的措施有
A.改用高效催化剂 B.增加CH4的浓度 C.缩小容器的体积 D.升高温度
(3)如图是一个化学过程的示意图。

①请回答图中甲、乙两池的名称,甲池是
②请回答下列电极的名称:B(Ag)电极的名称是
③写出电极反应式:通入CH3OH的电极的电极反应式是
④当乙池中B(Ag)极的质量增加
 时,甲池中理论上消耗O2
时,甲池中理论上消耗O2
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】和硅同一主族的锗也是重要的半导体材料,锗广泛用于航空航天测控、光纤通讯等领域。一种纯GeO2粗品(主要含GeO2、As2O3)制备锗工艺如下:
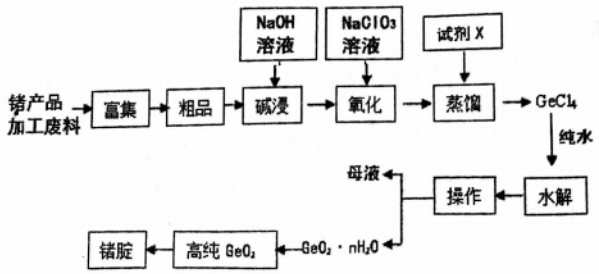
已知:①GeO2和As203都是两性氧化物;
②GeCl4的熔点为-49.5℃,GeCl4和AsC13的沸点分别为84℃、130.2℃。
回答下列问题:
(1)试剂X为:_____________ (填化学式)。
(2)“氧化”的过程是将NaAs02都氧化为Na3As04,其反应的离子方程式为:_______________________________________________ 。
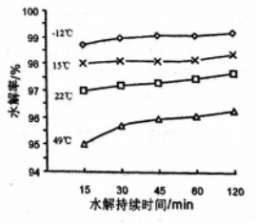
(3)GeCl4的水解率随温度变化曲线如图所示。结合图象和题干分析:“水解”操作时保持较低温度来提高产率的原因(说一条即可):__________________________ 。
(4)GeCl4水解生成Ge02·nH20,此过程用化学方程式可表示为:__________________________ 。
(5)传统的提纯方法是将“粗品”直接加入浓盐酸中蒸馏,其缺点是:__________________________ 。
(6)“操作”包括:__________________________ ;检验Ge02·nH20是否洗涤干净的方法:___________________________________________ 。

已知:①GeO2和As203都是两性氧化物;
②GeCl4的熔点为-49.5℃,GeCl4和AsC13的沸点分别为84℃、130.2℃。
回答下列问题:
(1)试剂X为:
(2)“氧化”的过程是将NaAs02都氧化为Na3As04,其反应的离子方程式为:
(3)GeCl4的水解率随温度变化曲线如图所示。结合图象和题干分析:“水解”操作时保持较低温度来提高产率的原因(说一条即可):

(4)GeCl4水解生成Ge02·nH20,此过程用化学方程式可表示为:
(5)传统的提纯方法是将“粗品”直接加入浓盐酸中蒸馏,其缺点是:
(6)“操作”包括:
您最近一年使用:0次
【推荐2】电解锰工艺过程会产生锰、镁复盐,其组成为(NH4)7MnMg2(SO4)6.5•21H2O。一种综合利用该复盐的工艺流程如图所示:

已知:Ksp[Mg(OH)2]=1.8×10-11,Kb(NH3•H2O)=1.8×10-5。回答下列问题:
(1)(NH4)7MnMg2(SO4)6.5•21H2O的水溶液呈__________________ 性(填“酸”或“碱”) ,Mn的化合价为__________________ 。
(2)“沉锰”的离子反应方程式为__________________ ;滤液1溶质的主要成分有__________________ 。
(3)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示:

①由图可知,“沉锰”合适的条件为__________________ 。
②Mg2+主要生成的是__________________ 沉淀(填“Mg(OH)2”或“MgCO3”),当温度高于45℃时Mg2+和Mn2+沉淀率的变化如图所示,原因是__________________ 。
(4)若将NH3通入0.01mol•L-1MgSO4溶液至Mg2+完全沉淀,则此时溶液中NH3•H2O的物质的量浓度为__________________ 。(已知 =1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
=1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)

已知:Ksp[Mg(OH)2]=1.8×10-11,Kb(NH3•H2O)=1.8×10-5。回答下列问题:
(1)(NH4)7MnMg2(SO4)6.5•21H2O的水溶液呈
(2)“沉锰”的离子反应方程式为
(3)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示:

①由图可知,“沉锰”合适的条件为
②Mg2+主要生成的是
(4)若将NH3通入0.01mol•L-1MgSO4溶液至Mg2+完全沉淀,则此时溶液中NH3•H2O的物质的量浓度为
 =1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
=1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一、
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)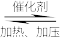 2SO3(g)。某温度下,SO2的平衡转化率( α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率( α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
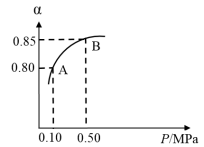
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于_______ 。
②平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);ΔH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);ΔH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_______ (阿伏加德罗常数的值用NA表示),放出的热量为_______ kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
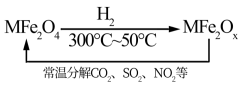
请写出MFe2Ox分解SO2的化学方程式_______ (可不配平)。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)
 2SO3(g)。某温度下,SO2的平衡转化率( α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率( α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于
②平衡状态由A变到B时,平衡常数K(A)
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);ΔH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);ΔH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:

请写出MFe2Ox分解SO2的化学方程式
您最近一年使用:0次



