通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
(1)按要求完成填空
a.2HCl(g) = H2(g)+Cl2(g);△H=______________________
b.N2 (g)+3H2(g)= 2NH3(g) ΔH=-92kJ/mol,则N—H键的键能是__________ kJ·mol
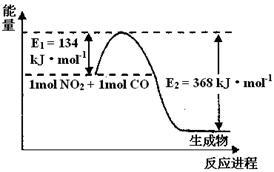
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式__________________________________
(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)=CO(g)+ 2H2O(l)ΔH =__________ (用含ΔH1、ΔH2、ΔH3的式子表示)
(4)已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H=-1644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H=-815.88kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式_______________________ 。
| 化学键 | Cl-Cl | H—H | H—Cl | N≡N |
| 键能/kJ·mol | 243 | 436 | 431 | 946 |
(1)按要求完成填空
a.2HCl(g) = H2(g)+Cl2(g);△H=
b.N2 (g)+3H2(g)= 2NH3(g) ΔH=-92kJ/mol,则N—H键的键能是
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式

(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)=CO(g)+ 2H2O(l)ΔH =
(4)已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H=-1644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H=-815.88kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式
10-11高一下·河北衡水·期末 查看更多[3]
(已下线)2010-2011学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2010—2011学年度本溪市第一中学高一下学期期末考试化学试卷宁夏育才中学2019-2020学年高二上学期第一次月考化学试题
更新时间:2011-06-22 15:15:23
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)⇌2NH3(g)ΔH<0,下列各项能说明该反应已经达到平衡状态的是______
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1 mol N≡N键的同时,生成6molN-H键
D.反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1
②2Ag(s)+1/2O2(g)=Ag2O(s)△H=-31.0kJ·mol-1
则 Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H=_____ kJ·mol-1
(3)已知两个热化学方程式
C(s)+O2(g)=CO2(g)△H=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol-1
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1 mol N≡N键的同时,生成6molN-H键
D.反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1
②2Ag(s)+1/2O2(g)=Ag2O(s)△H=-31.0kJ·mol-1
则 Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H=
(3)已知两个热化学方程式
C(s)+O2(g)=CO2(g)△H=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol-1
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】Ⅰ.(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ ΔH2。
Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
(2)肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1

试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为________ ,写出肼(l)和N2O4(l)反应的热化学方程式:___________________________________________________ 。
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是________ kJ。
Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
(2)肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1

试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是
您最近一年使用:0次
【推荐3】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。根据图回答下列问题:

(1)P和Cl2反应生成PCl3的热化学方程式是___ 。
(2)PCl5分解成PCl3和Cl2的热化学方程式是___ 。
(3)P和Cl2分两步反应生成1molPCl5的ΔH3。P和Cl2一步反应生成1molPCl5的ΔH4___ ΔH3(填“大于”、“小于”或“等于”)。

(1)P和Cl2反应生成PCl3的热化学方程式是
(2)PCl5分解成PCl3和Cl2的热化学方程式是
(3)P和Cl2分两步反应生成1molPCl5的ΔH3。P和Cl2一步反应生成1molPCl5的ΔH4
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】已知下列反应的热化学方程式:
①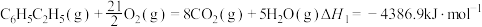
②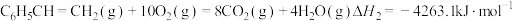
③
计算反应④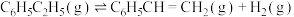 的
的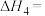
_____  ;
;
①
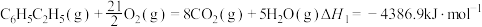
②
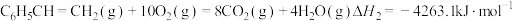
③

计算反应④
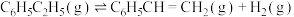 的
的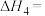
 ;
;
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】(1)8g CH4气体完全燃烧生成CO2气体和液态水放出445 kJ热量。
①写出表示甲烷燃烧热的热化学方程式____________________________________ 。
②若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量_____ 890 kJ( 填“>”、 “<”、“= ”)。
(2)已知在298K时:①C(石墨,s)+1/2O2(g)=CO(g) ΔH1=-111kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH2=-242kJ·mol-1
③C(石墨,s)+O2(g)=CO2(g) ΔH3=-394kJ·mol-1
利用盖斯定律,写出298K时一氧化碳与水蒸气转化为氢气和二氧化碳的热化学方程式:_________ 。
①写出表示甲烷燃烧热的热化学方程式
②若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量
(2)已知在298K时:①C(石墨,s)+1/2O2(g)=CO(g) ΔH1=-111kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH2=-242kJ·mol-1
③C(石墨,s)+O2(g)=CO2(g) ΔH3=-394kJ·mol-1
利用盖斯定律,写出298K时一氧化碳与水蒸气转化为氢气和二氧化碳的热化学方程式:
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题
(1)温室气体的利用是当前环境和能源领域的研究热点,CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1
2CO(g)+2H2(g) ΔH1
反应②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2KJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2KJ·mol-1
反应③CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
已知: O2(g)+H2(g)
O2(g)+H2(g) H2O(g) ΔH=-241.8kJ·mol-1,则ΔH1=
H2O(g) ΔH=-241.8kJ·mol-1,则ΔH1=_______ kJ·mol-1。
(2)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa,32.0gN2H4在氧气中完全燃烧生成水蒸气和氮气,放出热量624kJ(25°C),N2H4完全燃烧反应的热化学方程式是_______ 。
(1)温室气体的利用是当前环境和能源领域的研究热点,CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1
2CO(g)+2H2(g) ΔH1反应②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2KJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2KJ·mol-1反应③CH4(g)+
 O2(g)
O2(g) CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1已知:
 O2(g)+H2(g)
O2(g)+H2(g) H2O(g) ΔH=-241.8kJ·mol-1,则ΔH1=
H2O(g) ΔH=-241.8kJ·mol-1,则ΔH1=(2)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa,32.0gN2H4在氧气中完全燃烧生成水蒸气和氮气,放出热量624kJ(25°C),N2H4完全燃烧反应的热化学方程式是
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】CO2是一种廉价的碳资源,其综合利用具有重要意义,CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)  2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=___________ 。
 2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:
2CO(g)+2H2(g),已知上述反应中相关的化学键键能数据如下:| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)有关研究需要得到反应C3H8(g)=3C(石墨,s)+4H2(g)的△H,但测定实验难进行。设计如图1可计算得到:△H=____________________ (用图中其他反应的反应热表示)。

(2)已知在压强为a MPa、500℃下,2 mol H2和1 mol CO2在某密闭容器中反应,生成水和气态二甲醚CH3OCH3。其中CO2的转化率为60%,此过程中放出0.3Q kJ热量。此反应的热化学方程式为_________________________________________ 。
(3)下表是部分化学键的键能数据:
已知,白磷在空气中燃烧生产P4O10,白磷的燃烧热为d kJ⋅mol−1,白磷(P4)、P4O10结构如图所示,则上表中x=__________________ 。


(2)已知在压强为a MPa、500℃下,2 mol H2和1 mol CO2在某密闭容器中反应,生成水和气态二甲醚CH3OCH3。其中CO2的转化率为60%,此过程中放出0.3Q kJ热量。此反应的热化学方程式为
(3)下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ⋅mol−1) | a | b | c | x |

您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)表示甲醇完全燃烧热的的热化学方程式为________________ ;
(2)反应②中的能量变化如图所示,则ΔH2=__________ 。(用E1、E2的相关式子表示);

(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) △H2
NH4HCO3(aq) △H2
反应Ⅲ: (NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) △H3
2NH4HCO3(aq) △H3
则ΔH3与ΔH1 、ΔH2与之间的关系为ΔH3 =_________ ;
(4)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量:
已知反应N2(g)+3H2(g) 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值
2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值______ 。(注明“+”或“﹣”)。
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol(1)表示甲醇完全燃烧热的的热化学方程式为
(2)反应②中的能量变化如图所示,则ΔH2=

(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) △H2
NH4HCO3(aq) △H2反应Ⅲ: (NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq) △H3
2NH4HCO3(aq) △H3则ΔH3与ΔH1 、ΔH2与之间的关系为ΔH3 =
(4)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量:
| 化学键 | H﹣H | N﹣H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)
 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值
2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值
您最近一年使用:0次
【推荐2】CH4和CO2是引起温室效应的常见气体,CH4超干重整CO2是现在减少温室气体的一种有效方式,回答下面问题:
(1)实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是_______ 。
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有②④ B.仅有④ C.仅有②③④ D.全部符合要求
(2)在25℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=________ kJ·mol-1
(3)Ⅰ.CH4超干重整CO2过程中的能量变化图象如下图:
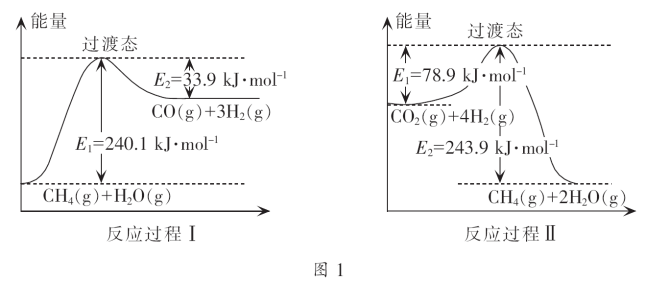
反应过程Ⅰ中发生的活化能是_______ kJ·mol-1,该反应的热化学方程式是______________ 。
反应过程Ⅱ中,CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=____________ kJ·mol-1
Ⅱ.CH4在某催化剂作用下超干重整CO2的转化如图2所示:
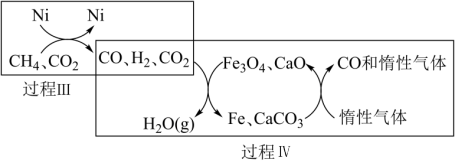
图2
①关于上述过程Ⅳ的说法不正确的是_____________ (填字母)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②写出过程Ⅲ的热化学方程式为:___________________ 。
(1)实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有②④ B.仅有④ C.仅有②③④ D.全部符合要求
(2)在25℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=
(3)Ⅰ.CH4超干重整CO2过程中的能量变化图象如下图:

反应过程Ⅰ中发生的活化能是
反应过程Ⅱ中,CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=
Ⅱ.CH4在某催化剂作用下超干重整CO2的转化如图2所示:

图2
①关于上述过程Ⅳ的说法不正确的是
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②写出过程Ⅲ的热化学方程式为:
您最近一年使用:0次
【推荐3】2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1,请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1,请回答下列问题:

(1)E的大小对该反应的反应热有无影响?__________ ,该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?__________ 。
(2)图中△H=__________ kJ·mol-1。
(3)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)放出的热量为__________ kJ。
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1,请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1,请回答下列问题:
(1)E的大小对该反应的反应热有无影响?
(2)图中△H=
(3)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)放出的热量为
您最近一年使用:0次



