常温下,下列有关电解质溶液叙述错误 的是
| A.某H2SO4溶液中c(OH-)/c(H+)=1.0×10-8,由水电离出的c(H+)=1×10-11mol·L-1 |
| B.将0.02mol·L-1盐酸与0.02mol·L-1Ba(OH)2溶液等体积混合后溶液pH约为12 |
| C.将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH一定大于7 |
| D.向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,溶液中c(HCO)先增大后减小 |
更新时间:2018-07-28 22:28:29
|
【知识点】 盐类水解的应用
相似题推荐
单选题
|
较难
(0.4)
【推荐1】根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
| B | 向BaSO4固体中加入饱和Na2CO3溶液,充分搅拌后,取沉淀(洗净)加入盐酸有气泡产生 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 向含酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去 | Na2CO3溶液中存在水解平衡 |
| D | 常温下,分别测量浓度均为0.1 mol·L−1的Na2SO3溶液和Na2CO3溶液的pH,后者的pH大 | 非金属性:C>S |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】已知下表为25℃时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32- |
| B.相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)=c(OH-)-c(H+) |
| C.25℃时,0.10mol·L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)=c(CO32-)+ c (HCO3-)+c(H2CO3) |
D.向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中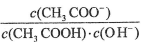 增大 增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】下列说法中正确的是
| A.常温下,在pH=3的CH3COOH溶液和pH=3的H2SO4溶液中,水的电离程度前者小于后者 |
| B.0.1 mol•L﹣1 CH3COONa溶液与0.05 mol•L﹣1盐酸等体积混合后的酸性溶液中:c(Cl﹣)>c(CH3COO﹣)>c(CH3COOH)>c(H+) |
| C.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9 ∶2(忽略溶液混合后的体积变化) |
| D.常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20 mL(忽略溶液混合后的体积变化) |
您最近一年使用:0次



