室温下,在pH=12的NaOH溶液中,由水电离生成的c(OH-)为
| A.1.0×10-7 mol·L-1 | B.1.0×10-6 mol·L-1 |
| C.1.0×10-2 mol·L-1 | D.1.0×10-12 mol·L-1 |
更新时间:2019-01-18 09:17:01
|
【知识点】 水溶液中水的电离程度及的计算解读
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】25℃时,在0.005mol·L-1的硫酸溶液中,水电离出的H+浓度是
| A.5×10-13mol·L-1 | B.0.02mol·L-1 | C.1×10-7mol·L-1 | D.1×10-12mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法中不正确的是
| A.pH相同的①CH3COONa②NaHCO3两种溶液中c(Na+):①>② |
| B.一定浓度的NaHS溶液中:c(Na+)+c(H+)=c(OH−)+c(HS−)+2c(S2−) |
| C.pH=a的氨水稀释至原体积的10倍后,其pH=b,则b>a−1 |
| D.室温下,甲、乙两烧杯均盛有5mLpH=2的一元酸溶液,向乙烧杯中加水稀释至pH=3,则甲、乙两烧杯中水电离出的c(OH−):10c(OH−)甲⩽c(OH−)乙 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】常温下,向20mL0.1mol/L氨水中滴加盐酸,溶液中由水电离出的c(H+)随加入盐酸体积的变化如图所示。则下列说法正确的是
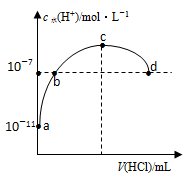

| A.b、d两点为恰好完全反应点 |
B.c点溶液中,c( )=c(Cl-) )=c(Cl-) |
C.a、b之间的任意一点:c(Cl-)>c( ),c(H+)>c(OH-) ),c(H+)>c(OH-) |
| D.常温下,0.1mol/L氨水的电离常数K约为1×10-5 |
您最近一年使用:0次



