常温下,向20mL0.1mol/L氨水中滴加盐酸,溶液中由水电离出的c(H+)随加入盐酸体积的变化如图所示。则下列说法正确的是
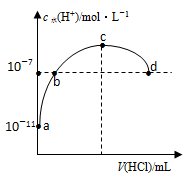

| A.b、d两点为恰好完全反应点 |
B.c点溶液中,c( )=c(Cl-) )=c(Cl-) |
C.a、b之间的任意一点:c(Cl-)>c( ),c(H+)>c(OH-) ),c(H+)>c(OH-) |
| D.常温下,0.1mol/L氨水的电离常数K约为1×10-5 |
2017·广东汕头·三模 查看更多[17]
河北省遵化市第一中学2023-2024学年高二上学期月考2化学试题浙江省温州市等2地浙江省江山市滨江高级中学2022-2023学年高二上学期11月期中考试化学试题(已下线)专项特训6 滴定过程的曲线分析浙江省衢温“5+1”联盟2022-2023学年高二上学期期中联考化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题(已下线)【浙江新东方】99(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】辽宁省大连市部分重点高中2019-2020学年高二上学期期中考试化学试题江西省九江市浔阳区九江市第七中学2020-2021学年高二上学期期中考试化学试题内蒙古包头市回民中学2020-2021学年高二上学期期中考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题09-2020年北京新高考化学模拟试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定的误差分析及拓展应用夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定的误差和曲线分析备考突破2020高三化学专题强化集训——酸碱中和滴定及其拓展江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题(已下线)专题8.2 水的电离和溶液的pH(讲)-《2020年高考一轮复习讲练测》广东省汕头市2017届高三第三次模拟考试理科综合化学试题
更新时间:2020/12/19 16:58:24
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】室温下,向20mL0.1mol·L1叠氮酸(HN3)溶液中滴加pH=13的NaOH溶液,水电离c(H)与NaOH溶液体积的关系如图所示,下列说法正确的是
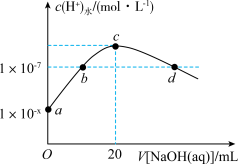
| A.在a、b、c、d中,水的电离度最大的是d |
| B.在c点对应溶液中:c(OH-)=c(H)+c(HN3) |
| C.b点和d点对应溶液的pH相等 |
| D.室温下,电离常数Ka(HN3)= 1×101−2x |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】人体血液中存在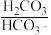 、
、 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示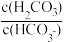 或
或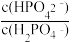 与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是
与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是

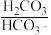 、
、 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示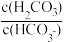 或
或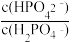 与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是
与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是
A.曲线I表示lg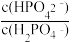 与pH的变化关系 与pH的变化关系 |
| B.a→b的过程中,水的电离程度逐渐减小 |
C.当pH增大时,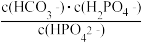 逐渐减小 逐渐减小 |
| D.当c(H2CO3)=c(HCO3-)时,c(HPO42-)=c(H2PO4-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列说法正确的是
| A.ΔH>0、ΔS>0的反应在低温下能自发进行 |
B.0.2mol·L-1氨水和0.2mol·L-1NH4HCO3溶液等体积混合:c(NH )+c(NH3·H2O)=c(H2CO3)+c(HCO )+c(NH3·H2O)=c(H2CO3)+c(HCO )+c(CO )+c(CO ) ) |
| C.25℃时,某盐溶液中由水电离出的c(H+)=1×10-amol·L-1,则该溶液的pH可能为a或14-a |
| D.0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下浓度均为 的四种盐溶液,其
的四种盐溶液,其 如表所示,下列说法正确的是
如表所示,下列说法正确的是
 的四种盐溶液,其
的四种盐溶液,其 如表所示,下列说法正确的是
如表所示,下列说法正确的是| 序号 | ① | ② | ③ | ④ |
| 溶液 |  |  |  |  |
 | 8.8 | 9.7 | 11.6 | 10.3 |
A.等浓度的 和 和 溶液, 溶液, 小的是 小的是 |
| B.四种溶液中水的电离程度:③>④>②>① |
C. 在溶液中电离程度大于水解程度 在溶液中电离程度大于水解程度 |
D. 溶液中有: 溶液中有: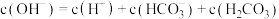 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法正确的是
A.0.1mol/LNa2CO3溶液中存在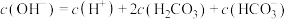 |
B.0.1mol/LNa2SO3溶液中,c(Na+) = 2c(SO ) + c(HSO ) + c(HSO ) + c(H2SO3) ) + c(H2SO3) |
C.碳酸氢钠溶液中有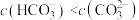 |
D.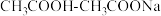 混合溶液 混合溶液 :c(Na+) >c( :c(Na+) >c( ) >c(CH3COO-) >c(H+) ) >c(CH3COO-) >c(H+) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。25℃时,向40ml浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是


| A.a点溶液中,c(CH3COO-)数量级约为10-5 |
| B.b点溶液中,c(NH4+) < c(CH3COOH) |
| C.c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-) |
| D.d点水的电离程度大于c点 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列大小比较正确的是
| A.接受H+的能力:CH3COO-> HCO3->ClO- |
| B.25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度 |
| C.0.1mol/L的(NH4)2CO3溶液中c(NH4+)等于0.1mol/L的NH4Cl溶液中c(NH4+)的2倍 |
| D.四氯化碳分子中的键角大于白磷分子中的键角 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列各溶液中,微粒的物质的量浓度关系正确的是
A.   的 的 溶液中: 溶液中: |
B.在 溶液中一定有: 溶液中一定有: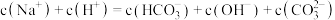 |
C. 相等的 相等的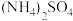 溶液、 溶液、 溶液和 溶液和 溶液: 溶液: |
D.10mL 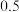   溶液与10 mL 1 溶液与10 mL 1  盐酸混合: 盐酸混合: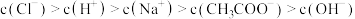 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】298K时,在20mL0.1mol•L-1H2R稀溶液中滴入相同浓度的NaOH溶液,用pH传感器测得混合溶液的pH变化曲线如图所示(已知的H2R的Ka2为1.0×10-10),下列有关叙述正确的是


| A.H2R的Ka1约为1.0×10-3 |
| B.a点存在:c(HR-)>c(R2-) |
| C.b点时:c(Na+)>c(HR-)>c(R2-)>c(H2R) |
| D.c点时:2c(H+)+3c(H2R)+c(HR-)=2c(OH-)+c(R2-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】已知HClO Ka=3.0×10-8,H2CO3 Ka1=4.1×10-7 Ka2=5.6×10-11试判断下列反应的离子方程式书写正确的是
A.硫酸铝溶液中加过量氨水:Al3++4NH3·H2O=AlO +4NH +4NH +2H2O +2H2O |
B.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO |
C.惰性电极电解MgCl2水溶液Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑ Mg(OH)2↓+H2↑+Cl2↑ |
D.澄清石灰水与足量小苏打溶液混合:Ca2++OH-+HCO =CaCO3↓+H2O =CaCO3↓+H2O |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】化学上常用AG表示溶液中的 。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
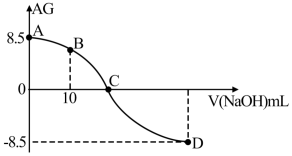
 。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
| A.HNO2为一元弱酸 |
B.D点溶液的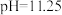 |
| C.C点之前溶液显碱性,C点之后溶液显酸性 |
D.25℃时,HNO2的电离常数 |
您最近半年使用:0次

 )>c(CH3COO- )
)>c(CH3COO- ) )>c(H2CO3)
)>c(H2CO3)

